Kiến thức chuyên môn
Ancol Etylic (C2H5OH) Là Gì? Tính Chất, Điều Chế & Ứng Dụng 2026
Bạn đang cầm trên tay một chai cồn 90 độ, hay đang đổ xăng E5 vào xe máy, hoặc đơn giản là đang giải bài tập Hóa học lớp 11 về phản ứng este hóa? Tất cả đều liên quan đến một “nhân vật” đình đám trong thế giới hóa học: Ancol Etylic.
Với kinh nghiệm hơn 20 năm trong ngành kỹ thuật hóa chất và điện phân, tôi nhận thấy có quá nhiều sự nhầm lẫn tai hại về hợp chất này. Bài viết dưới đây không chỉ là một trang định nghĩa khô khan. Nó là bản hướng dẫn toàn diện từ A-Z, giúp bạn hiểu sâu sắc bản chất Ancol Etylic là gì, cách nó vận hành trong phản ứng hóa học và ứng dụng thực chiến trong đời sống 2026.

Ancol Etylic tinh khiết (Ethanol) là chất lỏng không màu, được ứng dụng rộng rãi từ y tế đến công nghiệp.
Tổng Quan Về Ancol Etylic ( )
)
Trước khi đi sâu vào các phản ứng phức tạp, chúng ta cần “giải phẫu” cấu trúc của nó. Trong thuật ngữ chuyên ngành, chúng tôi gọi nó là Ancol Etylic, nhưng cái tên dân dã “Cồn” hay “Rượu” lại phổ biến hơn cả.
Công thức và Cấu tạo phân tử
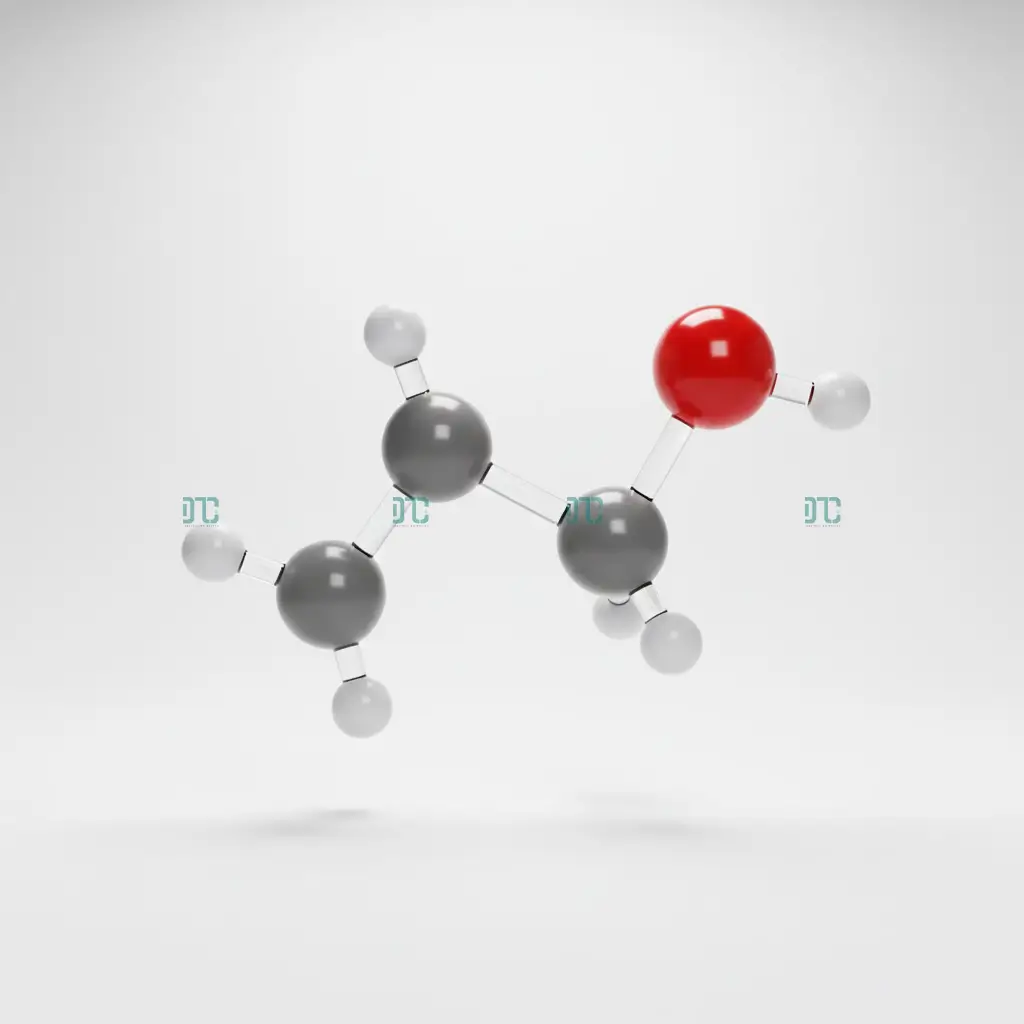
Mô hình phân tử Ethanol: Liên kết O-H phân cực chính là “chìa khóa” tạo nên tính chất hóa học đặc trưng.
Ancol etylic có công thức phân tử là ![]() . Tuy nhiên, để thể hiện rõ tính chất hóa học, chúng ta thường viết dưới dạng công thức cấu tạo thu gọn:
. Tuy nhiên, để thể hiện rõ tính chất hóa học, chúng ta thường viết dưới dạng công thức cấu tạo thu gọn:
![]()
hoặc viết chi tiết:
![]()
Tại sao cấu tạo này lại quan trọng? Bởi vì trong phân tử có một nguyên tử Hydro (H) linh động liên kết với nguyên tử Oxygen (O) trong nhóm chức Hydroxyl (-OH). Chính liên kết phân cực này là “chìa khóa” tạo nên mọi tính chất hóa học đặc trưng mà chúng ta sẽ bàn ở phần sau. Đây cũng là điểm khác biệt cốt lõi giúp phân biệt nó với người anh em đồng phân là Đimetyl Ete (![]() ) – một chất khí gây mê, không tác dụng với Natri.
) – một chất khí gây mê, không tác dụng với Natri.
Phân Tích Tính Chất Lý – Hóa (Expert Insights)
Đối với các bạn học sinh hay kỹ sư vận hành, đây là phần cốt lõi cần nắm vững. Sai một ly đi một dặm, đặc biệt là khi tính toán nhiệt lượng cháy hoặc pha chế dung môi.
Tính chất vật lý & Hiện tượng liên kết Hydro
- Trạng thái: Chất lỏng không màu, trong suốt, nhẹ hơn nước.
- Mùi vị: Mùi thơm đặc trưng nhẹ, vị cay nồng.
- Nhiệt độ sôi:
 .
.
❓ Câu hỏi tư duy: Tại sao Ancol Etylic (
) lại có nhiệt độ sôi cao hơn nhiều so với Ete (
) hoặc dẫn xuất halogen có cùng khối lượng phân tử?
💡 Giải đáp: Đó là nhờ Liên kết Hydro. Các phân tử Ethanol tạo thành liên kết liên phân tử bền vững với nhau, đòi hỏi năng lượng nhiệt lớn hơn để phá vỡ. Đây cũng là lý do Ethanol có độ tan vô hạn trong nước (do tạo liên kết Hydro với nước).
Khái niệm Độ rượu:
Trong thực tế, bạn thường nghe nói “rượu 40 độ” hay “cồn 90 độ”. Để hiểu rõ hơn về cách tính toán này trong pha chế, bạn có thể tham khảo bài viết chi tiết về độ rượu là gì.
Công thức tính:
![]()
Tính chất hóa học (Full phương trình)
Các phản ứng dưới đây là minh chứng rõ nhất cho sự linh động của nguyên tử H trong nhóm -OH.
a. Phản ứng thế với kim loại kiềm (Đặc trưng)
Ethanol tác dụng với các kim loại mạnh như Natri (Na), Kali (K) giải phóng khí Hydro. Đây là phản ứng dùng để nhận biết ancol.
![]()
b. Phản ứng cháy (Oxi hóa hoàn toàn)
Khi cháy, Ethanol tham gia phản ứng tỏa nhiệt rất lớn và không sinh ra khí độc như xăng dầu khoáng, nên được ứng dụng làm nhiên liệu sạch.
![]()
Khí sinh ra chủ yếu là CO2 (Carbon Dioxide) và hơi nước, ít gây hại cho môi trường hơn so với nhiên liệu hóa thạch.
c. Phản ứng tách nước (Tùy điều kiện nhiệt độ)
Đây là điểm “bẫy” mà học sinh thường sai. Sử dụng Axit Sunfuric (![]() ) đặc làm chất xúc tác sẽ cho ra 2 sản phẩm khác nhau tùy nhiệt độ:
) đặc làm chất xúc tác sẽ cho ra 2 sản phẩm khác nhau tùy nhiệt độ:
- Ở
 : Tách nước nội phân tử tạo Anken, cụ thể là Etilen (
: Tách nước nội phân tử tạo Anken, cụ thể là Etilen ( ).
).
![Rendered by QuickLaTeX.com \[C_2H_5OH \xrightarrow{H_2SO_4, 170^\circ C} C_2H_4 + H_2O\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20281%2023%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
- Ở
 : Tách nước liên phân tử tạo Ete.
: Tách nước liên phân tử tạo Ete.
![Rendered by QuickLaTeX.com \[2C_2H_5OH \xrightarrow{H_2SO_4, 140^\circ C} C_2H_5-O-C_2H_5 + H_2O\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20390%2023%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
(Đietyl ete)
d. Phản ứng Este hóa
Phản ứng thuận nghịch với axit hữu cơ tạo ra este có mùi thơm (dùng trong công nghiệp hương liệu). Điển hình là phản ứng với Acid Acetic:
![]()
e. Phản ứng oxi hóa không hoàn toàn
Khi đun nóng với CuO, Ethanol bị oxi hóa thành Andehit Axetic (![]() ), nhận biết qua phản ứng tráng gương sau này.
), nhận biết qua phản ứng tráng gương sau này.
Quy Trình Điều Chế: Từ Truyền Thống Đến Hiện Đại
Thế giới sản xuất hàng tỷ lít Ethanol mỗi năm. Vậy họ lấy nó từ đâu?

Quy trình sản xuất Ethanol công nghiệp hiện đại thông qua phương pháp lên men và chưng cất phân đoạn.
Phương pháp sinh hóa (Lên men)
Đây là phương pháp cổ xưa nhất, sử dụng nguồn nguyên liệu giàu tinh bột (gạo, ngô, sắn) hoặc đường như mật rỉ đường, mía. Dưới tác dụng của enzyme trong nấm men, đường chuyển hóa thành rượu.
Quy trình tóm tắt:
Tinh bột ![]() Glucose
Glucose ![]() Ethanol
Ethanol ![]() .
.
![]()
Sản phẩm thu được sau lên men chỉ đạt nồng độ thấp. Để có cồn 90 độ hay Ethanol 96%, người ta phải thực hiện chưng cất phân đoạn nhiều lần.
Phương pháp hóa học (Công nghiệp)
Ở quy mô công nghiệp hóa dầu, để sản xuất lượng lớn cồn kỹ thuật giá rẻ, người ta dùng phản ứng cộng nước vào khí Ethylene (sản phẩm cracking dầu mỏ).
![]()
Ma Trận Phân Loại Cồn: Đừng Mua Nhầm!
Là người mua hàng thông minh, bạn cần phân biệt rõ các loại cồn để sử dụng đúng mục đích và tiết kiệm chi phí.
| Tiêu chí | Cồn Thực Phẩm (Food Grade) | Cồn Công Nghiệp (Industrial) | Cồn Y Tế |
|---|---|---|---|
| Nồng độ | 96% – 98% (Tinh khiết) | 90% – 96% (Có tạp chất) | 70 độ hoặc 90 độ |
| Tạp chất | Đã loại bỏ gần hết este, andehit, metanol. | Chứa nhiều Methanol, andehit độc hại. | Pha từ cồn tinh khiết + nước cất. |
| Ứng dụng | Pha rượu, ngâm thuốc, phụ gia thực phẩm. | Dung môi pha sơn, đốt lò (làm cồn khô). | Sát trùng vết thương, dụng cụ. |
| Cảnh báo | Uống được (sau khi pha loãng). | TUYỆT ĐỐI KHÔNG UỐNG. | Dùng ngoài da. |
Top 5 Ứng Dụng Thực Tiễn Thay Đổi Đời Sống
Ancol Etylic không chỉ nằm trong phòng thí nghiệm, nó đang vận hành thế giới xung quanh bạn với vai trò là một dung môi và nhiên liệu quan trọng.
- Nhiên liệu Xanh (Xăng sinh học E5): E5 nghĩa là 5% Ethanol pha với 95% xăng A92. Đây là một dạng nhiên liệu lỏng sạch, giúp tăng chỉ số Octan, giúp nhiên liệu cháy triệt để hơn, giảm khí thải gây hiệu ứng nhà kính.
- Y tế & Dược phẩm: Là dung môi số 1 để bào chế thuốc, cồn iot, thuốc ngủ. Đặc biệt, cồn 70 độ được chứng minh khả năng diệt virus, vi khuẩn tốt hơn cồn 90 độ do khả năng thẩm thấu vào tế bào vi sinh vật chậm mà chắc.
- Công nghiệp Thực phẩm: Dùng làm dung môi chiết xuất hương liệu (vanilla), chất bảo quản chống nấm mốc trong bánh kẹo (như quy trình xử lý maltodextrin đôi khi cần dung môi tinh khiết), và dĩ nhiên là “linh hồn” của các loại bia rượu.
- Sản xuất Giấm ăn: Từ rượu etylic loãng, dưới tác dụng của men giấm và oxi, ta thu được Acid Acetic (giấm ăn) theo phản ứng lên men giấm.
- Mỹ phẩm: Là dung môi chính trong nước hoa (giúp hương thơm bay hơi tỏa xa), lăn khử mùi và kem dưỡng da (làm se lỗ chân lông).
CẢNH BÁO SOS: Phân Biệt Ethanol vs Methanol
☠️ Hiểm họa từ “Rượu giả” Methanol
Đây là phần quan trọng nhất liên quan đến tính mạng (YMYL). Rất nhiều gian thương vì lợi nhuận đã dùng Ancol Metylic (Methanol – ![]() ) để pha rượu thay vì Ethanol. Giá Methanol rẻ hơn một nửa, nhưng độc tính thì gấp trăm lần.
) để pha rượu thay vì Ethanol. Giá Methanol rẻ hơn một nửa, nhưng độc tính thì gấp trăm lần.
Tại sao Methanol độc? Khi vào cơ thể, Methanol bị gan chuyển hóa thành Formaldehyde (Andehit Fomic) và Axit Fomic. Các chất này tấn công dây thần kinh thị giác gây mù lòa vĩnh viễn, suy thận và tử vong nhanh chóng.
Dấu hiệu nhận biết:
- Methanol: Có mùi hắc nhẹ hơn Ethanol, khi đốt ngọn lửa có màu xanh nhạt đôi khi hơi lẫn trắng (rất khó nhìn). Khi uống vào gây đau đầu dữ dội, mờ mắt.
- Ethanol: Khi đốt cháy cho ngọn lửa màu xanh lam và vàng ở ngọn (dễ nhìn).
Lời khuyên chuyên gia: Không mua cồn trôi nổi không nhãn mác. Cần tuân thủ quy định ghi nhãn hóa chất theo GHS để nhận diện nguy hiểm.
Báo Giá & Lưu Ý Bảo Quản 2026
Giá cồn công nghiệp và thực phẩm biến động theo giá xăng dầu và nguyên liệu (sắn, ngô). Dưới đây là mức giá tham khảo trung bình trên thị trường B2B:
- Cồn thực phẩm (96%): 25.000đ – 35.000đ/lít.
- Cồn công nghiệp (Methanol/Ethanol biến tính): 12.000đ – 18.000đ/lít.
- Cồn y tế (chai nhỏ): 5.000đ – 10.000đ/chai 50ml.
Bảo quản: Ethanol là chất siêu dễ cháy (Flash point 13°C). Chỉ cần một tia lửa điện nhỏ cũng có thể gây hỏa hoạn. Bắt buộc bảo quản hóa chất nơi thoáng mát, tránh xa nguồn nhiệt, ổ điện và phải có bình chữa cháy CO2 hoặc bột bên cạnh. Lưu ý: Không dùng nước để chữa cháy xăng/cồn vì cồn nhẹ hơn nước sẽ nổi lên và tiếp tục cháy lan.
Câu Hỏi Thường Gặp (FAQ)
Q: Uống cồn y tế 90 độ pha loãng có sao không?
A: Rất nguy hiểm. Mặc dù thành phần chính là Ethanol, nhưng cồn y tế không được kiểm soát chặt chẽ về tạp chất như cồn thực phẩm. Nó có thể chứa andehit, furfural gây hại gan thận.
Q: Làm sao đổi độ rượu sang độ cồn %?
A: Về cơ bản độ rượu (![]() ) và nồng độ phần trăm thể tích (%) là tương đương nhau trong cách gọi thông thường. 40 độ nghĩa là 40% thể tích là rượu nguyên chất.
) và nồng độ phần trăm thể tích (%) là tương đương nhau trong cách gọi thông thường. 40 độ nghĩa là 40% thể tích là rượu nguyên chất.
Q: Ancol etylic có làm đổi màu quỳ tím không?
A: Không. Ancol etylic có tính axit cực yếu (yếu hơn cả nước), không phân ly ra ion ![]() đủ để làm đổi màu giấy quỳ tím.
đủ để làm đổi màu giấy quỳ tím.
Bạn cần nguồn cung Ancol Etylic Chất lượng cao?
Chúng tôi cung cấp Ethanol thực phẩm, Cồn công nghiệp và Cồn y tế với đầy đủ chứng nhận COA, MSDS. Cam kết đúng nồng độ, an toàn và giá thành cạnh tranh nhất thị trường.
Ghé thăm cửa hàng hóa chất gần đây của Doanh Tín hoặc liên hệ trực tiếp để được tư vấn.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









