Kiến thức chuyên môn
Phản ứng este hóa: Cơ chế, yếu tố ảnh hưởng và ứng dụng thực tế
Phản ứng este hóa là một trong những phản ứng quan trọng trong hóa học hữu cơ, đóng vai trò thiết yếu trong nhiều lĩnh vực công nghiệp như sản xuất hương liệu, dược phẩm, nhựa và dung môi. Để hiểu rõ hơn về phản ứng này, chúng ta sẽ cùng tìm hiểu về cơ chế phản ứng, các yếu tố ảnh hưởng và ứng dụng thực tiễn của nó.
Phản ứng este hóa là gì?
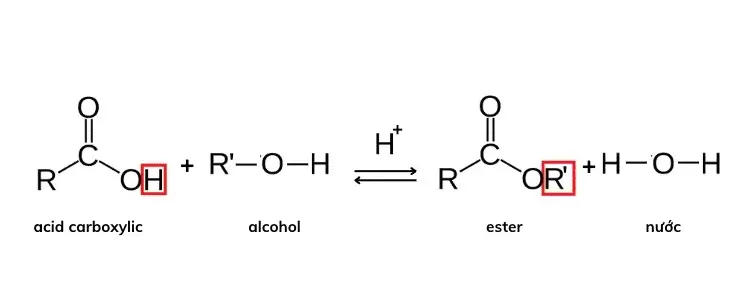
Phản ứng este hóa là quá trình axit cacboxylic phản ứng với ancol để tạo thành este và nước dưới tác động của chất xúc tác axit mạnh. Đây là một phản ứng thuận nghịch, có nghĩa là nó có thể diễn ra theo cả hai chiều, tùy thuộc vào điều kiện phản ứng.
Phương trình tổng quát của phản ứng este hóa:
RCOOH+R′OH⇌RCOOR′+H2ORCOOH + R’OH \rightleftharpoons RCOOR’ + H_2O
Trong đó:
- RCOOH: Axit cacboxylic
- R’OH: Ancol
- RCOOR’: Este tạo thành
Vai trò của phản ứng este hóa
- Trong công nghiệp: Sản xuất hương liệu, dung môi, nhựa, polyme.
- Trong đời sống: Tổng hợp este có mùi thơm dùng trong thực phẩm, nước hoa.
- Trong nghiên cứu: Giúp cải tiến vật liệu sinh học và hóa học xanh.
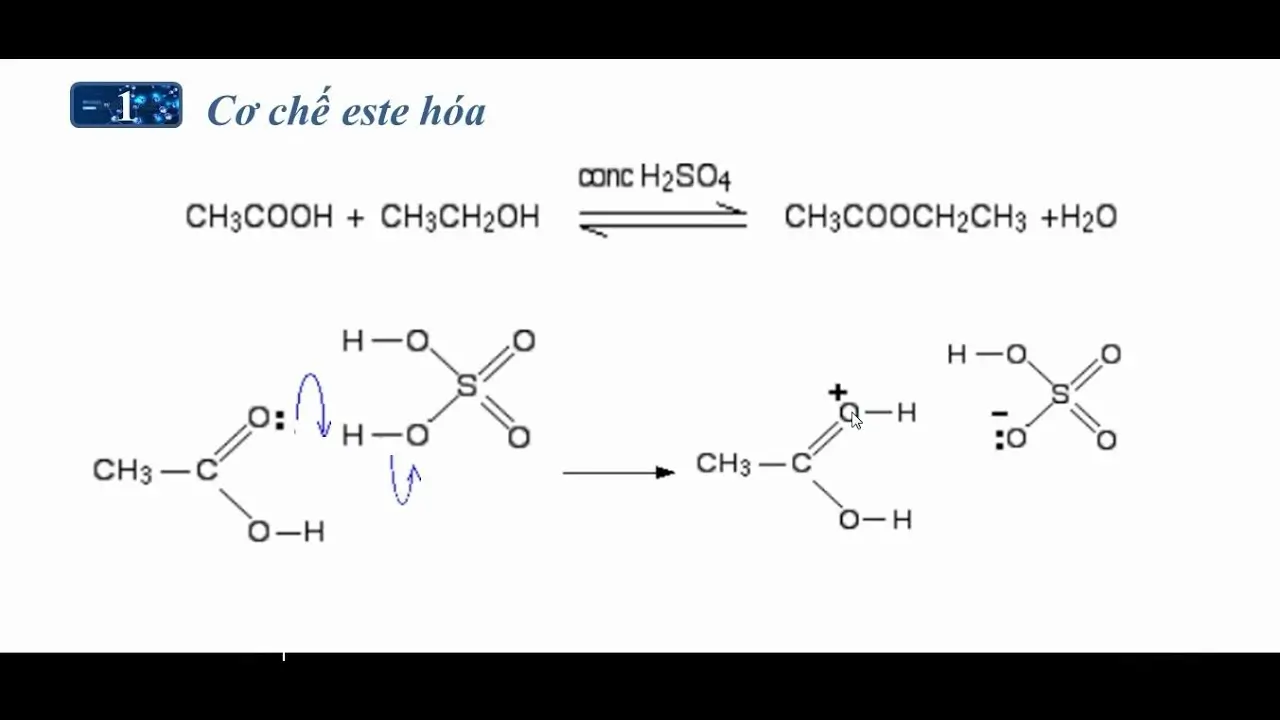
Cơ chế của phản ứng este hóa
Phản ứng este hóa diễn ra theo cơ chế nucleophin, gồm các bước sau:
- Proton hóa nhóm carbonyl: Nhóm -COOH của axit cacboxylic nhận proton từ axit xúc tác, làm tăng tính dương điện của carbon.
- Tấn công nucleophin: Nhóm -OH của ancol tấn công vào carbonyl của axit.
- Tạo sản phẩm trung gian: Một cấu trúc trung gian được hình thành.
- Mất proton: Hệ thống trở về trạng thái bền vững, giải phóng este và nước.
Các yếu tố ảnh hưởng đến phản ứng este hóa
1. Nhiệt độ
- Nhiệt độ cao giúp tăng tốc độ phản ứng.
- Tuy nhiên, nếu quá cao, có thể làm bay hơi các chất tham gia, giảm hiệu suất.
2. Nồng độ chất tham gia
- Sử dụng dư axit cacboxylic hoặc ancol giúp đẩy cân bằng về phía tạo este.
3. Chất xúc tác
- Axit sulfuric (H₂SO₄) là chất xúc tác phổ biến giúp đẩy nhanh phản ứng.
- Ngoài ra, có thể sử dụng axit hữu cơ hoặc nhựa trao đổi ion trong công nghiệp.
4. Loại bỏ nước
- Do phản ứng thuận nghịch, nếu loại bỏ nước liên tục, sẽ giúp cân bằng dịch chuyển theo hướng tạo este, tăng hiệu suất.
👉Xem thêm: Kali Nitrat (KNO₃)
Ứng dụng của phản ứng este hóa
1. Sản xuất hương liệu và nước hoa
- Các este như etyl axetat, butyl axetat có mùi thơm đặc trưng, được sử dụng trong nước hoa, thực phẩm.
2. Dung môi công nghiệp
- Este là thành phần chính trong sơn, keo dán, mực in, giúp hòa tan và bay hơi nhanh chóng.
3. Tổng hợp chất dẻo và polyme
- Polyester, polycarbonate là những loại nhựa có nguồn gốc từ este, ứng dụng trong sản xuất chai nhựa, sợi vải tổng hợp.
4. Dược phẩm và mỹ phẩm
- Aspirin (axit acetylsalicylic) là một sản phẩm từ phản ứng este hóa.
- Benzyl axetat có hương thơm nhẹ, được dùng trong mỹ phẩm.
5. Sản xuất biodiesel
- Este hóa giúp chuyển hóa axit béo tự do thành methyl ester, tạo ra nhiên liệu sinh học.
Phản ứng este hóa trong công nghiệp
1. Quy trình sản xuất este quy mô lớn
- Sử dụng xúc tác rắn thay vì axit lỏng để giảm ô nhiễm.
- Loại bỏ nước bằng hệ thống chưng cất phân đoạn để tối ưu hiệu suất.
2. Các phương pháp tách và tinh chế sản phẩm
- Chiết lỏng-lỏng để loại bỏ tạp chất.
- Chưng cất chân không để thu este tinh khiết.
So sánh phản ứng este hóa và phản ứng xà phòng hóa
| Tiêu chí | Phản ứng este hóa | Phản ứng xà phòng hóa |
|---|---|---|
| Chất tham gia | Axit cacboxylic + Ancol | Este + Bazơ mạnh (NaOH/KOH) |
| Sản phẩm | Este + Nước | Muối của axit béo (xà phòng) + Ancol |
| Môi trường | Axit | Kiềm |
| Tính thuận nghịch | Có | Không |
| Ứng dụng | Hương liệu, dung môi, polyme | Sản xuất xà phòng |
Các loại este phổ biến và đặc điểm của chúng
- Este đơn giản: Dễ bay hơi, có mùi thơm (etyl axetat, metyl butanoat).
- Este phức tạp: Ít bay hơi, bền hơn (phthalate, polyester).
Tác động môi trường và an toàn trong phản ứng este hóa
1. Ảnh hưởng đến môi trường
- Axit sulfuric dư có thể gây ô nhiễm nguồn nước.
- Dung môi hữu cơ có thể ảnh hưởng đến sức khỏe.
2. Biện pháp xử lý chất thải
- Tái chế dung môi, xử lý nước thải bằng oxy hóa nâng cao.
- Sử dụng chất xúc tác thân thiện với môi trường.
3. An toàn lao động
- Mang găng tay, kính bảo hộ khi làm việc với hóa chất.
- Hệ thống thông gió tốt trong phòng thí nghiệm, nhà máy.
Kết luận
Phản ứng este hóa có vai trò quan trọng trong nhiều lĩnh vực từ công nghiệp đến đời sống. Việc hiểu rõ cơ chế, yếu tố ảnh hưởng giúp tối ưu hóa quy trình sản xuất, nâng cao hiệu suất và đảm bảo an toàn. Nếu bạn muốn tìm hiểu thêm kiến thức chuyên môn về các giải pháp hóa chất an toàn, hãy ghé thăm hoachatdoanhtin.com để khám phá thêm nhiều nội dung hữu ích!

 English
English




