Kiến thức chuyên môn
Amin Là Gì? Cấu Trúc, Phân Loại & Ứng Dụng Chi Tiết 2025
Trong thế giới hóa học hữu cơ, amin là một trong những nhóm hợp chất quan trọng và có ứng dụng rộng rãi nhất. Chúng là chìa khóa để tạo ra từ dược phẩm, thuốc nhuộm đến các hợp chất sinh học thiết yếu. Bài viết này sẽ cung cấp một cái nhìn toàn diện, chi tiết và dễ hiểu nhất về amin, giúp bạn nắm vững kiến thức nền tảng chỉ trong vài phút.
Amin Là Gì? Định Nghĩa Toàn Diện
Amin là hợp chất hữu cơ chứa nguyên tử nitơ (N), được coi là dẫn xuất của amoniac (NH₃) khi một hay nhiều nguyên tử hydro được thay thế bằng gốc hydrocarbon. Đặc trưng cơ bản nhất của amin là tính bazơ do cặp electron tự do trên nguyên tử nitơ.
Cấu trúc của amin hình thành khi một hoặc nhiều nguyên tử hydro (H) trong phân tử amoniac được thay thế bằng các nhóm hydrocarbon (ký hiệu là R), có thể là gốc alkyl (no) hoặc aryl (thơm).
Công thức tổng quát của chúng thể hiện rõ sự thay thế này:
- Amin bậc 1: R-NH₂
- Amin bậc 2: R₂-NH
- Amin bậc 3: R₃-N
Điểm đặc trưng nhất trong cấu trúc của amin là sự hiện diện của một cặp electron tự do (lone pair) trên nguyên tử nitơ. Cặp electron này quyết định đến tính bazơ của amin, giúp chúng có khả năng nhận proton (H⁺) khi phản ứng với axit, tạo thành muối amoni.
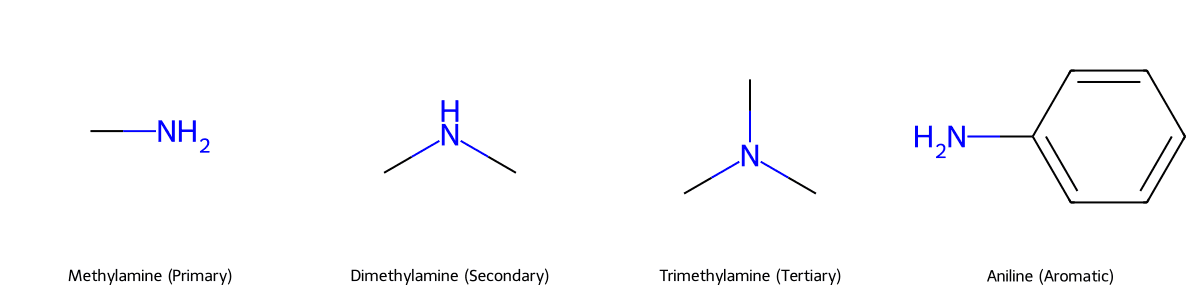
Phân Loại Amin: Cách Nhận Biết Chính Xác
Amin được phân loại theo hai cách chính: 1. Dựa vào bậc của amin (số gốc hydrocarbon liên kết với nitơ), chia thành amin bậc 1, 2, 3. 2. Dựa vào bản chất gốc hydrocarbon, chia thành amin béo (gốc alkyl) và amin thơm (gốc aryl).
Việc phân loại amin giúp chúng ta hiểu rõ hơn về tính chất và khả năng phản ứng của chúng. Có hai cách phân loại chính:
Dựa vào bậc của amin:
Bậc của amin là số lượng gốc hydrocarbon liên kết trực tiếp với nguyên tử nitơ. Amin bậc 1 có một gốc, bậc 2 có hai gốc và bậc 3 có ba gốc.
- Amin bậc 1: Chỉ có một gốc hydrocarbon gắn vào nitơ (ví dụ: Methylamin, CH₃NH₂).
- Amin bậc 2: Có hai gốc hydrocarbon gắn vào nitơ (ví dụ: Dimethylamin, (CH₃)₂NH).
- Amin bậc 3: Có ba gốc hydrocarbon gắn vào nitơ (ví dụ: Trimethylamin, (CH₃)₃N).
Dựa vào bản chất của gốc hydrocarbon:
Amin béo chứa gốc hydrocarbon no, không có vòng benzen, trong khi amin thơm có ít nhất một vòng benzen gắn trực tiếp vào nguyên tử nitơ.
- Amin béo (Aliphatic): Gốc hydrocarbon là các nhóm alkyl, không chứa vòng benzen (ví dụ: ethylamin, CH₃CH₂NH₂).
- Amin thơm (Aromatic): Có ít nhất một gốc hydrocarbon là nhóm aryl (chứa vòng benzen) gắn trực tiếp vào nitơ. Anilin (C₆H₅NH₂) là ví dụ tiêu biểu và quan trọng nhất.
Tính Chất Nổi Bật Của Amin
Amin có tính chất vật lý đa dạng (khí, lỏng, rắn) và mùi tanh đặc trưng. Về hóa học, tính chất quan trọng nhất là tính bazơ, với amin béo mạnh hơn amoniac và amin thơm yếu hơn amoniac.
Tính chất vật lý:
- Trạng thái: Các amin có phân tử khối thấp (như methylamin, ethylamin) là những chất khí ở điều kiện thường, có mùi khai và tanh tương tự amoniac. Các amin cao hơn ở dạng lỏng hoặc rắn.
- Mùi: Mùi tanh đặc trưng, thường thấy ở cá (nguyên nhân chính là do trimethylamin và các amin khác sinh ra từ sự phân hủy protein).
- Độ tan: Amin bậc thấp tan tốt trong nước do khả năng tạo liên kết hydro. Khi phân tử khối tăng, độ tan giảm dần do phần kỵ nước của gốc hydrocarbon lớn hơn. Anilin gần như không tan trong nước.
Tính chất hóa học: Tính Bazơ
Đây là tính chất quan trọng nhất và là “linh hồn” của các amin. Do có cặp electron chưa liên kết trên nitơ, amin hoạt động như một bazơ Lewis, dễ dàng nhận proton (H⁺) từ axit.
- Phản ứng với axit: Amin phản ứng với các axit mạnh như HCl hoặc H₂SO₄ để tạo thành muối amoni tan trong nước.
Ví dụ: CH₃NH₂ + HCl ⟶ CH₃NH₃Cl (Metylamoni clorua) - Tác dụng với dung dịch muối: Dung dịch amin có thể tác dụng với muối của các kim loại có hidroxit kết tủa.
Ví dụ: 3CH₃NH₂ + 3H₂O + FeCl₃ ⟶ Fe(OH)₃↓ + 3CH₃NH₃Cl - Độ mạnh của tính bazơ: Độ mạnh bazơ được đo bằng hằng số pKb (pKb càng nhỏ, bazơ càng mạnh).
- Amin béo có tính bazơ mạnh hơn amoniac (pKb của Metylamin ≈ 3.36, trong khi của NH₃ ≈ 4.75).
- Anilin (amin thơm) có tính bazơ rất yếu, yếu hơn cả amoniac (pKb ≈ 9.3), do ảnh hưởng hút electron của vòng benzen. Dung dịch anilin không làm đổi màu giấy quỳ tím hay phenolphtalein.
So Sánh Các Loại Amin
| Loại Amin | Ưu Điểm | Nhược Điểm | Ví Dụ | Ứng Dụng Tiêu Biểu |
|---|---|---|---|---|
| Bậc 1 | Bazơ mạnh, tan nước tốt (phân tử khối thấp), dễ tham gia phản ứng. | Dễ bay hơi, mùi mạnh, hoạt tính cao. | CH₃NH₂ (Methylamin) | Tổng hợp dược phẩm, thuốc trừ sâu. |
| Bậc 2 | Bazơ trung bình, ổn định hơn amin bậc 1. | Ít tan hơn bậc 1, có thể tạo nitrosamine (chất gây ung thư). | (CH₃)₂NH (Dimethylamin) | Sản xuất dung môi, thuốc diệt nấm. |
| Bậc 3 | Ổn định nhiệt, ít mùi hơn, là chất xúc tác tốt. | Bazơ yếu hơn amin bậc 1 và 2, không gian cồng kềnh. | (CH₃)₃N (Trimethylamin) | Chất xúc tác trong tổng hợp hữu cơ, hóa dẻo. |
Ứng Dụng Của Amin Trong Đời Sống và Công Nghiệp
Amin là hợp chất nền tảng trong nhiều lĩnh vực: sản xuất Polyme (nylon, PU), nông nghiệp (phân bón, thuốc trừ sâu), và đặc biệt là dược phẩm (thuốc gây tê, thuốc kháng sinh, thuốc chống dị ứng).
- Sản xuất Polyme: Anilin là nguyên liệu để sản xuất polyuretan (PU) và thuốc nhuộm azo. Hexametylenđiamin và axit ađipic được dùng để sản xuất nilon-6,6, một loại vật liệu siêu bền.
- Nông nghiệp: Một số amin được sử dụng để tổng hợp phân đạm, thuốc trừ sâu và thuốc diệt cỏ, góp phần quan trọng vào an ninh lương thực.
- Dược phẩm: Cấu trúc amin có mặt trong vô số loại thuốc, từ thuốc giảm đau, thuốc gây tê (Novocain), thuốc kháng sinh (nhóm Sulfonamid) đến thuốc chống dị ứng (kháng histamin) và thuốc điều trị trầm cảm. Ephedrine, một amin tự nhiên, được dùng làm thuốc thông mũi.
- Hóa mỹ phẩm: Các amin thơm như p-phenylenediamine (PPD) là thành phần chính trong nhiều loại thuốc nhuộm tóc vĩnh viễn.
- Xử lý nước: Amin được dùng làm chất ức chế ăn mòn cho đường ống kim loại và trong các hệ thống lọc nước công nghiệp.
Phân Biệt Amin và Axit Amin: Đừng Nhầm Lẫn!
Điểm khác biệt cốt lõi: Amin chỉ chứa nhóm chức amino (-NH₂), trong khi axit amin là hợp chất tạp chức, chứa cả nhóm amino (-NH₂) và nhóm cacboxyl (-COOH). Axit amin là đơn vị xây dựng nên protein.
Đây là một điểm rất quan trọng. Mặc dù tên gọi gần giống nhau, nhưng cấu trúc và chức năng của chúng hoàn toàn khác biệt.
- Amin: Chỉ chứa nhóm chức amino (-NH₂). Chức năng hóa học chính là tính bazơ.
- Axit amin: Là hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm amino (-NH₂) và nhóm cacboxyl (-COOH). Chúng có tính lưỡng tính (vừa là axit, vừa là bazơ).
Glycine (H₂N-CH₂-COOH) là ví dụ đơn giản nhất của một axit amin. Axit amin là đơn vị cấu tạo nên protein, nền tảng của sự sống, trong khi amin có vai trò đa dạng hơn trong hóa học và công nghiệp.
Câu Hỏi Thường Gặp (FAQ)
Làm thế nào để nhận biết một dung dịch amin có tính bazơ?
Dung dịch amin béo trong nước có thể làm giấy quỳ tím hóa xanh hoặc dung dịch phenolphtalein chuyển sang màu hồng, cho thấy môi trường bazơ. Đây là phương pháp nhận biết đơn giản và hiệu quả nhất trong phòng thí nghiệm.
Amin có độc không?
Có. Nhiều loại amin có độc tính, đặc biệt là các amin bậc thấp và amin thơm như anilin. Chúng có thể gây kích ứng da, mắt và hệ hô hấp. Việc hít phải hơi amin nồng độ cao có thể gây tổn thương hệ thần kinh. Cần tuân thủ các quy tắc an toàn hóa chất khi làm việc với chúng.
Ví dụ về amin trong tự nhiên là gì?
Trong tự nhiên, amin thường xuất hiện trong quá trình phân hủy các chất hữu cơ chứa nitơ. Trimethylamin tạo ra mùi tanh của cá. Các ancaloit (như morphin, cafein, nicotin) cũng là những hợp chất amin phức tạp có nguồn gốc thực vật với hoạt tính sinh học rất mạnh.
Tuyên bố miễn trừ trách nhiệm: Bài viết này được tổng hợp từ các nguồn khoa học đáng tin cậy nhằm mục đích cung cấp kiến thức. Nội dung không thay thế cho giáo trình chuyên ngành hoặc tư vấn từ chuyên gia hóa học. Cập nhật lần cuối: 08/10/2025.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









