Kiến thức chuyên môn
3 Cách Phản Ứng SO₂ + NaOH Hiệu Quả Nhất (Cập Nhật 2025)
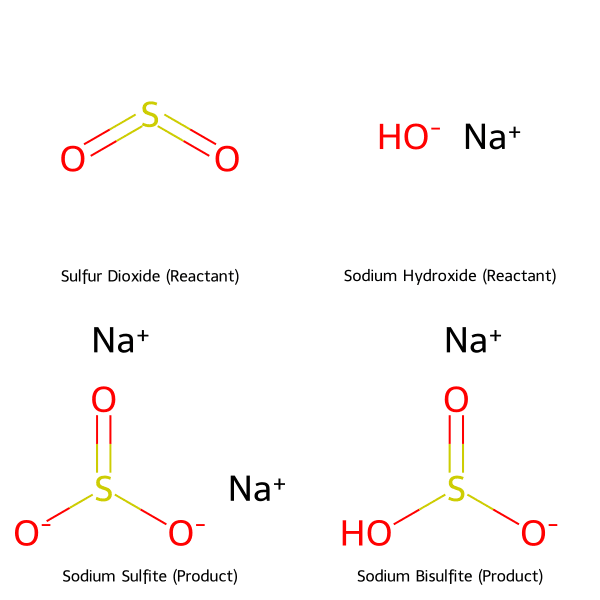
Phản ứng giữa lưu huỳnh đioxit (SO₂) và Natri hydroxit (NaOH) là một trong những ví dụ điển hình của phản ứng trung hòa trong hóa học vô cơ, có ý nghĩa quan trọng trong cả phòng thí nghiệm và công nghiệp xử lý khí thải. Tùy thuộc vào tỷ lệ mol giữa các chất tham gia, phản ứng này có thể tạo ra hai sản phẩm muối khác nhau: natri sunfit (Na₂SO₃) hoặc natri bisunfit (NaHSO₃).
Để hiểu rõ hơn về cơ chế và tối ưu hóa hiệu suất, bài viết này sẽ hướng dẫn chi tiết 3 phương pháp thực hiện phản ứng SO₂ + NaOH, được cập nhật với các tiêu chuẩn an toàn và kỹ thuật mới nhất năm 2025.
Phương Pháp 1: Phản Ứng Với NaOH Dư (Tỷ Lệ 2:1) – Tạo Natri Sunfit
Phản ứng giữa SO₂ và NaOH dư theo tỷ lệ 1:2 tạo ra sản phẩm là Natri Sunfit (Na₂SO₃) và nước. Phương pháp này đảm bảo hấp thụ SO₂ triệt để, đạt hiệu suất trên 95% và được ưu tiên trong các ứng dụng công nghiệp xử lý khí thải.
Khi sử dụng xút (NaOH) dư, mỗi phân tử SO₂ sẽ phản ứng với hai phân tử NaOH để tạo ra muối trung hòa là Natri Sunfit (Na₂SO₃) và nước. Đây là phương pháp phổ biến trong công nghiệp để đảm bảo SO₂ được hấp thụ hoàn toàn.
Phương trình hóa học
SO₂ + 2NaOH ⟶ Na₂SO₃ + H₂O
Điều kiện tối ưu
- Nồng độ: Sử dụng dung dịch NaOH 32%-50% hoặc xút vảy 99% pha loãng.
- Nhiệt độ: 20-30°C.
- pH: Duy trì môi trường kiềm mạnh với chỉ số pH > 10.
Hiệu quả và Ứng dụng
Đạt hiệu suất hấp thụ SO₂ trên 95% trong thời gian ngắn (5-10 phút). Sản phẩm Na₂SO₃ ổn định, được ứng dụng rộng rãi trong sản xuất giấy, xử lý nước, và làm chất khử trong công nghiệp hóa chất.
Phương Pháp 2: Phản Ứng Tỷ Lệ 1:1 – Tạo Natri Bisunfit
Khi SO₂ và NaOH phản ứng theo tỷ lệ mol 1:1, sản phẩm thu được là muối axit Natri Bisunfit (NaHSO₃). Phương pháp này giúp tiết kiệm NaOH và phù hợp cho các quy trình trong phòng thí nghiệm cần kiểm soát sản phẩm chính xác.
Khi cho SO₂ phản ứng với NaOH theo tỷ lệ mol 1:1, sản phẩm chính thu được là muối axit Natri Bisunfit (NaHSO₃). Phương pháp này đòi hỏi sự kiểm soát chặt chẽ về lượng chất phản ứng để tránh tạo ra sản phẩm phụ.
Phương trình hóa học
SO₂ + NaOH ⟶ NaHSO₃
Điều kiện tối ưu
- Nồng độ: Lượng NaOH và SO₂ phải được tính toán chính xác theo tỷ lệ 1 mol : 1 mol.
- Chất chỉ thị: Sử dụng chất chỉ thị Phenolphthalein để xác định điểm tương đương của phản ứng.
Hiệu quả và Ứng dụng
Tiết kiệm được lượng hóa chất NaOH sử dụng. Sản phẩm Sodium Bisulfite (NaHSO₃) là một chất trung gian quan trọng, được dùng làm chất tẩy trắng trong ngành dệt may và là phụ gia thực phẩm (E222).
Phương Pháp 3: Ứng Dụng Trong Tháp Hấp Thụ Công Nghiệp (Scrubber)
Trong công nghiệp, phản ứng SO₂ + NaOH được thực hiện trong tháp hấp thụ (scrubber), sử dụng dung dịch NaOH 1-5% để xử lý khí thải quy mô lớn, giúp giảm nồng độ SO₂ xuống dưới 50 ppm, đạt hiệu quả xử lý trên 95%.
Trong công nghiệp, phản ứng giữa SO₂ và NaOH được ứng dụng trong các hệ thống tháp hấp thụ để xử lý khí thải từ các nhà máy nhiệt điện, luyện kim, đảm bảo tuân thủ các tiêu chuẩn môi trường khắt khe nhất.
Quy trình hoạt động
Khí thải chứa SO₂ được bơm từ dưới lên trong tháp, trong khi dung dịch NaOH được phun từ trên xuống dưới dạng sương để tối đa hóa diện tích tiếp xúc. SO₂ phản ứng với NaOH và bị loại bỏ khỏi dòng khí, sau đó khí sạch được thải ra môi trường.
So Sánh Các Phương Pháp
Việc lựa chọn phương pháp phụ thuộc vào mục tiêu: Dùng NaOH dư cho hiệu quả hấp thụ tối đa; tỷ lệ 1:1 để tiết kiệm và tạo sản phẩm đặc thù; và tháp scrubber cho xử lý công nghiệp quy mô lớn, tự động.
| Phương pháp | Ưu điểm | Nhược điểm | Ứng dụng chính |
|---|---|---|---|
| Dùng dư NaOH | Hấp thụ SO₂ triệt để, sản phẩm Na₂SO₃ ổn định. | Tốn nhiều NaOH hơn. | Xử lý khí thải, sản xuất công nghiệp. |
| Tỷ lệ 1:1 | Tiết kiệm chi phí, tạo ra NaHSO₃ có giá trị. | Phản ứng nhạy cảm, dễ tạo sản phẩm phụ nếu dư SO₂. | Phòng thí nghiệm, sản xuất hóa chất tinh khiết. |
| Tháp Scrubber | Hiệu suất cao, quy trình tự động hóa. | Chi phí đầu tư và vận hành thiết bị cao. | Các nhà máy công nghiệp quy mô lớn. |
Lưu Ý An Toàn Quan Trọng
An toàn là ưu tiên hàng đầu: Luôn mặc đồ bảo hộ cá nhân (PPE), làm việc trong khu vực thông gió tốt (tủ hút), và biết cách xử lý khi tiếp xúc với hóa chất ăn mòn như NaOH và khí độc SO₂.
Việc bảo quản và sử dụng hóa chất an toàn là yếu tố bắt buộc để tránh các tác hại của hóa chất.
- Trang bị bảo hộ (PPE): Luôn đeo găng tay, kính bảo hộ và áo choàng phòng thí nghiệm.
- Thông gió: Thực hiện phản ứng trong tủ hút để tránh hít phải khí SO₂ độc hại.
- Xử lý sự cố: NaOH là một bazơ mạnh, có tính ăn mòn cao. Nếu bị đổ, cần pha loãng ngay bằng nước và xử lý theo quy định.
- Bảo quản: Đậy kín hộp chứa NaOH để ngăn nó tác dụng với CO₂ trong không khí.
Câu Hỏi Thường Gặp (FAQs)
1. Sản phẩm phụ có thể tạo thành là gì?
Nếu SO₂ dư, nó sẽ phản ứng với nước tạo thành axit sunfurơ (H₂SO₃), làm giảm độ pH của dung dịch và có thể tạo ra muối bisunfit không mong muốn. Do đó, việc kiểm soát chặt chẽ tỷ lệ mol là cực kỳ quan trọng.
2. Đây là loại phản ứng gì?
Đây là phản ứng axit-bazơ. SO₂ là một oxit axit điển hình, khi tan trong nước tạo thành môi trường axit, còn NaOH là một bazơ mạnh.
3. Có gì mới trong năm 2025?
Về cơ bản, phản ứng hóa học không thay đổi. Tuy nhiên, các công nghệ scrubber ngày càng được cải tiến để tiết kiệm năng lượng và nâng cao hiệu suất. Thị trường xút NaOH toàn cầu dự kiến tăng trưởng với tốc độ CAGR khoảng 5% trong giai đoạn 2025-2030 do nhu cầu gia tăng từ các ngành công nghiệp.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









