Kiến thức chuyên môn
Fe + HCl: Toàn Tập Về Phản Ứng Kinh Điển Giữa Sắt và Axit Clohydric
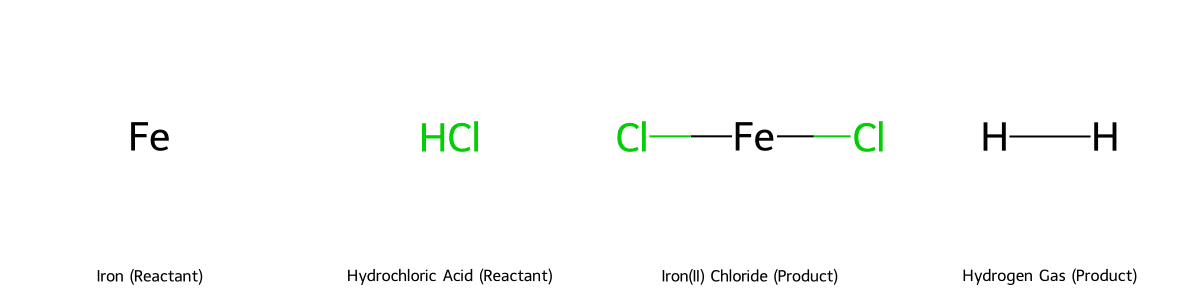
Phản ứng giữa Sắt (Fe) và axit clohidric (HCl) là một trong những thí nghiệm hóa học vô cơ kinh điển, tạo ra sản phẩm chính là muối sắt(II) clorua (FeCl₂) và giải phóng khí hydro (H₂). Phương trình phản ứng được biểu diễn như sau:
Fe + 2HCl ⟶ FeCl₂ + H₂
Đây là phản ứng oxi hóa – khử, trong đó sắt đóng vai trò là chất khử và ion H⁺ trong axit là chất oxi hóa. Tùy thuộc vào mục đích sử dụng, quy mô và điều kiện an toàn, chúng ta có thể tiến hành phản ứng này theo nhiều cách khác nhau. Bài viết này sẽ hướng dẫn chi tiết 3 phương pháp thực hiện an toàn và hiệu quả nhất trong năm 2025.
Phương Pháp 1: Thí Nghiệm Trong Ống Nghiệm (Quy Mô Phòng Lab Cơ Bản)
Đây là phương pháp đơn giản nhất, sử dụng bột sắt và HCl loãng trong ống nghiệm. Phản ứng tạo ra khí hydro và dung dịch FeCl₂ màu xanh nhạt sau 5-10 phút, lý tưởng cho mục đích giảng dạy và nghiên cứu cơ bản.
Bước 1: Chuẩn bị hóa chất và dụng cụ
- Chuẩn bị 0.5g bột sắt (Fe) nguyên chất, không bị gỉ sét.
- Đong 5ml dung dịch HCl 1M.
- Sử dụng ống nghiệm khô, sạch và que thủy tinh.
Bước 2: Tiến hành phản ứng
- Cho từ từ bột sắt vào ống nghiệm chứa dung dịch HCl.
- Khuấy nhẹ bằng que thủy tinh để tăng diện tích tiếp xúc, giúp phản ứng diễn ra nhanh hơn.
Bước 3: Quan sát hiện tượng
- Bọt khí không màu, không mùi (khí H₂) sẽ thoát ra ngay lập tức. Có thể thử bằng cách đưa que diêm đang cháy vào miệng ống nghiệm, sẽ có tiếng nổ nhỏ đặc trưng.
- Sau khoảng 5-10 phút, dung dịch sẽ dần chuyển sang màu xanh lục nhạt, là màu của muối FeCl₂.
Bước 4: Hoàn thành và thu sản phẩm
- Nếu sắt còn dư, có thể lọc để tách ra khỏi dung dịch.
- Dung dịch thu được là Sắt(II) clorua, có thể được sử dụng cho các thí nghiệm khác.
Phương Pháp 2: Sản Xuất Sắt(II) Clorua Quy Mô Công Nghiệp
Ở quy mô công nghiệp, phản ứng được thực hiện trong lò phản ứng kín với sắt phế liệu và HCl 20%, duy trì nhiệt độ 50-60°C. Phương pháp này cho năng suất cao, thu hồi khí H₂ và tạo ra FeCl₂ tinh khiết sau quá trình kết tinh và sấy khô.
Bước 1: Chuẩn bị nguyên liệu
- Sử dụng lò phản ứng bằng vật liệu kháng axit, có hệ thống khuấy và kiểm soát nhiệt độ.
- Nạp khoảng 100kg sắt phế liệu (đã được làm sạch) và bơm dung dịch HCl nồng độ 20% (thường dùng dư 10-20% để đảm bảo phản ứng hoàn toàn).
Bước 2: Kiểm soát quá trình phản ứng
- Duy trì nhiệt độ trong lò ở mức 50-60°C để tăng tốc độ phản ứng.
- Hệ thống khuấy hoạt động liên tục để tránh tích tụ cục bộ khí H₂, giảm nguy cơ cháy nổ.
Bước 3: Thu hồi sản phẩm
- Khí H₂ sinh ra được dẫn qua hệ thống lọc để làm sạch và có thể tái sử dụng làm nhiên liệu hoặc cho các quy trình tổng hợp hóa học khác.
- Dung dịch muối FeCl₂ được làm nguội để kết tinh, sau đó được ly tâm và sấy khô để thu được sản phẩm rắn.
Bước 4: Kiểm tra chất lượng (QC)
- Đo độ pH và phân tích quang phổ để đảm bảo sản phẩm FeCl₂ đạt độ tinh khiết yêu cầu trước khi xuất xưởng.
Phương Pháp 3: Thí Nghiệm Với HCl Đặc (Có Thể Tạo Ra FeCl₃)
Khi dùng HCl đặc (37%) và đun nóng tới 80°C, đặc biệt khi có mặt oxy không khí, sản phẩm chính có thể là sắt(III) clorua (FeCl₃), nhận biết qua dung dịch màu vàng nâu. Phương pháp này tiềm ẩn rủi ro cao do sinh khí độc.
Bước 1: Chuẩn bị trong điều kiện an toàn
- Sử dụng 0.5g sắt và 5ml HCl nồng độ 37% trong tủ hút khí độc để đảm bảo thông gió tốt.
- Trang bị đầy đủ kính bảo hộ và găng tay chịu axit.
Bước 2: Tiến hành phản ứng
- Đun nhẹ hỗn hợp đến khoảng 80°C. Ở nhiệt độ này, phản ứng diễn ra mãnh liệt.
- Ban đầu, FeCl₂ vẫn được tạo thành. Tuy nhiên, HCl đặc và nhiệt độ cao sẽ làm tăng khả năng sắt bị oxi hóa lên số oxi hóa +3, đặc biệt khi tiếp xúc với không khí.
- Phương trình phản ứng có thể diễn ra như sau: 4FeCl₂ + O₂ + 4HCl ⟶ 4FeCl₃ + 2H₂O.
Bước 3: Quan sát hiện tượng
- Dung dịch sẽ chuyển từ màu xanh nhạt của FeCl₂ sang màu vàng nâu đặc trưng của FeCl₃.
- Có thể có khí Cl₂ màu vàng lục, mùi hắc thoát ra, rất độc, cần tuyệt đối cẩn thận.
Bước 4: Xử lý sau phản ứng
- Làm nguội dung dịch và tiến hành trung hòa lượng axit dư bằng dung dịch NaOH loãng trước khi xử lý chất thải.
So Sánh Ưu và Nhược Điểm Của 3 Phương Pháp
Phương pháp ống nghiệm dễ và rẻ nhưng quy mô nhỏ. Phương pháp công nghiệp cho năng suất cao nhưng yêu cầu thiết bị chuyên dụng. Phương pháp dùng HCl đặc tạo sản phẩm đa dạng nhưng rủi ro cao nhất.
| Phương Pháp | Thời Gian | Sản Phẩm Chính | Ưu Điểm | Nhược Điểm |
|---|---|---|---|---|
| Ống Nghiệm | 5-15 phút | FeCl₂, H₂ | Dễ thực hiện, chi phí thấp | Quy mô nhỏ, hiệu suất không cao |
| Công Nghiệp | 1-2 giờ | FeCl₂ tinh khiết | Năng suất cao, thu hồi khí H₂ | Yêu cầu thiết bị chuyên dụng, vốn đầu tư lớn |
| HCl Đặc | 10-30 phút | FeCl₃ (nếu có O₂) | Tạo sản phẩm đa dạng hóa trị | Rủi ro cao, phát sinh khí độc, cần thông gió tốt |
Những Lưu Ý An Toàn Quan Trọng Khi Thực Hiện
Câu trả lời ngắn: Luôn đeo kính và găng tay bảo hộ. Thực hiện trong tủ hút khi dùng HCl đặc. Không dùng sắt gỉ và luôn trung hòa axit dư bằng NaHCO₃ trước khi xử lý chất thải.
Để đảm bảo an toàn tuyệt đối, việc bảo quản hóa chất và tuân thủ quy tắc là cực kỳ quan trọng.
- Bảo hộ cá nhân: Luôn đeo kính bảo hộ và găng tay cao su. Axit HCl có thể gây bỏng nặng.
- Thông gió: Luôn thực hiện thí nghiệm trong không gian thông thoáng hoặc tủ hút, đặc biệt khi dùng HCl đặc. Khí H₂ tích tụ có thể gây cháy nổ.
- Chất lượng nguyên liệu: Không dùng sắt bị gỉ sét (chứa Fe₂O₃) vì sẽ tạo ra tạp chất và làm chậm phản ứng.
- Kiểm soát nồng độ: Nồng độ HCl loãng (1-2M) là lý tưởng cho việc điều chế FeCl₂. Nồng độ quá cao làm tăng nguy cơ bay hơi và tạo ra các sản phẩm phụ không mong muốn.
- Xử lý chất thải: Trung hòa dung dịch axit dư bằng các bazơ yếu như NaHCO₃ trước khi thải ra môi trường.
Câu Hỏi Thường Gặp (FAQs)
Phản ứng Fe + HCl tạo ra FeCl₂ hay FeCl₃?
Với HCl loãng, sản phẩm chính luôn là FeCl₂. Muối FeCl₃ chỉ tạo thành khi có mặt chất oxi hóa mạnh hoặc khi dùng HCl đặc, nóng.
Làm cách nào để đo lường lượng khí H₂ thoát ra?
Có thể dùng ống đo khí (eudiometer) trong phòng thí nghiệm hoặc tính toán lý thuyết dựa trên khối lượng sắt đã phản ứng (tỷ lệ mol 1:1).
Ứng dụng thực tế của phản ứng này là gì?
Phản ứng này được dùng để tẩy gỉ sét bề mặt kim loại, sản xuất FeCl₂ dùng trong xử lý nước thải, và điều chế khí hydro trong phòng thí nghiệm.
Phản ứng có tỏa nhiệt không?
Có, đây là một phản ứng tỏa nhiệt. Ở quy mô công nghiệp, cần có hệ thống làm mát để kiểm soát nhiệt độ, tránh quá nhiệt gây nguy hiểm.Nếu bạn có bất kỳ câu hỏi nào hoặc có nhu cầu về các loại hóa chất công nghiệp và thí nghiệm như Axit HCl, FeCl₂, FeCl₃, hãy liên hệ ngay với chúng tôi để nhận được sự tư vấn chuyên nghiệp và sản phẩm chất lượng hàng đầu.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









