Kiến thức chuyên môn
Phản Ứng CH4 + Cl2: Sản Phẩm, Điều Kiện và Cơ Chế Chi Tiết
Phản ứng giữa metan (CH₄) và Clo (Cl₂) là một trong những phản ứng halogen hóa điển hình nhất của ankan, đóng vai trò nền tảng trong hóa học hữu cơ và công nghiệp. Bài viết này sẽ phân tích chi tiết cơ chế, các sản phẩm tạo thành, ứng dụng thực tiễn và những lưu ý an toàn quan trọng nhất được cập nhật đến tháng 10 năm 2025.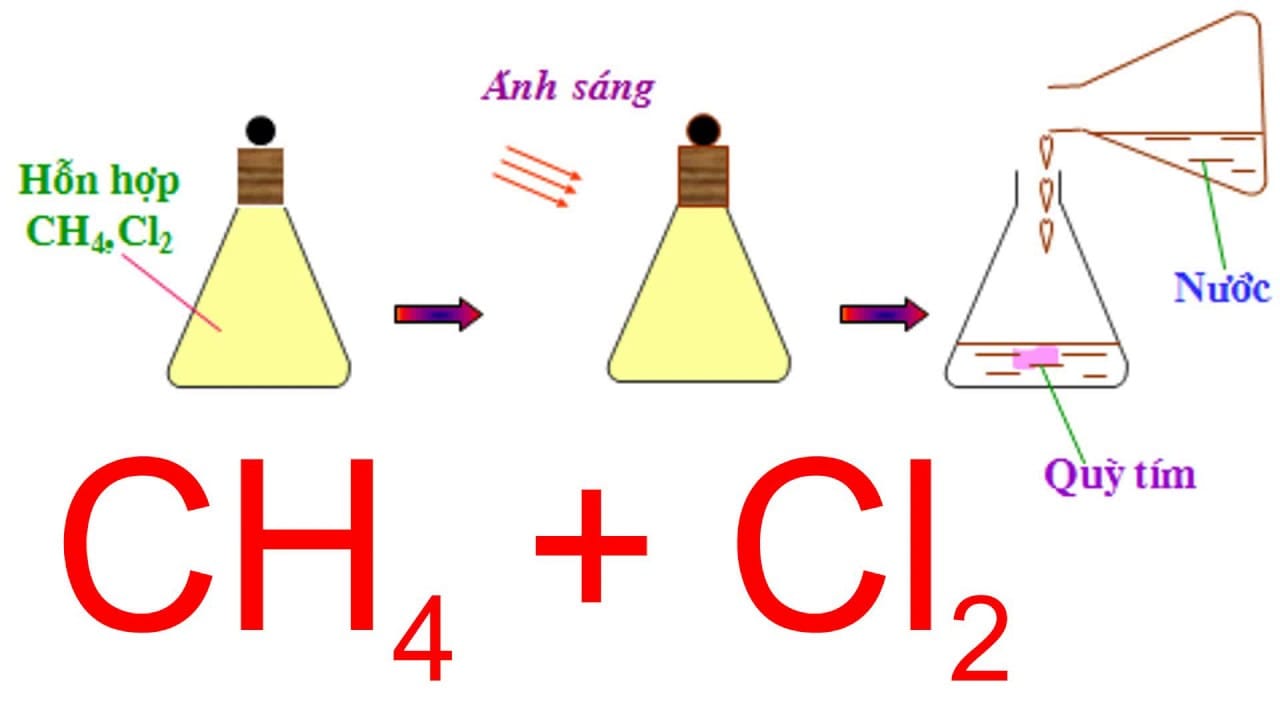
Phương Trình Phản Ứng Và Các Sản Phẩm Chính
Phản ứng cơ bản giữa CH₄ và Cl₂ theo tỷ lệ 1:1 tạo ra sản phẩm chính là clorometan (CH₃Cl) và axit clohidric (HCl). Nếu dư clo, phản ứng sẽ tiếp tục tạo ra các sản phẩm thế sâu hơn như CH₂Cl₂, CHCl₃ và CCl₄.
Phản ứng cơ bản nhất xảy ra khi trộn metan và clo theo tỉ lệ mol 1:1, dưới tác dụng của ánh sáng khuch tán hoặc nhiệt độ cao (300-500°C). Đây là phản ứng thế nguyên tử hydro bằng nguyên tử clo:
CH₄ + Cl₂ ⟶ CH₃Cl + HCl
Sản phẩm chính của phản ứng này là clorometan (metyl clorua, CH₃Cl) và axit clohidric (HCl).
Sản Phẩm Thế Sâu Hơn Khi Dư Clo
Khi tỷ lệ Cl₂ cao hơn CH₄, các nguyên tử hydro còn lại trong CH₃Cl tiếp tục bị thay thế, tạo ra một hỗn hợp sản phẩm gồm điclo metan (CH₂Cl₂), triclo metan (CHCl₃), và tetraclo metan (CCl₄).
Nếu lượng clo (Cl₂) được sử dụng dư thừa, phản ứng sẽ không dừng lại ở sản phẩm mono-clo. Thay vào đó, các nguyên tử hydro còn lại trong phân tử clorometan sẽ tiếp tục bị thế bởi clo, tạo ra một hỗn hợp các sản phẩm có mức độ clo hóa cao hơn:
- Tạo Điclo metan (CH₂Cl₂):
CH₃Cl + Cl₂ ⟶ CH₂Cl₂ + HCl - Tạo Triclo metan (CHCl₃ – Chloroform):
CH₂Cl₂ + Cl₂ ⟶ CHCl₃ + HCl - Tạo Tetraclo metan (CCl₄ – Cacbon tetraclorua):
CHCl₃ + Cl₂ ⟶ CCl₄ + HCl
Để kiểm soát và thu được sản phẩm mong muốn với hiệu suất cao, việc điều chỉnh tỉ lệ mol giữa các chất phản ứng là cực kỳ quan trọng. Tỷ lệ 1:1 ưu tiên tạo ra CH₃Cl, trong khi tỷ lệ 1:4 (CH₄:Cl₂) sẽ hướng đến sản phẩm cuối cùng là CCl₄.
Cơ Chế Phản Ứng Gốc Tự Do (Free Radical Substitution)
Phản ứng diễn ra theo cơ chế chuỗi gốc tự do gồm 3 giai đoạn: Khơi mào (tia UV hoặc nhiệt phá vỡ liên kết Cl-Cl), Phát triển mạch (các gốc tự do phản ứng và tái tạo), và Kết thúc (các gốc tự do kết hợp với nhau).
Giai đoạn 1: Khơi mào (Initiation)
Dưới tác động của tia UV (ánh sáng) hoặc nhiệt độ cao, phân tử clo (Cl₂) hấp thụ năng lượng và phá vỡ liên kết Cl-Cl (năng lượng liên kết ≈ 243 kJ/mol), tạo ra hai gốc tự do clo (Cl•) rất hoạt động.
Cl₂ + ánh sáng/nhiệt độ ⟶ 2Cl•
Giai đoạn 2: Phát triển mạch (Propagation)
Các gốc tự do clo tấn công phân tử metan, bứt một nguyên tử hydro để tạo ra phân tử HCl bền vững và một gốc metyl (CH₃•). Gốc metyl này lại tấn công phân tử Cl₂ để tạo sản phẩm và tái sinh gốc Cl•, duy trì chuỗi phản ứng.
Cl• + CH₄ ⟶ HCl + CH₃•
CH₃• + Cl₂ ⟶ CH₃Cl + Cl•
Giai đoạn 3: Kết thúc (Termination)
Chuỗi phản ứng sẽ dừng lại khi các gốc tự do kết hợp với nhau, tạo thành các phân tử bền vững và làm giảm nồng độ gốc tự do trong hỗn hợp.
Cl• + Cl• ⟶ Cl₂CH₃• + CH₃• ⟶ C₂H₆ (Etan)CH₃• + Cl• ⟶ CH₃Cl
Ứng Dụng Thực Tiễn Và Vấn Đề An Toàn
Các sản phẩm của phản ứng được ứng dụng rộng rãi làm dung môi và hóa chất trung gian. Tuy nhiên, cần tuân thủ nghiêm ngặt các biện pháp an toàn do nguy cơ cháy nổ từ CH₄ và độc tính của Cl₂ cũng như các sản phẩm clo hóa.
Ứng Dụng Công Nghiệp
- Clorometan (CH₃Cl): Được sử dụng làm dung môi trong sản xuất silicone, cao su butyl và làm chất trung gian để tổng hợp các hóa chất khác.
- Điclo metan (CH₂Cl₂): Là một dung môi quan trọng, dùng để tẩy sơn, tẩy dầu mỡ và trong ngành dược phẩm.
- Chloroform (CHCl₃): Từng được dùng làm chất gây mê nhưng hiện nay chủ yếu được sử dụng làm dung môi và sản xuất chất làm lạnh. Tìm hiểu thêm về tác hại của Chloroform để biết tại sao ứng dụng này bị hạn chế.
- Cacbon tetraclorua (CCl₄): Trước đây được dùng rộng rãi trong bình chữa cháy và làm chất giặt khô. Tuy nhiên, do độc tính cao và khả năng phá hủy tầng ozon, việc sử dụng CCl₄ đã bị cấm hoặc hạn chế nghiêm ngặt ở nhiều quốc gia theo Nghị định thư Montreal.
An Toàn Trong Thí Nghiệm Và Sản Xuất
- Nguy cơ cháy nổ: Metan là một chất khí cực kỳ dễ cháy, có thể tạo hỗn hợp nổ với không khí ở nồng độ 5-15%.
- Độc tính: Clo là một khí độc, gây kích ứng mạnh hệ hô hấp, mắt và da. Các sản phẩm clo hóa như CHCl₃ và CCl₄ cũng có độc tính cao, ảnh hưởng đến gan, thận và hệ thần kinh trung ương.
- Biện pháp phòng ngừa: Thực hiện phản ứng trong tủ hút khí độc, sử dụng đầy đủ trang bị bảo hộ cá nhân (PPE), và kiểm soát chặt chẽ nhiệt độ, áp suất và tỉ lệ phản ứng.
So Sánh Tóm Tắt Các Sản Phẩm
Mức độ clo hóa càng cao, sản phẩm càng có xu hướng độc hơn và các ứng dụng chuyên biệt hơn. Việc lựa chọn sản phẩm phụ thuộc vào mục tiêu tổng hợp và yêu cầu về độ tinh khiết.
| Sản Phẩm | Tỷ Lệ Cl₂ Ưu Tiên | Ứng Dụng Chính | Mức Độ Độc Tính |
|---|---|---|---|
| CH₃Cl | 1:1 | Dung môi, hóa chất trung gian | Trung bình |
| CH₂Cl₂ | ~2:1 | Dung môi tẩy rửa, chiết xuất | Cao, ảnh hưởng thần kinh |
| CHCl₃ | ~3:1 | Dung môi, sản xuất hóa chất | Rất cao, nghi ngờ gây ung thư |
| CCl₄ | ≥ 4:1 | Hạn chế (trước đây dùng làm chất tẩy) | Cực cao, phá hủy tầng ozon |
Cập Nhật Quy Định An Toàn 2025
Tính đến cuối năm 2025, các quy định về an toàn và môi trường ngày càng siết chặt. Giới hạn phơi nhiễm cho phép (PEL) đối với clo của OSHA là 1 ppm, và việc sử dụng CCl₄ gần như bị loại bỏ hoàn toàn trong các ứng dụng phổ thông do tác động môi trường.
Đến năm 2025, cơ chế phản ứng và phương trình hóa học vẫn không thay đổi. Tuy nhiên, các quy định về an toàn lao động và bảo vệ môi trường ngày càng được siết chặt. Theo OSHA (Cơ quan An toàn và Sức khỏe Nghề nghiệp Hoa Kỳ), giới hạn phơi nhiễm cho phép đối với khí clo trong không khí làm việc vẫn duy trì ở mức thấp (khoảng 0.5 ppm). EPA (Cơ quan Bảo vệ Môi trường Hoa Kỳ) tiếp tục hạn chế nghiêm ngặt việc sản xuất và sử dụng CCl₄ do tác động tiêu cực đến tầng ozon.
Câu Hỏi Thường Gặp (FAQ)
1. Điều kiện tối ưu cho phản ứng CH₄ + Cl₂ là gì?
Điều kiện cần thiết là năng lượng kích hoạt từ ánh sáng tử ngoại (UV) hoặc nhiệt độ cao, thường trong khoảng 300-500°C.
2. Làm thế nào để thu được CH₃Cl là sản phẩm chính?
Sử dụng tỷ lệ mol CH₄:Cl₂ là 1:1 hoặc cho metan dư. Điều này làm giảm xác suất một phân tử sản phẩm (CH₃Cl) tiếp tục va chạm và phản ứng với gốc clo.
3. Phản ứng này có nguy hiểm không?
Có. Phản ứng có nguy cơ gây nổ nếu không kiểm soát được nhiệt độ và nồng độ. Các chất tham gia và sản phẩm đều có độc tính, đòi hỏi phải tuân thủ nghiêm ngặt các quy tắc an toàn.
Lưu ý: Bài viết này được tổng hợp từ các nguồn tài liệu hóa học uy tín và chỉ mang tính chất tham khảo. Để được tư vấn chi tiết về sản phẩm và an toàn hóa chất, vui lòng liên hệ với các chuyên gia của Hóa chất Doanh Tín
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










