Kiến thức chuyên môn
Oxygen (O₂) là gì? Toàn tập về Tính chất, Điều chế & Ứng dụng
Bạn đang tìm kiếm cách điều chế khí Oxy trong phòng thí nghiệm một cách an toàn và hiệu quả? Oxy (Oxygen) là một đơn chất quan trọng, không chỉ trong đời sống mà còn trong các thí nghiệm hóa học. Bài viết này sẽ hướng dẫn chi tiết 3 phương pháp điều chế khí O₂ phổ biến nhất, kèm theo so sánh ưu nhược điểm và những lưu ý an toàn quan trọng được cập nhật cho năm 2025.

Cấu Trúc Hóa Học Của Các Hóa Chất Phản Ứng
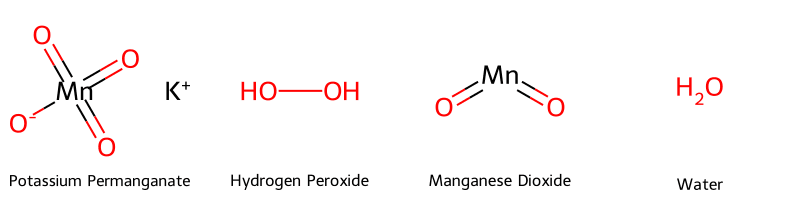
Để hiểu rõ bản chất phản ứng, việc nắm được cấu trúc phân tử của các hóa chất tham gia như Kali Pemanganat, Hydro Peroxide, Mangan Dioxit và Nước là vô cùng cần thiết.
Dưới đây là hình ảnh minh họa cấu trúc phân tử của các hợp chất chính được sử dụng trong các phương pháp điều chế oxy, giúp bạn hình dung rõ hơn về quá trình biến đổi hóa học.
Phương Pháp 1: Phân Hủy Kali Pemanganat (KMnO₄) Bằng Nhiệt
Đây là phương pháp điều chế oxy bằng cách đun nóng hóa chất Kali Pemanganat (thuốc tím) ở nhiệt độ khoảng 200°C. Phản ứng tạo ra khí oxy với hiệu suất ~80% trong thời gian 10-15 phút.

- Chuẩn bị: 5g KMnO4, ống nghiệm, ống dẫn khí, bình thu khí.
- Bước 1: Đổ KMnO4 vào ống nghiệm.
- Bước 2: Đun nóng đến 200°C.
- Bước 3: Thu khí oxy qua ống dẫn vào bình.
- Thời gian: 10-15 phút, hiệu suất 80%.
Đây là phương pháp kinh điển và dễ thực hiện nhất trong các phòng thí nghiệm phổ thông. Khi đun nóng, thuốc tím (KMnO₄) sẽ bị nhiệt phân, tạo ra khí oxy và các sản phẩm khác. Phản ứng này là một ví dụ điển hình của phản ứng phân hủy bởi nhiệt.
2KMnO₄ —(t°)→ K₂MnO₄ + MnO₂ + O₂
Chuẩn bị
Cần chuẩn bị khoảng 5g KMnO₄ và các dụng cụ thí nghiệm cơ bản như ống nghiệm chịu nhiệt, đèn cồn, hệ thống ống dẫn khí và bình thu khí.
- Hóa chất: Khoảng 5g Kali Pemanganat (KMnO₄).
- Dụng cụ: Ống nghiệm thủy tinh chịu nhiệt, đèn cồn, ống dẫn khí, bình thu khí (sử dụng phương pháp đẩy nước hoặc đẩy không khí), kẹp ống nghiệm, nhiệt kế phòng thí nghiệm.
Các bước tiến hành
Quy trình gồm 3 bước: Cho KMnO₄ vào ống nghiệm, tiến hành đun nóng bằng đèn cồn và cuối cùng là thu khí oxy tinh khiết thoát ra.
- Cho KMnO₄ vào ống nghiệm khô, lắp hệ thống ống dẫn khí vào miệng ống nghiệm.
- Dùng đèn cồn đun nóng đều toàn bộ ống nghiệm, sau đó tập trung đun vào phần đáy ống chứa hóa chất. Nhiệt năng cung cấp sẽ khởi đầu và duy trì phản ứng phân hủy.
- Khí oxy thoát ra được dẫn qua ống và thu vào bình bằng phương pháp đẩy nước để thu được khí O₂ tinh khiết hơn.
Phương Pháp 2: Phân Hủy Hydro Peroxide (H₂O₂)
Phương pháp này sử dụng dung dịch Hydro Peroxide (H₂O₂) 3% và Mangan Dioxit (MnO₂) làm chất xúc tác. Phản ứng xảy ra ở nhiệt độ phòng, tạo oxy nhanh chóng (5-10 phút) với hiệu suất cao 90%.
Phương pháp này rất phổ biến vì tính an toàn, nhanh chóng và không yêu cầu gia nhiệt. Phản ứng sử dụng một chất xúc tác để tăng tốc độ phân hủy H₂O₂ thành nước và oxy.
2H₂O₂ —(MnO₂)→ 2H₂O + O₂
Chuẩn bị
Chuẩn bị 10ml H₂O₂ 3%, 0.5g MnO₂, bình tam giác, phễu nhỏ giọt và bộ dụng cụ thu khí.
- Hóa chất: Khoảng 10ml dung dịch H₂O₂ nồng độ 3%, 0.5g Mangan Dioxit (MnO₂), một hợp chất của Mangan.
- Dụng cụ: Bình tam giác, phễu nhỏ giọt, ống dẫn khí, bình thu khí.
Các bước tiến hành
Chỉ cần cho H₂O₂ tiếp xúc với chất xúc tác MnO₂, phản ứng sẽ tự xảy ra và giải phóng khí oxy để thu thập.
- Cho 0.5g bột MnO₂ vào bình tam giác.
- Đổ dung dịch H₂O₂ vào phễu nhỏ giọt đã được lắp trên miệng bình.
- Mở khóa phễu để H₂O₂ chảy từ từ xuống bình. Phản ứng xảy ra ngay lập tức, bọt khí oxy nổi lên mạnh mẽ.
- Dẫn khí oxy qua ống và thu vào bình chứa.
Phương Pháp 3: Điện Phân Nước (H₂O)
Đây là phương pháp tạo oxy tinh khiết nhất (99.9%) bằng cách dùng dòng điện một chiều để phân tách phân tử nước thành khí oxy và hydro. Quá trình này được gọi là điện phân dung dịch.
Đây là phương pháp tạo ra oxy có độ tinh khiết cao nhất, thường được dùng khi cần nguồn oxy sạch cho các thí nghiệm nhạy cảm. Quá trình này được gọi là điện phân dung dịch.
2H₂O —(Điện phân)→ 2H₂ + O₂
Chuẩn bị
Cần có bình điện phân, điện cực, nguồn điện một chiều và dung dịch điện li (nước cất pha vài giọt H₂SO₄).
- Hóa chất: Nước cất, vài giọt dung dịch Axit Sunfuric (H₂SO₄) để tăng khả năng dẫn điện.
- Dụng cụ: Bình điện phân (như bình Hofmann), 2 điện cực (thường là Platin hoặc than chì), nguồn điện một chiều (6-12V).
Các bước tiến hành
Quy trình bao gồm nạp dung dịch vào bình, kết nối điện cực với nguồn điện, và thu khí oxy ở cực dương (anot).
- Đổ nước cất đã pha vài giọt H₂SO₄ loãng vào đầy bình điện phân.
- Nối hai điện cực với các cực tương ứng của nguồn điện một chiều.
- Bật nguồn điện. Khí Oxy (O₂) sẽ được giải phóng ở cực dương (anot) và khí Hydro (H₂) ở cực âm (catot) với tỉ lệ thể tích H₂:O₂ là 2:1.
So Sánh Nhanh 3 Phương Pháp
Bảng so sánh chi tiết về ưu điểm, nhược điểm, hiệu suất và thời gian của 3 phương pháp điều chế oxy: phân hủy KMnO₄, phân hủy H₂O₂, và điện phân nước, giúp lựa chọn phương pháp phù hợp nhất.
| Tiêu Chí | Phân Hủy KMnO₄ | Phân Hủy H₂O₂ | Điện Phân H₂O |
|---|---|---|---|
| Ưu điểm | Dễ làm, rẻ tiền | Nhanh, an toàn, không cần nhiệt | Oxy tinh khiết cao (99.9%) |
| Nhược điểm | Cần đun nóng, lẫn tạp chất | Oxy lẫn hơi nước | Cần thiết bị, tốn điện |
| Hiệu suất | ~ 80% | ~ 90% | > 95% |
| Thời gian | 10-15 phút | 5-10 phút | 20-30 phút |
Lưu Ý Quan Trọng Về An Toàn Hóa Chất
An toàn là ưu tiên hàng đầu khi điều chế oxy. Luôn sử dụng đầy đủ trang bị bảo hộ, tránh xa nguồn lửa do oxy duy trì sự cháy mạnh và nắm vững cách kiểm tra khí thu được.
Khi làm việc trong phòng thí nghiệm, an toàn là trên hết. Hãy luôn tuân thủ các quy tắc về bảo quản hóa chất và nhận thức rõ về tác hại của hóa chất nếu không sử dụng đúng cách.
- Trang bị bảo hộ: Luôn đeo kính bảo hộ và găng tay để tránh bị bỏng nhiệt hoặc hóa chất ăn mòn.
- Phòng chống cháy nổ: Oxy là một chất oxi hóa mạnh, duy trì sự cháy. Tuyệt đối không để nguồn lửa hoặc tia lửa điện gần khu vực thí nghiệm.
- Kiểm tra khí: Cách đơn giản nhất để nhận biết oxy là dùng que đóm còn tàn đỏ. Đưa que đóm vào miệng bình thu khí, nếu que đóm bùng cháy trở lại, chứng tỏ trong bình có oxy.
Câu Hỏi Thường Gặp (FAQs)
Giải đáp các thắc mắc phổ biến về độc tính của oxy, cách nhận biết bình chứa khí oxy công nghiệp và vai trò của axit trong phương pháp điện phân nước.
Khí Oxy có độc không?
Oxy không độc và cần thiết cho sự sống. Tuy nhiên, việc hít thở oxy ở nồng độ quá cao (trên 60%) và áp suất cao trong thời gian dài có thể gây ngộ độc oxy, ảnh hưởng đến phổi và hệ thần kinh trung ương.
Làm thế nào để phân biệt bình khí Oxy và các bình khí khác?
Theo tiêu chuẩn, các bình chứa oxy già công nghiệp và y tế thường được sơn màu xanh dương hoặc đen để dễ nhận biết và tránh nhầm lẫn.
Tại sao trong phương pháp điện phân cần thêm axit?
Nước tinh khiết là chất điện li rất yếu, dẫn điện kém. Việc thêm một ít axit mạnh như H₂SO₄ sẽ cung cấp ion H⁺ và SO₄²⁻, giúp dung dịch dẫn điện tốt hơn nhiều lần, từ đó đẩy nhanh quá trình điện phân và tăng hiệu suất tạo khí.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









