Kiến thức chuyên môn
Nhiệt lượng kế là gì? Nguyên lý, ứng dụng và cách sử dụng hiệu quả
Trong thế giới hóa học và vật lý, việc đo lường năng lượng là cực kỳ quan trọng. Một trong những công cụ không thể thiếu cho nhiệm vụ này chính là nhiệt lượng kế. Vậy nhiệt lượng kế là gì? Nó hoạt động ra sao và có những loại nào phổ biến?
Bài viết này sẽ cung cấp một cái nhìn toàn diện, từ định nghĩa cơ bản, nguyên lý hoạt động, công thức tính toán, đến hướng dẫn chi tiết cách sử dụng các loại nhiệt lượng kế phổ biến nhất hiện nay.
Nhiệt Lượng Kế Là Gì?
Nhiệt lượng kế (Calorimeter) là thiết bị khoa học chuyên dụng để đo lường lượng nhiệt (Q) tỏa ra hoặc hấp thụ trong một phản ứng hóa học hoặc một quá trình vật lý, hoạt động dựa trên sự thay đổi nhiệt độ của môi trường xung quanh.
Nhiệt lượng kế (Calorimeter) là một thiết bị khoa học được sử dụng để đo nhiệt lượng (Q) tỏa ra hoặc hấp thụ trong một biến đổi hóa học hoặc vật lý. Biến đổi này có thể là một phản ứng hóa học, sự thay đổi pha (như nóng chảy hoặc bay hơi), hoặc sự hòa tan của một chất.
Về cơ bản, thiết bị này hoạt động bằng cách đo sự thay đổi nhiệt độ của một môi trường đã biết (thường là nước) xung quanh quá trình cần đo, từ đó suy ra lượng nhiệt năng đã trao đổi.
Nguyên Lý Hoạt Động và Công Thức Tính
Nguyên lý hoạt động của nhiệt lượng kế tuân theo định luật bảo toàn năng lượng. Lượng nhiệt được tính toán chính xác thông qua công thức cơ bản: Q = m × c × ΔT, trong đó Q là nhiệt lượng, m là khối lượng, c là nhiệt dung riêng và ΔT là biến thiên nhiệt độ.
Nguyên tắc cốt lõi của nhiệt lượng kế dựa trên định luật bảo toàn năng lượng. Nhiệt lượng do phản ứng tỏa ra sẽ bằng nhiệt lượng mà môi trường (nước và chính nhiệt lượng kế) hấp thụ vào.
Công thức tính nhiệt lượng cơ bản được sử dụng là:
Q = m × c × ΔT
Trong đó:
- Q: Nhiệt lượng tỏa ra hoặc hấp thụ (Joule, kJ).
- m: Khối lượng của môi trường (thường là nước) (kg).
- c: Nhiệt dung riêng của môi trường (J/kg·K).
- ΔT: Biến thiên nhiệt độ (t₂ – t₁), được đo bằng các loại nhiệt kế phòng thí nghiệm có độ chính xác cao.
Đối với các hệ thống phức tạp hơn như Bomb Calorimeter, công thức có thể biến đổi thành Q = C × ΔT, với C là nhiệt dung tổng của toàn bộ hệ thống (nhiệt lượng kế và nước).
Phân Loại Nhiệt Lượng Kế Phổ Biến
Hiện nay có ba loại nhiệt lượng kế được sử dụng phổ biến nhất: Bomb Calorimeter (chuyên đo nhiệt đốt cháy), Differential Scanning Calorimeter – DSC (dùng để phân tích sự chuyển pha nhiệt của vật liệu), và Reaction Calorimeter (theo dõi nhiệt của phản ứng hóa học trong thời gian thực).
Có nhiều loại nhiệt lượng kế khác nhau, mỗi loại được thiết kế cho một mục đích cụ thể. Dưới đây là ba loại thông dụng nhất:
Bomb Calorimeter (Nhiệt Lượng Kế Bom)
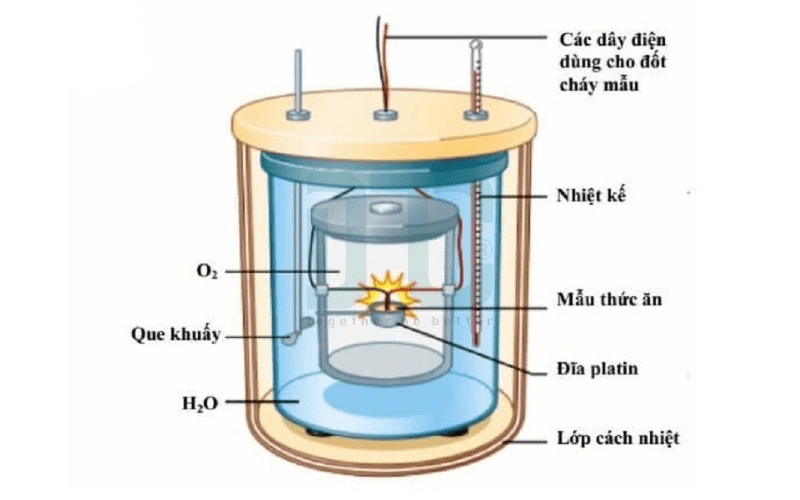
Bomb Calorimeter là thiết bị đo nhiệt của các phản ứng đốt cháy ở thể tích không đổi, thường dùng để xác định nhiệt trị (năng lượng) của nhiên liệu và thực phẩm. Thiết bị này cần được hiệu chuẩn bằng chất chuẩn như Axit Benzoic để đảm bảo độ chính xác.
Đây là thiết bị chuyên dụng để đo nhiệt của các phản ứng đốt cháy ở thể tích không đổi. Nó đặc biệt hữu ích trong việc xác định nhiệt trị (năng lượng) của nhiên liệu, thực phẩm.
- Nguyên tắc: Mẫu được đặt trong một bình kín chịu áp suất cao gọi là “bom” chứa đầy oxy tinh khiết. Bom được đặt trong một thùng chứa nước. Khi mẫu bị đốt cháy, nhiệt tỏa ra sẽ làm nóng nước và toàn bộ hệ thống.
- Ứng dụng: Xác định calo trong thực phẩm, đo nhiệt trị của than đá, xăng dầu.
Để đảm bảo độ chính xác, Bomb Calorimeter thường được hiệu chuẩn bằng cách đốt cháy một mẫu chuẩn có nhiệt trị đã biết, phổ biến nhất là Axit Benzoic.
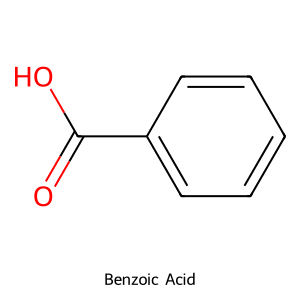
Cấu trúc phân tử Axit Benzoic (Chất chuẩn hiệu chỉnh Bomb Calorimeter)
Differential Scanning Calorimeter (DSC)
DSC là một kỹ thuật phân tích nhiệt đo lường sự chênh lệch dòng nhiệt giữa một mẫu và một mẫu tham chiếu khi cả hai được gia nhiệt. Nó rất mạnh mẽ trong việc xác định các điểm chuyển pha như nóng chảy, kết tinh của polymer, dược phẩm.
DSC là một kỹ thuật phân tích nhiệt mạnh mẽ, đo sự khác biệt về lượng nhiệt cần thiết để tăng nhiệt độ của một mẫu và một mẫu tham chiếu.
- Nguyên tắc: Mẫu và mẫu tham chiếu được đặt trong hai khay riêng biệt và được gia nhiệt đồng thời theo một chương trình nhiệt độ được kiểm soát. DSC sẽ đo dòng nhiệt chênh lệch giữa hai khay khi mẫu trải qua các quá trình chuyển pha như nóng chảy, kết tinh, hoặc phản ứng hóa học.
- Ứng dụng: Nghiên cứu tính chất của polymer, dược phẩm, kim loại. Xác định điểm nóng chảy, độ tinh khiết, và sự ổn định nhiệt của vật liệu.
Reaction Calorimeter (Nhiệt Lượng Kế Phản Ứng)
Reaction Calorimeter được thiết kế để theo dõi và đo lường nhiệt lượng sinh ra hoặc hấp thụ liên tục trong suốt quá trình phản ứng hóa học. Nó đóng vai trò quan trọng trong việc nghiên cứu động học phản ứng và đảm bảo an toàn quy trình sản xuất.
Đúng như tên gọi, loại này được thiết kế để theo dõi lượng nhiệt sinh ra hoặc hấp thụ trong suốt quá trình của một phản ứng hóa học trong thời gian thực.
- Nguyên tắc: Phản ứng diễn ra trong một bình được kiểm soát nhiệt độ chính xác. Thiết bị sẽ liên tục đo và bù trừ lượng nhiệt để duy trì nhiệt độ không đổi (đẳng nhiệt) hoặc theo một tốc độ gia nhiệt định sẵn. Lượng năng lượng cần để bù trừ chính là nhiệt lượng của phản ứng.
- Ứng dụng: Nghiên cứu động học phản ứng, tối ưu hóa quy trình sản xuất hóa chất, và đánh giá an toàn trong các phản ứng tỏa nhiệt mạnh.
Bảng So Sánh 3 Loại Nhiệt Lượng Kế
Bảng so sánh cho thấy Bomb Calorimeter có độ chính xác cao nhất (±0.1%) cho đo nhiệt đốt cháy, DSC linh hoạt cho phân tích chuyển pha với mẫu nhỏ, và Reaction Calorimeter lý tưởng để theo dõi phản ứng thực tế dù thiết lập phức tạp.
| Tiêu Chí | Bomb Calorimeter | Differential Scanning Calorimeter (DSC) | Reaction Calorimeter |
|---|---|---|---|
| Mục đích chính | Đo nhiệt đốt cháy | Phân tích chuyển pha nhiệt | Theo dõi động học phản ứng |
| Ưu điểm | Độ chính xác cao, đo nhiệt trị lớn | Nhanh, mẫu nhỏ, đa năng | Dữ liệu thời gian thực, an toàn |
| Nhược điểm | Phá hủy mẫu, chỉ đo đẳng tích | Không đo được nhiệt trị lớn | Thiết lập phức tạp, tốn thời gian |
| Lượng mẫu | ~1 gram | 5 – 10 miligram | Vài ml đến vài lít |
| Độ chính xác | ±0.1% | ±0.5% | ±1% |
Những Lưu Ý Quan Trọng Khi Sử Dụng
Để đảm bảo kết quả đo chính xác và an toàn, người dùng phải tuyệt đối tuân thủ các nguyên tắc: hiệu chuẩn định kỳ bằng chất chuẩn, đảm bảo cân bằng nhiệt, ưu tiên an toàn lao động và kiểm tra kỹ hệ thống để tránh rò rỉ.
Để đảm bảo kết quả đo chính xác và an toàn, người dùng cần tuân thủ các nguyên tắc sau:
- Hiệu chuẩn định kỳ: Luôn hiệu chuẩn thiết bị, đặc biệt là Bomb Calorimeter, bằng các chất chuẩn như Axit Benzoic từ các nhà cung cấp uy tín như Sigma-Aldrich.
- Đảm bảo cân bằng nhiệt: Luôn khuấy đều môi trường (nước) và chờ cho nhiệt độ ổn định hoàn toàn trước và sau khi đo để tránh sai số.
- An toàn là trên hết: Sử dụng đầy đủ đồ bảo hộ như găng tay, kính mắt khi làm việc với oxy nén, áp suất cao hoặc các hóa chất nguy hiểm.
- Kiểm tra rò rỉ: Trước mỗi lần sử dụng Bomb Calorimeter, phải kiểm tra kỹ hệ thống để đảm bảo không có sự rò rỉ khí oxy.
Câu Hỏi Thường Gặp (FAQs)
Nhiệt lượng kế đo đại lượng nào?
Nhiệt lượng kế đo nhiệt lượng (Q) trao đổi trong một quá trình, được tính gián tiếp qua sự thay đổi nhiệt độ của hệ thống.
Làm thế nào để hiệu chuẩn Bomb Calorimeter?
Sử dụng khoảng 1g Axit Benzoic tinh khiết, tiến hành đốt cháy và so sánh nhiệt lượng đo được với giá trị nhiệt trị chuẩn của nó (khoảng 26.454 kJ/g) để tính ra nhiệt dung của hệ thống.
DSC thường được dùng cho loại vật liệu nào?
DSC rất lý tưởng cho việc phân tích các loại polymer, dược phẩm, hợp kim kim loại, và các vật liệu hữu cơ để xác định điểm nóng chảy, điểm chuyển thủy tinh và các quá trình chuyển pha khác.
Sai lầm phổ biến nhất khi đo nhiệt lượng là gì?
Những sai lầm thường gặp bao gồm không khuấy đều dung dịch dẫn đến ΔT không chính xác, bỏ qua nhiệt dung của chính nhiệt lượng kế (phần nhiệt mà vỏ máy hấp thụ), và hiệu chuẩn thiết bị không đúng cách.
Hy vọng bài viết chi tiết này đã giúp bạn hiểu rõ “Nhiệt lượng kế là gì” cũng như cách thức hoạt động và ứng dụng của chúng. Việc nắm vững kỹ thuật này là nền tảng cho nhiều nghiên cứu và ứng dụng quan trọng trong khoa học và công nghiệp.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









