Kiến thức chuyên môn
Amoniac (NH₃): Liên Kết, Tính Bazơ & Ứng Dụng | Doanh Tín
Amoniac (NH₃) là một trong những hợp chất vô cơ được sản xuất nhiều nhất trên thế giới, đóng vai trò nền tảng cho vô số ngành công nghiệp. Tuy nhiên, đằng sau công thức hóa học quen thuộc là những đặc tính phân tử phức tạp quyết định đến hành vi và ứng dụng của nó. Trong bài phân tích chuyên sâu này, đội ngũ chuyên gia của Hóa Chất Doanh Tín sẽ làm rõ câu hỏi cốt lõi: NH₃ là liên kết gì?, tại sao nó là một bazơ, và làm thế nào để khai thác tiềm năng của nó một cách an toàn và hiệu quả.
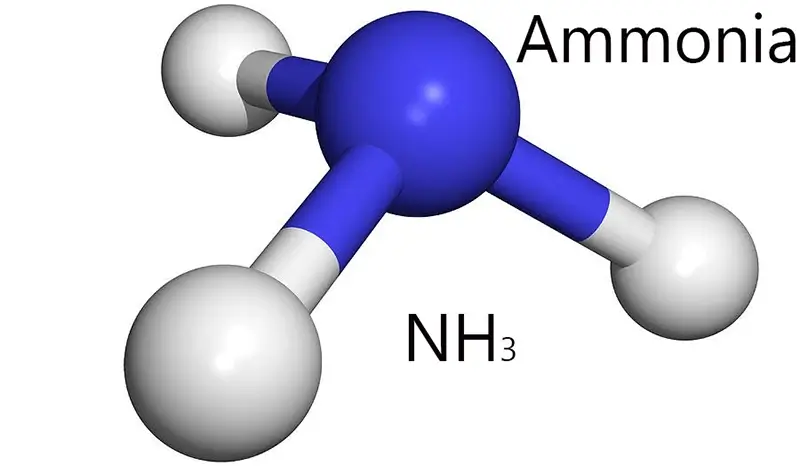
Cấu Trúc Phân Tử và Loại Liên Kết Của NH₃ là gì?
Để hiểu rõ bản chất của amoniac, chúng ta cần bắt đầu từ cấu trúc electron và hình học phân tử của nó.
Liên kết trong Amoniac (NH₃) là loại liên kết gì?
Liên kết trong phân tử Amoniac (NH₃) là liên kết cộng hóa trị phân cực.
Đây là một khái niệm cơ bản trong hóa học, tương tự như các liên kết trong phân tử metan (CH₄).
- Cấu tạo: Phân tử NH₃ được tạo thành từ 1 nguyên tử Nitơ (N) liên kết với 3 nguyên tử Hydro (H). Bạn có thể tra cứu vị trí của các nguyên tố này trong bảng tuần hoàn hóa học.
- Sự chênh lệch độ âm điện: Nitơ có độ âm điện cao hơn đáng kể (khoảng 3.04) so với Hydro (khoảng 2.20). Sự chênh lệch này làm cho các cặp electron dùng chung trong liên kết N-H bị hút lệch về phía nguyên tử Nitơ.
- Kết quả: Điều này tạo ra các điện tích riêng phần: Nitơ mang điện tích âm (δ-) và các nguyên tử Hydro mang điện tích dương (δ+). Do đó, mỗi liên kết N-H là một liên kết cộng hóa trị phân cực.
Tại sao toàn bộ phân tử NH₃ lại phân cực?
Phân tử NH₃ phân cực do có cấu trúc hình học chóp tam giác không đối xứng, khiến cho sự phân bố điện tích tổng thể không đồng đều.
Không chỉ liên kết N-H phân cực, mà toàn bộ phân tử NH₃ cũng là một phân tử phân cực. Nguyên nhân đến từ cấu trúc hình học của nó.
- Cấu trúc chóp tam giác: Nguyên tử Nitơ còn một cặp electron không liên kết (cặp electron tự do). Cặp electron này đẩy 3 cặp electron liên kết N-H, tạo thành cấu trúc hình chóp tam giác với nguyên tử Nitơ ở đỉnh và 3 nguyên tử Hydro ở đáy. Góc liên kết H-N-H là khoảng 107.8°.
- Tính phân cực tổng thể: Do cấu trúc không đối xứng và sự phân bố điện tích không đồng đều, tổng hợp các vector moment lưỡng cực của các liên kết N-H không bị triệt tiêu. Kết quả là toàn bộ phân tử NH₃ có một moment lưỡng cực, khiến nó trở thành một dung môi phân cực tốt.
Liên kết hydro trong amoniac có vai trò gì?
Liên kết hydro giải thích tại sao amoniac có nhiệt độ sôi cao bất thường và khả năng hòa tan tốt trong nước.
Một đặc tính thường bị bỏ qua nhưng cực kỳ quan trọng là khả năng tạo liên kết hydro của amoniac. Do sự phân cực mạnh và cặp electron tự do trên Nitơ, phân tử NH₃ có thể tạo liên kết yếu với nguyên tử Hydro của các phân tử NH₃ khác. Liên kết hydro này giải thích tại sao amoniac có nhiệt độ sôi (-33.34 °C) cao hơn đáng kể so với các phân tử có khối lượng tương tự (ví dụ metan CH₄: -161.5 °C) và khả năng hòa tan tốt trong nước, một chủ đề liên quan đến độ tan.
Tại sao NH₃ được coi là một bazơ yếu điển hình?
Trong hóa học, NH₃ luôn được biết đến là một bazơ yếu. Tính chất này không phải ngẫu nhiên mà được quyết định bởi chính cấu trúc electron đã phân tích ở trên.
Cặp electron tự do đóng vai trò gì trong việc quyết định tính bazơ của NH₃?
Theo thuyết Lewis, cặp electron tự do trên nguyên tử Nitơ sẵn sàng cho đi hoặc chia sẻ với ion H⁺, đây chính là nguồn gốc tính bazơ của amoniac.
Theo thuyết axit-bazơ của Lewis, một bazơ là một chất có khả năng cho đi một cặp electron. Nguyên tử Nitơ trong NH₃ có một cặp electron tự do. Cặp electron này sẵn sàng cho đi hoặc chia sẻ với các chất khác thiếu electron, điển hình là ion H⁺. Đây chính là nguồn gốc tính bazơ của amoniac.
NH₃ + H₂O ⇌ NH₄⁺ + OH⁻
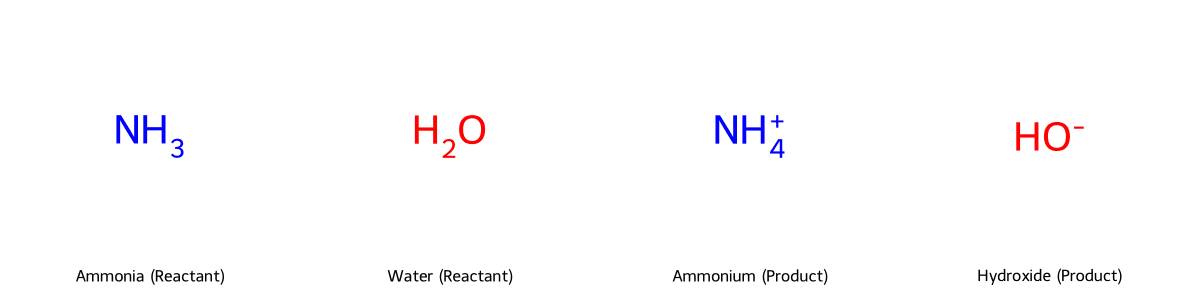
Phản ứng này sinh ra ion hydroxide (OH⁻), làm tăng độ pH của dung dịch và thể hiện tính bazơ. Tuy nhiên, đây là một phản ứng thuận nghịch và chỉ một phần nhỏ các phân tử NH₃ phản ứng với nước, do đó NH₃ được xếp vào loại bazơ yếu với hằng số phân ly bazơ (Kb) là 1.8 x 10⁻⁵.
Làm thế nào để nhận biết tính bazơ của Amoniac?
Có thể nhận biết tính bazơ của amoniac qua việc nó làm quỳ tím ẩm hóa xanh, làm phenolphtalein hóa hồng, và phản ứng với axit.
- Làm giấy quỳ tím ẩm hóa xanh.
- Làm dung dịch phenolphtalein (một loại chất chỉ thị) không màu chuyển sang màu hồng.
- Phản ứng mạnh với axit để tạo thành muối amoni.
GÓC NHÌN CHUYÊN GIA
Bà Nguyễn Thị Mỹ Linh, Trưởng phòng Kỹ thuật Hóa Chất Doanh Tín chia sẻ: “Nhiều khách hàng thường chỉ quan tâm đến nồng độ, nhưng chính hằng số bazơ Kb=1.8×10⁻⁵ mới là chỉ số nói lên sức mạnh thực sự của dung dịch amoniac. Hiểu được đây là một bazơ yếu giúp chúng tôi tư vấn cho khách hàng trong ngành dệt nhuộm sử dụng liều lượng chính xác để điều chỉnh pH, một kỹ thuật liên quan đến 4 công thức tính pH, mà không gây sốc cho môi trường bể nhuộm, tiết kiệm chi phí và bảo vệ vật liệu.”
Những Phản Ứng Hóa Học Quan Trọng Của Amoniac là gì?
Với vai trò là một bazơ và một chất khử, NH₃ tham gia vào nhiều phản ứng hóa học quan trọng trong cả phòng thí nghiệm và công nghiệp.
Phản ứng của NH₃ với Axit diễn ra như thế nào?
NH₃ phản ứng với axit mạnh tạo thành muối amoni. Ví dụ, với HCl, nó tạo ra khói trắng của amoni clorua (NH₄Cl).
NH₃ dễ dàng phản ứng với các axit mạnh để tạo thành muối amoni. Ví dụ kinh điển là phản ứng với axit clohydric (HCl), tạo ra khói trắng là các tinh thể amoni clorua (NH₄Cl).
NH₃(k) + HCl(k) ⟶ NH₄Cl(r)
Phản ứng Oxi Hóa – Khử của NH₃ với Oxi tạo ra sản phẩm gì?
Tùy thuộc vào điều kiện, phản ứng tạo ra khí Nitơ (N₂) và nước (không có xúc tác) hoặc Nitric oxit (NO) và nước (có xúc tác Pt).
Amoniac có thể bị oxi hóa bởi oxy, nhưng sản phẩm tạo thành phụ thuộc vào điều kiện phản ứng.
- Khi không có chất xúc tác: NH₃ cháy trong oxy tạo ra khí Nitơ và hơi nước.
4NH₃ + 3O₂ ⟶ 2N₂ + 6H₂O - Khi có xúc tác (như Platinum, Pt) và nhiệt độ cao (850–900 °C): Đây là phản ứng quan trọng trong công nghiệp để sản xuất axit nitric.
4NH₃ + 5O₂ ⟶ 4NO + 6H₂O
Hiện tượng gì xảy ra khi NH₃ phản ứng với dung dịch muối?
Dung dịch amoniac có khả năng tạo kết tủa hydroxide của nhiều kim loại, ví dụ như kết tủa keo trắng Al(OH)₃.
Dung dịch amoniac có khả năng tạo kết tủa hydroxide của nhiều kim loại. Ví dụ, khi cho dung dịch NH₃ vào dung dịch nhôm clorua (AlCl₃), sẽ xuất hiện kết tủa keo trắng của nhôm hydroxide.
AlCl₃ + 3NH₃ + 3H₂O ⟶ Al(OH)₃↓ + 3NH₄Cl
NH₃ thể hiện tính khử mạnh như thế nào khi phản ứng với Oxit Kim Loại?
Ở nhiệt độ cao, NH₃ có thể khử một số oxit kim loại (như CuO) về kim loại tương ứng, ví dụ từ CuO màu đen thành Cu màu đỏ.
Ở nhiệt độ cao, NH₃ có thể khử một số oxit kim loại (như CuO, PbO) về kim loại tương ứng. Ví dụ, khi dẫn khí NH₃ qua bột đồng (II) oxit (CuO) màu đen và đun nóng, chất rắn sẽ chuyển dần sang màu đỏ của kim loại đồng (Cu).
2NH₃ + 3CuO ⟶ N₂ + 3Cu + 3H₂O
Các Ứng Dụng Công Nghiệp Đa Dạng Của Amoniac là gì?
Amoniac là một hóa chất công nghiệp thiết yếu. Tại Hóa Chất Doanh Tín, chúng tôi cung cấp amoniac (NH₃) chất lượng cao cho các ứng dụng then chốt sau:
- Sản xuất phân bón: Đây là ứng dụng lớn nhất, chiếm hơn 80% sản lượng amoniac toàn cầu, dùng để sản xuất phân urê, amoni nitrat (NH₄NO₃), và supephotphat.
- Sản xuất Axit Nitric (HNO₃): Là nguyên liệu đầu vào cho quá trình Ostwald để sản xuất HNO₃ công nghiệp.
- Công nghiệp lạnh: Amoniac lỏng (R717) là một chất làm lạnh hiệu quả và thân thiện với môi trường, được sử dụng rộng rãi trong các kho lạnh, nhà máy chế biến thủy sản, thực phẩm.
- Xử lý nước và khí thải: Amoniac được dùng để trung hòa các thành phần axit trong nước thải và khử NOx trong khí thải công nghiệp, một ứng dụng trong các hệ thống tháp xử lý khí (scrubber).
- Ngành dệt may: Amoniac lỏng được sử dụng trong quá trình xử lý vải, làm mềm và tạo độ bền màu.
- Sản xuất hóa chất khác: Là tiền chất để sản xuất thuốc nổ, dược phẩm, thuốc nhuộm và nhiều hợp chất chứa nitơ khác.
Case Study: Tối Ưu Hóa Hệ Thống Làm Lạnh Bằng Amoniac cho Nhà Máy Thủy Sản ABC
- Thách thức: Nhà máy ABC gặp tình trạng tiêu thụ năng lượng cao và hiệu suất làm lạnh không ổn định.
- Giải pháp của Doanh Tín: Chúng tôi tiến hành khảo sát và nhận thấy amoniac đang sử dụng lẫn nhiều tạp chất. Doanh Tín đã cung cấp amoniac lỏng (R717) với độ tinh khiết >99.98%, đồng thời tư vấn điều chỉnh áp suất vận hành hệ thống.
- Kết quả: Nhà máy ABC giảm 15% chi phí điện năng cho hệ thống lạnh và tăng 20% hiệu suất cấp đông, đảm bảo chất lượng sản phẩm xuất khẩu.
Cần Tuân Thủ Những Tiêu Chuẩn An Toàn Nào Khi Sử Dụng và Lưu Trữ Amoniac?
Amoniac là một hóa chất có mùi khai, hắc và có thể gây nguy hiểm nếu không được xử lý đúng cách. Hóa Chất Doanh Tín luôn nhấn mạnh tầm quan trọng của việc bảo quản hóa chất an toàn.
- Trang bị bảo hộ cá nhân (PPE): Luôn đeo kính bảo hộ, găng tay chống hóa chất, và mặt nạ phòng độc phù hợp khi làm việc trong môi trường có nồng độ NH₃ cao.
- Thông gió: Khu vực làm việc, lưu trữ phải được thông gió tốt để tránh tích tụ khí.
- Lưu trữ: Amoniac lỏng phải được chứa trong các bồn chịu áp lực, làm từ vật liệu tương thích (thép carbon) và đặt ở nơi khô ráo, thoáng mát, tránh xa nguồn nhiệt và các vật liệu không tương thích (axit, chất oxi hóa mạnh).
- Tuân thủ quy định: Việc sử dụng và vận chuyển amoniac phải tuân thủ nghiêm ngặt các quy định của pháp luật Việt Nam, ví dụ như Nghị định 113/2017/NĐ-CP và các quy định về ghi nhãn hóa chất theo GHS.
Các Câu Hỏi Thường Gặp (FAQ)
Amoniac có độc không?
Có. Hít phải amoniac nồng độ cao có thể gây kích ứng nghiêm trọng cho hệ hô hấp, mắt và da.
Việc tuân thủ các biện pháp an toàn là bắt buộc.
Tại sao nước tiểu có mùi khai của amoniac?
Mùi khai xuất hiện do vi khuẩn phân hủy urê (hợp chất không mùi trong nước tiểu) thành amoniac.
Cơ thể chuyển hóa protein tạo ra urê, một hợp chất không mùi. Tuy nhiên, nếu nước tiểu để lâu, vi khuẩn sẽ phân hủy urê thành amoniac, gây ra mùi khai đặc trưng.
Làm thế nào để phân biệt amoniac và amoni?
Amoniac (NH₃) là một phân tử trung hòa, trong khi Amoni (NH₄⁺) là một cation (ion dương).
Amoniac (NH₃) là một phân tử trung hòa, ở dạng chất khí hoặc dung dịch. Amoni (NH₄⁺) là một cation đa nguyên tử mang điện tích dương, được tạo thành khi amoniac nhận một proton (H⁺), thường tồn tại trong các hợp chất muối.
Nồng độ amoniac thương mại là bao nhiêu?
Dung dịch amoniac đậm đặc thường có nồng độ 25-30%, trong khi amoniac lỏng công nghiệp (khan) có độ tinh khiết trên 99.5%.
Vì sao nên chọn Hóa Chất Doanh Tín làm đối tác cung cấp Amoniac?
Việc hiểu rõ NH₃ là liên kết gì và các tính chất của nó là bước đầu tiên để ứng dụng hiệu quả. Bước tiếp theo là lựa chọn một nhà cung cấp đáng tin cậy.
Tại Hóa Chất Doanh Tín, chúng tôi không chỉ cung cấp sản phẩm amoniac với độ tinh khiết và chất lượng được đảm bảo, mà còn mang đến giải pháp toàn diện:
- Tư vấn kỹ thuật: Đội ngũ chuyên gia của chúng tôi sẵn sàng tư vấn về ứng dụng, liều lượng và quy trình sử dụng tối ưu cho từng ngành.
- An toàn và tuân thủ: Chúng tôi cung cấp đầy đủ tài liệu an toàn hóa chất (MSDS) và hỗ trợ khách hàng trong việc tuân thủ các quy định hiện hành.
- Vận chuyển chuyên nghiệp: Hệ thống logistics của chúng tôi đảm bảo giao hàng an toàn, đúng tiến độ tới các KCN tại Bình Dương, Đồng Nai, TP.HCM và trên toàn quốc.
Nếu bạn có nhu cầu về amoniac hoặc cần tư vấn sâu hơn về các giải pháp hóa chất công nghiệp, hãy liên hệ ngay với Hóa Chất Doanh Tín để được hỗ trợ.
Lưu ý: Thông tin trong bài viết này chỉ mang tính chất tham khảo kỹ thuật. Luôn tham khảo Tài liệu An toàn Hóa chất (MSDS) và tuân thủ quy trình vận hành tiêu chuẩn khi làm việc với amoniac.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









