Kiến thức chuyên môn
Natri Phenolat Là Gì? Ứng Dụng & Những Lưu Ý Khi Sử Dụng
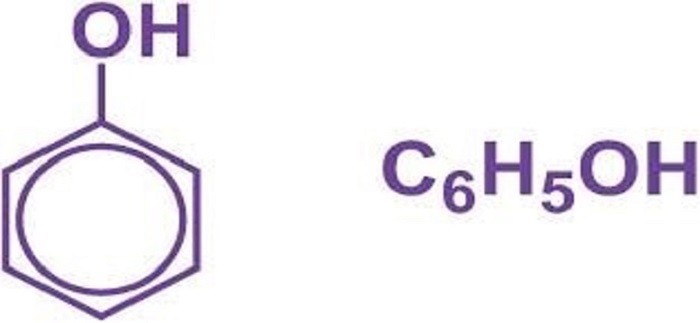
Natri phenolat (công thức hóa học: ![]() ), còn được gọi là phenolate natri, là muối natri của phenol. Hợp chất này thuộc nhóm phenolate và được hình thành khi phenol (
), còn được gọi là phenolate natri, là muối natri của phenol. Hợp chất này thuộc nhóm phenolate và được hình thành khi phenol (![]() ) phản ứng với một bazơ mạnh như natri hidroxit (NaOH), trong đó nguyên tử hydro trong nhóm hydroxyl (-OH) của phenol được thay thế bằng nguyên tử natri.
) phản ứng với một bazơ mạnh như natri hidroxit (NaOH), trong đó nguyên tử hydro trong nhóm hydroxyl (-OH) của phenol được thay thế bằng nguyên tử natri.
Ở điều kiện thường, natri phenolat tồn tại dưới dạng tinh thể rắn màu trắng hoặc vàng nhạt. Nó có tính kiềm đặc trưng, tan tốt trong nước nhưng không tan trong các dung môi hữu cơ phổ biến như benzen.
Thông số kỹ thuật cơ bản:
- Khối lượng phân tử: 116,09 g/mol
- Điểm nóng chảy: 255°C (Giá trị này có thể thay đổi tùy thuộc vào độ tinh khiết, một số nguồn ghi nhận ở mức cao hơn)
- Điểm sôi: 384°C
- Tên gọi khác: Natri phenoxide, natri benzenolate, natri hydroxybenzen, muối natri của phenol.
Nhờ khả năng tăng tính bazơ và độ hòa tan của phenol, natri phenolat đóng vai trò quan trọng như một chất nền thiết yếu trong nhiều quy trình tổng hợp hữu cơ.
Tính Chất Hóa Học của Natri Phenolat
Natri phenolat có tính kiềm mạnh do bị thủy phân trong nước, phản ứng với axit (kể cả axit yếu như
) để tái tạo phenol. Nó cũng có thể tham gia phản ứng thế ở vòng benzen (như phản ứng với
) và các phản ứng oxy hóa.
Natri phenolat sở hữu các đặc tính hóa học nổi bật, chủ yếu xuất phát từ cấu trúc của ion phenolat (![]() ) liên kết với ion
) liên kết với ion ![]() .
.
1. Tính Kiềm (Tính Bazơ)
Khi tan trong nước, ion phenolat (
) bị thủy phân, nhận proton (H+) từ nước, tạo ra
và ion
. Chính sự giải phóng
này làm cho dung dịch có tính kiềm mạnh.
Khi hòa tan trong nước, natri phenolat bị thủy phân và thể hiện tính kiềm mạnh, tạo ra dung dịch chứa ion hydroxide (![]() ) làm tăng độ pH của dung dịch.
) làm tăng độ pH của dung dịch.
Do có tính kiềm, nó có thể phản ứng với các axit yếu hơn, ví dụ như axit axetic:
Một phản ứng quan trọng chứng minh tính axit của phenol yếu hơn cả axit cacbonic là sục khí ![]() qua dung dịch natri phenolat, sẽ tạo ra phenol và natri hidrocacbonat:
qua dung dịch natri phenolat, sẽ tạo ra phenol và natri hidrocacbonat:
2. Phản ứng với Axit Mạnh
Natri phenolat phản ứng ngay lập tức với các axit mạnh (như HCl,
) để tạo lại phenol (
) và muối natri tương ứng. Đây là phản ứng trung hòa bazơ (phenolat) bằng axit.
Khi tác dụng với các axit mạnh, natri phenolat sẽ tái tạo lại phenol. Đây là phản ứng chứng minh tính axit của phenol yếu hơn các axit vô cơ mạnh.
3. Tính Oxy Hóa
Ion phenolat
(với nhóm
đẩy electron mạnh) làm vòng benzen trở nên rất hoạt động, dễ bị oxy hóa. Ví dụ, nó có thể tác dụng với halogen như khí clo.
Natri phenolat có thể bị oxy hóa trong những điều kiện cụ thể. Ví dụ, khi tác dụng với các halogen như khí clo:
Tính Chất Vật Lý của Natri Phenolat
Natri phenolat là chất rắn kết tinh màu trắng hoặc vàng nhạt, có mùi đặc trưng của phenol, tan tốt trong nước và rượu, nhưng không tan trong dung môi không phân cực (benzen). Nó có nhiệt độ nóng chảy cao (255°C) và khối lượng mol là 116,09 g/mol.
Các đặc điểm vật lý giúp nhận diện và ứng dụng hợp chất này trong thực tế:
- Trạng thái: Tồn tại ở dạng chất rắn kết tinh, có màu trắng hoặc ngả vàng nhạt.
- Mùi: Mang mùi đặc trưng của phenol, dễ nhận biết khi hòa tan.
- Độ hòa tan: Tan tốt trong nước, rượu (ancol) và axeton. Không tan trong các dung môi hữu cơ không phân cực như benzen.
- Nhiệt độ nóng chảy: 255°C, một mức nhiệt độ tương đối cao, cho thấy khả năng chịu nhiệt tốt của hợp chất.
- Khối lượng mol: 116,09 g/mol, là cơ sở để tính toán chính xác tỉ lệ các chất trong phản ứng hóa học.

Phương Pháp Tổng Hợp (Điều Chế) Natri Phenolat
Có 3 phương pháp chính: (1) Cho phenol tác dụng với NaOH (phổ biến, an toàn nhất), (2) Cho phenol tác dụng với kim loại Na (hiệu quả nhưng nguy hiểm cháy nổ), (3) Cho phenol tác dụng với natri hydride (NaH) (rất hiệu quả nhưng cực kỳ nguy hiểm).
Có ba phương pháp chính để điều chế natri phenolat, trong đó phương pháp sử dụng NaOH là phổ biến nhất.
4.1. Tổng Hợp Bằng NaOH Tác Động Lên Phenol
Đây là phương pháp phổ biến nhất, dựa trên phản ứng axit-bazơ đơn giản:
NaOH
. Phương pháp này an toàn, chi phí thấp và dễ thực hiện.
- Nguyên liệu: Phenol (
 ), natri hidroxit (NaOH).
), natri hidroxit (NaOH). - Phản ứng:
- Quy trình: Đây là phương pháp phổ biến, đơn giản và an toàn nhất. Phenol phản ứng trực tiếp với dung dịch NaOH trong môi trường kiềm, tạo ra natri phenolat và nước. Phương pháp này có chi phí thấp và dễ thực hiện trong cả phòng thí nghiệm lẫn quy mô công nghiệp.
4.2. Tổng Hợp Bằng Na Tác Động Lên Phenol
Phương pháp này dùng natri kim loại (chất khử mạnh) tác dụng với phenol, giải phóng khí hydro:
. Cần cẩn thận vì Na dễ cháy nổ.
- Quy trình: Natri kim loại (một chất khử mạnh) sẽ khử phenol và giải phóng khí hydro (
 ). Phương pháp này cho hiệu quả cao nhưng tiềm ẩn rủi ro vì natri kim loại rất dễ cháy nổ khi tiếp xúc với không khí hoặc nước.
). Phương pháp này cho hiệu quả cao nhưng tiềm ẩn rủi ro vì natri kim loại rất dễ cháy nổ khi tiếp xúc với không khí hoặc nước.
4.3. Tổng Hợp Bằng Natri Hydride (NaH) Tác Động Lên Phenol
Tương tự Na, NaH là một bazơ/chất khử rất mạnh, phản ứng với phenol:
. Phương pháp này rất hiệu quả nhưng ít dùng vì NaH nguy hiểm và đòi hỏi kỹ thuật cao.
- Nguyên liệu: Phenol (
 ), natri hydride (NaH).
), natri hydride (NaH). - Phản ứng:
- Quy trình: Tương tự như dùng Na, NaH cũng là một chất khử/bazơ rất mạnh, phản ứng với phenol tạo natri phenolat và khí
 . Đây là phương pháp hiệu quả nhưng ít phổ biến nhất do NaH là chất nguy hiểm, đòi hỏi các điều kiện kiểm soát an toàn cực kỳ nghiêm ngặt.
. Đây là phương pháp hiệu quả nhưng ít phổ biến nhất do NaH là chất nguy hiểm, đòi hỏi các điều kiện kiểm soát an toàn cực kỳ nghiêm ngặt.
Ứng Dụng của Natri Phenolat
Natri phenolat là một hóa chất trung gian quan trọng, được dùng để sản xuất dược phẩm (như aspirin, thuốc an thần), chất bảo quản (trong mỹ phẩm, thực phẩm), chất chống oxy hóa (cho cao su, nhựa), thuốc nhuộm, và hóa chất dệt may.
Natri phenolat là một hóa chất nền tảng có nhiều ứng dụng giá trị trong cả công nghiệp và đời sống hàng ngày.

5.1. Trong Ngành Công Nghiệp
Các ứng dụng công nghiệp chính bao gồm: làm chất trung gian sản xuất dược phẩm (ví dụ: trong tổng hợp axit salicylic để sản xuất Aspirin), hóa chất dệt may (chất kết dính, xử lý vải), sản xuất chất chống oxy hóa (như BHT), và trong tinh lọc dầu khí.
- Dệt may: Dùng làm chất kết dính và chất xử lý vải, giúp tăng khả năng bám màu và độ bền của thuốc nhuộm.
- Dược phẩm: Là chất trung gian quan trọng trong quá trình tổng hợp các loại thuốc kháng histamine, thuốc an thần và một số dược chất khác. Một trong những ứng dụng nổi tiếng nhất là phản ứng Kolbe–Schmitt, nơi natri phenolat phản ứng với
 dưới áp suất cao để tạo ra natri salicylate, tiền chất của Aspirin.
dưới áp suất cao để tạo ra natri salicylate, tiền chất của Aspirin. - Hóa chất: Sử dụng trong sản xuất chất chống oxy hóa (cho nhựa, cao su), chất tạo màu, và chất phân tán.
- Nhựa và cao su: Cải thiện khả năng chống ăn mòn và tăng độ bền cho vật liệu polymer.
- Sơn và mực in: Giúp tăng tính ổn định của công thức và hỗ trợ tạo màu.
- Dầu khí: Được sử dụng để loại bỏ các hợp chất axit (như mercaptan) ra khỏi dầu thô trong quá trình tinh lọc.
- Chất tạo màu và hương liệu: Ứng dụng trong sản xuất hương liệu tổng hợp và một số loại thuốc nhuộm.
5.2. Trong Đời Sống Hàng Ngày
Trong đời sống, nó được dùng chủ yếu làm phụ gia thực phẩm/mỹ phẩm với vai trò chất bảo quản (ngăn vi khuẩn, nấm mốc), chất chống oxy hóa (bảo vệ dầu mỡ), và thành phần trong xà phòng (tăng bọt).
- Bảo quản thực phẩm/mỹ phẩm: Hoạt động như một chất bảo quản hiệu quả, ngăn ngừa sự phát triển của vi khuẩn và nấm mốc trong kem dưỡng da, mỹ phẩm chống nắng. Đây là một ứng dụng phổ biến của phụ gia thực phẩm và mỹ phẩm.
- Chống oxy hóa thực phẩm: Bảo vệ các loại dầu và chất béo trong thực phẩm khỏi quá trình oxy hóa, giúp kéo dài thời hạn sử dụng.
- Sản xuất xà phòng: Tăng khả năng tạo bọt và làm sạch, liên quan đến quá trình xà phòng hóa.
- Phân tích hóa học: Dùng làm thuốc thử trong các quy trình kiểm tra và phân tích axit mạnh.
- Sản phẩm chăm sóc cá nhân: Có thể tìm thấy trong xà phòng, kem đánh răng, nước hoa với vai trò tạo màu hoặc tăng độ ổn định.
- Giấy và thực phẩm đóng hộp: Kiểm soát pH, bảo quản thực phẩm.
Natri Phenolat Có Độc Không? Lưu Ý Khi Sử Dụng và Bảo Quản
Natri phenolat không độc mạnh như phenol, nhưng có tính kiềm cao, gây ăn mòn và kích ứng nghiêm trọng cho da, mắt và hệ hô hấp. Tuyệt đối tuân thủ an toàn lao động, sử dụng đồ bảo hộ (găng tay, kính) và bảo quản nơi khô ráo, kín, tránh ẩm và không khí (
).
Natri phenolat không được coi là chất độc mạnh nếu sử dụng đúng cách và có biện pháp bảo hộ. Tuy nhiên, do tính kiềm mạnh, nó có thể gây nguy hiểm nếu tiếp xúc trực tiếp mà không được bảo vệ.
Nguy cơ tiềm ẩn
Các nguy cơ chính bao gồm: gây kích ứng, bỏng kiềm khi tiếp xúc với da; gây kích ứng đường hô hấp, khó thở khi hít phải bụi; và gây đau dạ dày, buồn nôn, nguy hiểm nếu nuốt phải.
- Tiếp xúc da: Có thể gây kích ứng nghiêm trọng, mẩn đỏ, ngứa rát, thậm chí là bỏng hóa chất do tính kiềm.
- Hít phải: Bụi hoặc hơi của natri phenolat có thể gây kích ứng đường hô hấp, dẫn đến khó thở, ho. (Tham khảo: Tác hại của hóa chất khi hít phải).
- Nuốt phải: Gây đau dạ dày, buồn nôn, ói mửa. Rất nguy hiểm nếu nuốt phải ở liều lượng cao.
- Tiếp xúc mắt: Cực kỳ nguy hiểm, có thể gây tổn thương giác mạc nghiêm trọng do tính kiềm.
Lưu ý an toàn khi sử dụng
Bắt buộc phải đeo găng tay chống hóa chất, kính bảo hộ (hoặc tấm che mặt) và khẩu trang/mặt nạ phòng độc. Làm việc ở nơi thông thoáng (tốt nhất là tủ hút) và tuyệt đối không ăn uống, hút thuốc khi làm việc.
- Trang bị bảo hộ: Luôn đeo găng tay chống hóa chất, kính bảo hộ, khẩu trang khi xử lý natri phenolat dạng rắn hoặc dung dịch.
- Thông gió: Làm việc trong môi trường thông thoáng, tốt nhất là dưới tủ hút khí độc, để tránh hít phải bụi/hơi.
- Tuyệt đối không nuốt: Không ăn, uống hoặc hút thuốc khi đang làm việc với hóa chất. Tìm kiếm y tế ngay lập tức nếu vô tình nuốt phải.
- Rửa sạch: Rửa tay thật kỹ bằng xà phòng sau khi tiếp xúc, ngay cả khi có đeo găng tay.
Hướng dẫn bảo quản
Phải bảo quản trong bao bì kín tuyệt đối, đặt ở nơi khô ráo, thoáng mát. Tránh xa nguồn nhiệt, ánh nắng và đặc biệt là không khí (vì nó sẽ phản ứng với hơi ẩm và
).
Việc bảo quản hóa chất đúng cách là vô cùng quan trọng để đảm bảo an toàn và chất lượng sản phẩm:
- Lưu trữ trong bao bì kín: Bao bì phải được đậy nắp, niêm phong kín để tránh tiếp xúc với không khí.
- Điều kiện khô ráo: Đặt ở nơi khô ráo, thoáng mát, tránh ẩm ướt tuyệt đối.
- Tránh nhiệt và ánh sáng: Tránh ánh nắng trực tiếp và các nguồn nhiệt, nguồn gây cháy nổ.
- Ngăn tiếp xúc với không khí: Natri phenolat sẽ bị hỏng (chuyển màu sẫm và tái tạo phenol) khi tiếp xúc với
 và hơi ẩm trong không khí.
và hơi ẩm trong không khí.
Kết luận
Natri phenolat là một hợp chất hữu ích với nhiều ứng dụng đa dạng từ công nghiệp nặng (dược phẩm, dệt nhuộm) đến sản phẩm tiêu dùng (chất bảo quản). Mặc dù mang lại nhiều lợi ích, việc hiểu rõ tính chất và tuân thủ nghiêm ngặt các quy tắc an toàn khi sử dụng và bảo quản là điều bắt buộc để bảo vệ sức khỏe con người và môi trường.
Để biết thêm thông tin về các loại hóa chất công nghiệp và dung môi, vui lòng truy cập website Hóa chất Doanh Tín hoặc liên hệ trực tiếp với chúng tôi để được tư vấn kỹ thuật chi tiết.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









