Kiến thức chuyên môn
N2H4 Là Gì? Hướng Dẫn Chi Tiết Về Hydrazine (Cập Nhật 2025)
Hydrazine, với công thức hóa học N₂H₄, là một hợp chất vô cơ quan trọng được biết đến với nhiều ứng dụng chuyên biệt. Trong bài viết này, Hóa chất Doanh Tín sẽ cùng bạn khám phá chi tiết N₂H₄ là gì, từ tính chất vật lý, hóa học, phương pháp điều chế cho đến các ứng dụng thực tiễn và những lưu ý an toàn không thể bỏ qua.
N₂H₄ Là Gì?
N₂H₄ là công thức hóa học của Hydrazine, một hợp chất vô cơ dạng lỏng, không màu, mùi khai, dễ cháy và là một chất khử cực mạnh, có công dụng chính trong nhiên liệu tên lửa và xử lý nước công nghiệp.
N₂H₄ là công thức hóa học của Hydrazine. Đây là một hợp chất vô cơ ở dạng lỏng, không màu, có mùi khai đặc trưng tương tự như amoniac (NH₃). Hydrazine có khả năng bốc khói trong không khí, dễ cháy và là một chất khử cực mạnh. Nhờ những đặc tính này, nó đóng vai trò không thể thiếu trong nhiều ngành công nghiệp, từ nhiên liệu tên lửa, xử lý nước nồi hơi đến nguyên liệu cho tổng hợp hóa học.
Tính Chất Vật Lý Nổi Bật Của Hydrazine
Hydrazine là chất lỏng không màu, bốc khói, mùi khai, sôi ở 113,5°C. Nó có tỷ trọng 1,004 g/cm³ và hòa tan tốt trong nước và ethanol.
Việc hiểu rõ tính chất vật lý giúp nhận diện, sử dụng và bảo quản hóa chất N₂H₄ một cách an toàn. Dưới đây là các đặc điểm vật lý chi tiết cập nhật đến năm 2025:
- Trạng thái: Dạng lỏng không màu, dễ bay hơi và bốc khói mạnh khi tiếp xúc với không khí ẩm.
- Mùi: Mùi khai nồng, hăng đặc trưng, tương tự amoniac (NH₃).
- Điểm sôi: 113,5°C (386.65 K) – cao hơn đáng kể so với amoniac (-33,3°C).
- Điểm đông đặc: 1,53°C (274.68 K).
- Tỷ trọng: 1,004 g/cm³ ở 20°C, xấp xỉ với tỷ trọng của nước.
- Độ hòa tan: Tan tốt trong nước và các dung môi phân cực như ethanol, metanol. Không tan trong các dung môi không phân cực như ether và chloroform.
Tính Chất Hóa Học Đặc Trưng Của N₂H₄
Hydrazine là một chất khử rất mạnh, phản ứng mãnh liệt với chất oxy hóa. Nó cũng là một base yếu, có khả năng tạo muối với acid và dễ bị phân hủy bởi nhiệt.
Hydrazine là một hóa chất có hoạt tính cao với các tính chất hóa học đặc trưng sau:
Tính Khử Mạnh
Đây là tính chất quan trọng nhất, giúp Hydrazine loại bỏ oxy và các chất oxy hóa khác, ứng dụng trong xử lý nước và nhiên liệu tên lửa.
Đây là tính chất nổi bật và quan trọng nhất của Hydrazine. Nó phản ứng mạnh với các chất oxy hóa. Phản ứng tiêu biểu là với khí oxy, tạo ra khí nitơ và nước, đồng thời giải phóng một lượng nhiệt lớn (ΔH = -622.2 kJ/mol).
N₂H₄ + O₂ ⟶ N₂ + 2H₂O
Phản ứng tỏa nhiệt mạnh này là cơ sở cho ứng dụng của Hydrazine trong xử lý nước nồi hơi và làm nhiên liệu tên lửa.
Tính Base Yếu
Hydrazine nhận proton (H⁺) từ acid để tạo thành muối hydrazinium, tương tự như amoniac nhưng có tính base yếu hơn.
Tương tự amoniac, Hydrazine có tính base yếu (hằng số base Kb = 8,5 × 10⁻⁷). Khi tác dụng với acid, nó tạo thành muối hydrazinium. Ví dụ, khi phản ứng với acid clohidric (HCl), nó tạo thành muối N₂H₅Cl hoặc N₂H₆Cl₂. Để kiểm tra tính base, có thể sử dụng các chất chỉ thị như giấy quỳ tím (chuyển sang màu xanh).
Phản Ứng Phân Hủy
Khi có nhiệt và xúc tác, N₂H₄ phân hủy thành các khí như N₂, H₂ và NH₃, giải phóng năng lượng lớn.
Ở nhiệt độ cao và có mặt các chất xúc tác kim loại (như Iridi, Sắt, Đồng), Hydrazine dễ dàng phân hủy thành nitơ, hydro và amoniac. Phản ứng này cũng tỏa nhiệt mạnh và được ứng dụng trong động cơ đẩy đơn nhiên liệu.
4. Các Phương Pháp Sản Xuất Hydrazine Phổ Biến
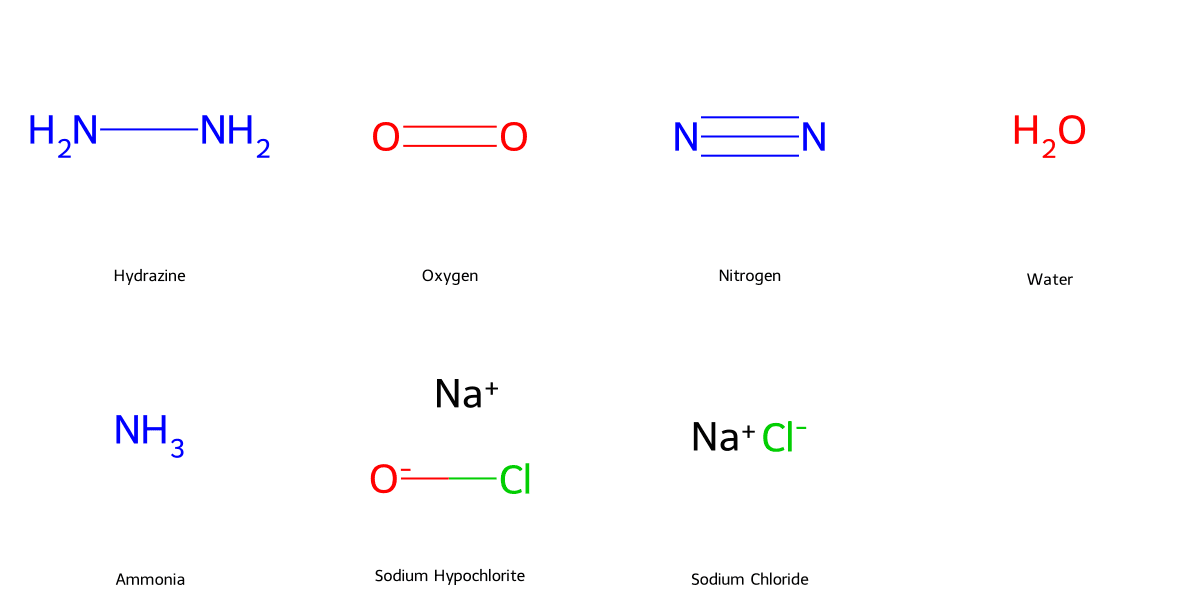
Ba phương pháp chính sản xuất Hydrazine là quy trình Olin-Raschig (dùng NaOCl và NH₃), quy trình Peroxide (dùng H₂O₂ và NH₃), và quy trình từ Urea.
Hydrazine có thể được sản xuất qua nhiều quy trình khác nhau, trong đó phổ biến và hiệu quả nhất là:
- Quy trình Olin-Raschig: Đây là phương pháp truyền thống, sử dụng Natri hypochlorite (NaOCl) hay còn gọi là Javen, để oxy hóa amoniac trong môi trường kiềm.
2NH₃ + NaOCl ⟶ N₂H₄ + NaCl + H₂O
Sản phẩm phụ của quá trình này là Natri Clorua (NaCl) và nước.
- Quy trình Peroxide (Pechiney-Ugine-Kuhlmann): Phương pháp này sử dụng hydro peroxide (H₂O₂) để oxy hóa amoniac với sự có mặt của ketone làm chất xúc tác. Quy trình này được coi là thân thiện với môi trường hơn do sản phẩm phụ chỉ là nước.
- Quy trình từ Urea: Cho Urea phản ứng với Natri hypochlorite để tạo ra hydrazine. Đây là phương pháp ít phổ biến hơn trong quy mô công nghiệp lớn.
Ứng Dụng Chính Của Hydrazine (N₂H₄)
N₂H₄ được dùng chủ yếu làm nhiên liệu cho tên lửa và tàu vũ trụ, chất khử oxy trong nước nồi hơi, và làm chất trung gian trong tổng hợp hóa dược, thuốc trừ sâu.
Nhờ các tính chất độc đáo, N₂H₄ được ứng dụng rộng rãi trong nhiều lĩnh vực công nghệ cao và công nghiệp:
- Nhiên liệu tên lửa: Hydrazine và các dẫn xuất của nó (như Monomethylhydrazine – MMH) là nhiên liệu phổ biến cho động cơ tên lửa đẩy và tàu vũ trụ do khả năng tự bốc cháy khi kết hợp với chất oxy hóa như N₂O₄, tạo ra lực đẩy lớn và hiệu quả.
- Xử lý nước nồi hơi: N₂H₄ được dùng làm chất khử oxy dư trong nước cấp cho nồi hơi và hệ thống sưởi ấm, giúp ngăn chặn quá trình ăn mòn đường ống và thiết bị. Liều lượng thường được duy trì ở mức rất thấp, khoảng 20-100 ppb (phần tỷ).
- Tổng hợp hóa học: Là một dung môi và chất khử quan trọng trong việc sản xuất dược phẩm (ví dụ: isoniazid), thuốc trừ sâu, và các hợp chất hữu cơ khác theo phản ứng Wolff-Kishner.
- Công nghiệp khác: Dùng trong sản xuất chất tạo bọt cho ngành nhựa (azodicarbonamide), chất chống oxy hóa cho cao su, và trong ngành mạ điện kim loại.
Lưu Ý Quan Trọng Về An Toàn Khi Sử Dụng N₂H₄
Hydrazine là chất cực độc, ăn mòn và có khả năng gây ung thư. Phải luôn sử dụng đồ bảo hộ đầy đủ (găng tay, kính, mặt nạ), làm việc trong khu vực thông gió tốt và bảo quản xa nguồn nhiệt.
Hydrazine là một hóa chất cực kỳ độc và nguy hiểm. Việc tuân thủ các quy tắc an toàn là bắt buộc để tránh những tác hại của hóa chất.
- An toàn lao động: Luôn trang bị đầy đủ đồ bảo hộ cá nhân (găng tay chống hóa chất, kính bảo hộ, mặt nạ phòng độc có phin lọc phù hợp). Thực hiện thao tác trong tủ hút khí độc để tránh hít phải hơi.
- Bảo quản: Lưu trữ Hydrazine trong các thùng chứa kín bằng vật liệu tương thích (thép không gỉ, teflon), đặt ở nơi khô ráo, thoáng mát, tránh xa nguồn nhiệt, ánh sáng mặt trời và các kim loại có thể làm xúc tác cho phản ứng phân hủy.
- Xử lý sự cố:
- Tiếp xúc da/mắt: Rửa ngay lập tức với nhiều nước trong ít nhất 15 phút và tìm kiếm sự trợ giúp y tế khẩn cấp.
- Hít phải: Di chuyển nạn nhân đến nơi không khí trong lành, giữ ấm và yên tĩnh, gọi cấp cứu.
- Tràn đổ: Cô lập khu vực. Sử dụng vật liệu thấm hút trơ (như cát, vermiculite) và xử lý như chất thải nguy hại theo quy định. Không dùng vật liệu dễ cháy như mùn cưa.
Câu Hỏi Thường Gặp Về Hydrazine
N₂H₄ có độc không?
Có. Hydrazine là chất độc, được xếp vào nhóm chất có khả năng gây ung thư cho người (Group 2A bởi IARC). Phơi nhiễm cấp tính có thể gây bỏng nặng cho da và mắt, tổn thương gan, thận và hệ thần kinh trung ương. Phơi nhiễm lâu dài dù ở nồng độ thấp cũng làm tăng nguy cơ ung thư.
Hydrazine được dùng trong xử lý nước nồi hơi như thế nào?
Nó được bơm định lượng vào nước cấp cho nồi hơi để loại bỏ oxy hòa tan thông qua phản ứng hóa học N₂H₄ + O₂ ⟶ N₂ + 2H₂O. Phản ứng này giúp bảo vệ các bề mặt kim loại của hệ thống khỏi bị ăn mòn oxy hóa, đặc biệt hiệu quả trong các hệ thống nồi hơi áp suất cao.
Xu hướng mới nhất về N₂H₄ năm 2025 là gì?
Các nghiên cứu đang tập trung vào việc phát triển các phương pháp sản xuất “xanh” và an toàn hơn, chẳng hạn như tổng hợp Hydrazine từ nitơ và nước bằng phương pháp điện hóa có xúc tác. Ngoài ra, việc tìm kiếm các nhiên liệu thay thế ít độc hại hơn cho tên lửa (như nhiên liệu gốc Hydroxylammonium nitrate) cũng đang là một xu hướng quan trọng.
Nếu bạn có nhu cầu mua hóa chất Hydrazine hoặc các sản phẩm hóa chất công nghiệp, hóa chất xử lý nước khác, hãy liên hệ ngay với Hóa chất Doanh Tín – cửa hàng hóa chất uy tín và chất lượng – để được tư vấn và nhận báo giá tốt nhất.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










