Kiến thức chuyên môn
Muối Axit Là Gì? Công Thức, Tính Chất Và Ứng Dụng Thực Tế
Trong hóa học, muối axit là một khái niệm nền tảng nhưng thường gây nhầm lẫn cho người mới bắt đầu. Liệu nó là muối hay axit? Làm thế nào để nhận biết và nó có vai trò gì trong cuộc sống?
Bài viết này sẽ cung cấp một cái nhìn toàn diện, từ định nghĩa, cách nhận biết, phương pháp điều chế đến các ứng dụng quan trọng của muối axit, giúp bạn nắm vững kiến thức một cách dễ dàng.

Muối Axit Là Gì?
Muối axit là muối mà gốc axit vẫn còn chứa nguyên tử hydro (H) có thể phân ly thành ion H⁺, được tạo thành từ phản ứng trung hòa không hoàn toàn giữa axit và bazơ.
Muối axit là hợp chất được hình thành khi nguyên tử hydro (H) trong phân tử axit nhiều nấc chỉ được thay thế một phần bởi cation kim loại hoặc cation amoni (NH₄⁺).
Điểm đặc trưng nhất của muối axit là anion (gốc axit) của nó vẫn còn chứa hydro có khả năng phân ly ra ion H⁺ trong dung dịch, làm cho dung dịch có tính axit nhẹ. Chúng là sản phẩm của phản ứng trung hòa không hoàn toàn giữa một axit và một bazơ.
Ví dụ điển hình:
Các muối axit phổ biến bao gồm Natri Hidrocacbonat (NaHCO₃), Kali Hidrosunfat (KHSO₄), và Canxi Đihidrophotphat (Ca(H₂PO₄)₂).
- Natri Hidrocacbonat (NaHCO₃): Được tạo ra khi một trong hai nguyên tử hydro của axit cacbonic (H₂CO₃) được thay thế bởi cation natri (Na⁺).
- Kali Hidrosunfat (KHSO₄): Hình thành khi một trong hai nguyên tử hydro của axit sunfuric (H₂SO₄) được thay thế bởi cation kali (K⁺).
- Canxi Đihidrophotphat (Ca(H₂PO₄)₂): Một muối axit quan trọng trong sản xuất phân bón.
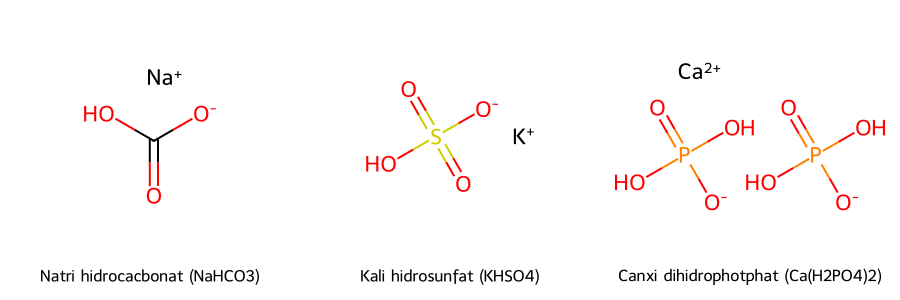
Cấu trúc hóa học của các muối axit phổ biến: Natri hidrocacbonat, Kali hidrosunfat, Canxi đihidrophotphat
3 Dấu Hiệu Nhận Biết Muối Axit
Nhận biết muối axit dựa vào công thức hóa học (còn H trong gốc axit), dung dịch có pH < 7 (làm quỳ tím hóa hồng), và khả năng phản ứng với bazơ để tạo muối trung hòa.
Để xác định một hợp chất có phải là muối axit hay không, bạn có thể dựa vào ba đặc điểm cốt lõi sau:
1. Công thức hóa học
Đây là dấu hiệu rõ ràng nhất. Công thức của muối axit luôn chứa:
- Cation: Kim loại hoặc NH₄⁺.
- Anion (gốc axit): Vẫn còn chứa nguyên tử hydro, ví dụ như HCO₃⁻, HSO₄⁻, H₂PO₄⁻, HPO₄²⁻.
2. Tính tan và độ pH
Hầu hết các muối axit đều tan tốt trong nước. Khi hòa tan, chúng phân ly ra ion H⁺ từ gốc axit, làm cho dung dịch có độ pH < 7. Bạn có thể dễ dàng kiểm tra điều này bằng giấy quỳ tím – giấy sẽ chuyển sang màu hồng hoặc đỏ nhạt.
3. Phản ứng hóa học đặc trưng
Muối axit có thể tác dụng với bazơ để tạo thành muối trung hòa và nước. Đây là phản ứng trung hòa hoàn toàn phần hydro còn lại trong gốc axit.
Ví dụ: NaHCO₃ + NaOH ⟶ Na₂CO₃ + H₂O
So Sánh Nhanh: Muối Axit và Muối Trung Hòa
Muối axit còn hydro trong gốc axit và có tính axit (pH<7), trong khi muối trung hòa không còn hydro trong gốc axit và thường có tính trung tính (pH≈7).
Để tránh nhầm lẫn, hãy xem bảng so sánh ngắn gọn dưới đây:
| Tiêu Chí | Muối Axit | Muối Trung Hòa |
|---|---|---|
| Định nghĩa | Gốc axit còn chứa hydro có khả năng phân ly H⁺. | Gốc axit không còn hydro có khả năng phân ly H⁺. |
| Công thức | Chứa H trong anion (ví dụ: NaHCO₃, KHSO₄). | Không chứa H trong anion (ví dụ: Na₂CO₃, K₂SO₄). |
| Môi trường dung dịch | Thường có pH < 7 (tính axit). | Thường có pH ≈ 7 (trung tính). |
| Phản ứng với Bazơ | Có phản ứng để tạo muối trung hòa. | Không phản ứng. |
| Ví dụ | Natri hidrocacbonat, Kali bisunfit. | Natri clorua (muối ăn), Canxi cacbonat. |
Ứng Dụng Thực Tế Của Các Muối Axit Phổ Biến
Muối axit được ứng dụng rộng rãi trong thực phẩm (bột nở NaHCO₃), nông nghiệp (phân bón supephotphat Ca(H₂PO₄)₂), y tế (thuốc kháng axit), và công nghiệp (chất làm sạch KHSO₄).
Muối axit không chỉ là lý thuyết mà còn có rất nhiều ứng dụng quan trọng trong đời sống và sản xuất.

1. Natri Hidrocacbonat (NaHCO₃) – Baking Soda
Còn được gọi là “thuốc muối”, NaHCO₃ là một trong những muối axit đa năng nhất:
- Thực phẩm: Là thành phần chính trong bột nở, giải phóng khí CO₂ khi gặp nhiệt độ cao hoặc môi trường axit, giúp bánh mì, bánh quy nở xốp. Sản phẩm Bicar Food là một ví dụ tiêu biểu.
- Y tế: Dùng làm thuốc kháng axit để trung hòa dịch vị dạ dày, giảm triệu chứng ợ nóng, khó tiêu.
- Vệ sinh: Là chất tẩy rửa nhẹ, khử mùi hiệu quả cho tủ lạnh, nhà bếp.
2. Kali Hidrosunfat (KHSO₄)
- Công nghiệp: Dùng làm chất làm sạch kim loại, chất xúc tác trong một số phản ứng hóa học.
- Nông nghiệp: Điều chỉnh độ pH của đất trồng.
- Hóa phân tích: Được sử dụng như một thuốc thử trong phòng thí nghiệm.
3. Canxi Đihidrophotphat (Ca(H₂PO₄)₂) – Monocalcium Phosphate
- Nông nghiệp: Là thành phần chính của phân bón supephotphat, cung cấp cả canxi và photpho dễ tiêu cho cây trồng, giúp rễ phát triển và tăng năng suất.
- Thức ăn chăn nuôi: Bổ sung khoáng chất thiết yếu cho gia súc, gia cầm.
Các Câu Hỏi Thường Gặp (FAQ)
1. Muối axit có phải là axit không?
Không. Về bản chất, nó là một loại muối nhưng dung dịch của nó có tính axit yếu do khả năng phân ly ra ion H⁺.
2. Làm thế nào để phân biệt muối axit và muối bazơ?
Cách đơn giản nhất là kiểm tra môi trường dung dịch bằng giấy quỳ tím. Muối axit làm quỳ tím hóa hồng (pH < 7), trong khi muối bazơ làm quỳ tím hóa xanh (pH > 7).
3. Mua các loại muối axit này ở đâu?
Các hóa chất như NaHCO₃, KHSO₄, Ca(H₂PO₄)₂ được ứng dụng rộng rãi và có thể tìm mua tại các cửa hàng hóa chất uy tín. Đoàn Tín là nhà cung cấp chuyên nghiệp các sản phẩm hóa chất công nghiệp và thực phẩm chất lượng cao.
Kết Luận
Muối axit là một nhóm hợp chất đa năng với các đặc tính hóa học độc đáo, đóng vai trò quan trọng từ gian bếp gia đình đến các ngành công nghiệp quy mô lớn. Hiểu rõ bản chất, cách nhận biết và ứng dụng của chúng không chỉ giúp bạn nắm vững kiến thức hóa học mà còn biết cách tận dụng chúng một cách an toàn và hiệu quả.
Nếu bạn có nhu cầu tìm hiểu thêm hoặc mua các sản phẩm hóa chất liên quan, hãy liên hệ ngay với Hóa Chất Doanh Tín để được tư vấn chi tiết!
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









