Kiến thức chuyên môn
Mn Hóa Trị Mấy? Hóa Trị Mangan Và Ứng Dụng
Khi tìm hiểu về các nguyên tố hóa học, một trong những câu hỏi phổ biến nhất là “Mn hóa trị mấy?”. Mangan (Mn) là một kim loại chuyển tiếp đặc biệt với nhiều số oxi hóa khác nhau, dẫn đến sự đa dạng về hóa trị. Bài viết này sẽ cung cấp một hướng dẫn chi tiết và dễ hiểu nhất về các hóa trị của Mangan, cách xác định chúng và những ứng dụng thực tiễn quan trọng.

Mangan (Mn) có nhiều hóa trị, trong đó các hóa trị phổ biến và thường gặp nhất trong chương trình học và ứng dụng công nghiệp là II (+2), IV (+4) và VII (+7).
- Hóa trị II (+2): Đây là trạng thái bền vững nhất của Mangan trong dung dịch, thường thấy trong các hợp chất muối như MnCl₂ hoặc MnSO₄.
- Hóa trị IV (+4): Đặc trưng bởi hợp chất Mangan Dioxide (MnO₂), một chất rắn màu đen quen thuộc.
- Hóa trị VII (+7): Xuất hiện trong hợp chất “thuốc tím” nổi tiếng Kali pemanganat (KMnO₄), một chất oxy hóa cực mạnh.
Để xác định hóa trị của Mn trong một hợp chất vô cơ, chúng ta thường dựa vào quy tắc hóa trị cơ bản: trong một phân tử có công thức AₓBᵧ, tổng hóa trị của các nguyên tố luôn bằng 0.
Các Hóa Trị Phổ Biến Của Mn: Từ +2 đến +7
Là một kim loại chuyển tiếp điển hình, Mangan có hóa trị rất đa dạng, từ -3 đến +7. Tuy nhiên, trong thực tế, chúng ta thường gặp các hóa trị sau:
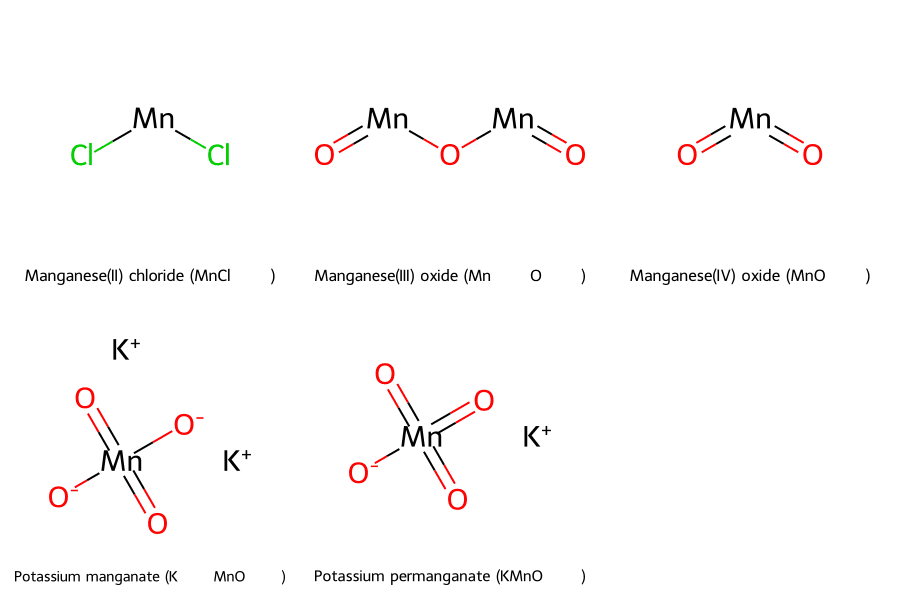
- Hóa trị +2 (Manganous): Đây là trạng thái ổn định nhất, tạo ra các muối như Manganese(II) sulfate (MnSO₄) hay Manganese(II) chloride (MnCl₂). Các dung dịch muối này thường có màu hồng nhạt đặc trưng và thể hiện tính khử.
- Hóa trị +3 (Manganic): Trạng thái này kém ổn định hơn, dễ bị oxy hóa hoặc khử. Ví dụ điển hình là Manganese(III) oxide (Mn₂O₃), một chất rắn màu nâu.
- Hóa trị +4: Rất phổ biến với hợp chất Mangan dioxide (MnO₂), một chất rắn màu đen không tan trong nước. MnO₂ là một chất xúc tác quan trọng trong nhiều phản ứng hóa học và là thành phần chính trong pin kiềm.
- Hóa trị +6: Trạng thái này tồn tại trong ion manganate (MnO₄²⁻), ví dụ như trong hợp chất Kali manganat (K₂MnO₄) có màu xanh lục.
- Hóa trị +7: Đây là trạng thái oxy hóa cao nhất của Mangan. Hợp chất tiêu biểu là Thuốc tím Kali pemanganat (KMnO₄), một chất oxy hóa rất mạnh với màu tím đặc trưng, được ứng dụng rộng rãi trong y tế để sát khuẩn và trong công nghiệp để xử lý nước.
Hướng Dẫn Cách Xác Định Hóa Trị Mn Trong Hợp Chất
Việc xác định hóa trị của Mangan trở nên đơn giản nếu bạn nắm vững các quy tắc cơ bản sau:
- Xác định hóa trị của các nguyên tố đã biết: Trong hầu hết các hợp chất, hóa trị của Oxygen (O) là II, Hydro (H) là I, Kali (K) là I, và các halogen như Clo (Cl) là I. Nhóm sulfate (SO₄) có hóa trị II.
- Áp dụng quy tắc cân bằng hóa trị: Tổng hóa trị của các nguyên tử trong một phân tử trung hòa về điện luôn bằng 0.
- Giải phương trình đơn giản: Gọi hóa trị của Mn là ‘a’ và thiết lập phương trình.
Ví dụ Minh Họa:
- Trong MnO₂:
- Hóa trị của O là II.
- Ta có phương trình: a × 1 + (-II) × 2 = 0
- Giải ra, a = IV. Vậy Mn có hóa trị IV.
- Trong KMnO₄:
- Hóa trị của K là I, O là II.
- Ta có phương trình: (+I) × 1 + a × 1 + (-II) × 4 = 0
- Giải ra: 1 + a – 8 = 0 ⟶ a = VII. Vậy Mn có hóa trị VII.
- Trong Mn₂O₇:
- Hóa trị của O là II.
- Ta có phương trình: a × 2 + (-II) × 7 = 0
- Giải ra: 2a = 14 ⟶ a = VII. Vậy Mn có hóa trị VII.
Bảng So Sánh Nhanh Các Hóa Trị Của Mangan
| Hóa Trị | Hợp Chất Ví Dụ | Tính Chất Chính | Ứng Dụng Nổi Bật |
|---|---|---|---|
| +2 | MnCl₂, MnSO₄ | Dung dịch màu hồng, tính khử | Sản xuất muối công nghiệp, phân bón vi lượng |
| +3 | Mn₂O₃ | Rắn màu đỏ nâu, không ổn định | Ít phổ biến |
| +4 | MnO₂ | Rắn màu đen, chất oxy hóa | Pin kiềm, chất xúc tác, sản xuất gốm sứ |
| +6 | K₂MnO₄ | Rắn màu xanh lục, trung gian hóa học | Phòng thí nghiệm, sản xuất KMnO₄ |
| +7 | KMnO₄, Mn₂O₇ | Tinh thể tím, oxy hóa rất mạnh | Sát khuẩn, xử lý nước, hóa phân tích |
Mẹo Ghi Nhớ Hóa Trị Mangan
Để ghi nhớ hóa trị của Mn một cách hiệu quả, bạn có thể áp dụng các mẹo sau:
- Học qua các hợp chất quen thuộc: Liên kết hóa trị với các chất bạn thường gặp: MnO₂ (hóa trị IV), “thuốc tím” KMnO₄ (hóa trị VII), và các muối phổ biến như MnCl₂ (hóa trị II).
- Sử dụng thơ ca: “Mangan hai, bốn, bảy thường dùng, ba, sáu ít dùng, nhớ không bạn hiền”.
- Liên kết với Bảng Tuần Hoàn Hóa Học: Mangan nằm ở nhóm VIIB, vì vậy hóa trị cao nhất và đặc trưng của nó là VII.
Lưu Ý Quan Trọng
- Sự đa dạng hóa trị của Mangan là do cấu hình electron đặc biệt `[Ar] 4s² 3d⁵`, cho phép nó dễ dàng mất các electron ở cả phân lớp 4s và 3d để tham gia vào các liên kết ion hoặc liên kết cộng hóa trị.
- Trong các oxit, khi số lượng nguyên tử oxy tăng, hóa trị của Mangan cũng có xu hướng tăng theo.
Câu Hỏi Thường Gặp (FAQ)
1. Mn hóa trị mấy trong MnSO₄?
Đáp: Trong MnSO₄, Mangan có hóa trị II (+2). Vì nhóm sulfate (SO₄) có hóa trị II, để phân tử trung hòa, Mn phải có hóa trị II.
2. Hóa trị cao nhất của Mn là bao nhiêu?
Đáp: Hóa trị cao nhất của Mangan là VII (+7), được tìm thấy trong các hợp chất như Kali pemanganat (KMnO₄) và Mangan(VII) oxide (Mn₂O₇).
3. Làm thế nào để học sinh dễ nhớ hóa trị của Mn?
Đáp: Cách tốt nhất là liên kết hóa trị với màu sắc và các hợp chất ví dụ quen thuộc: Mn(II) – muối hồng, MnO₂ – bột đen, KMnO₄ – thuốc tím.
Hy vọng bài viết này đã giải đáp chi tiết thắc mắc “Mn hóa trị mấy?” của bạn. Để tìm hiểu thêm về các loại hóa chất và kiến thức hóa học khác, hãy tiếp tục theo dõi các bài viết trên website của chúng tôi.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









