Góc chuyên gia:
Một sai lầm kinh điển mà nhiều kỹ thuật viên mới mắc phải là nhầm lẫn giữa V₂ (Tổng thể tích sau pha) và Vd (Thể tích dung môi cần thêm vào). Hãy nhớ kỹ: V₂ = V₁ + Vd.
2. Sự tương đồng giữa C và M (Nồng độ Mol)
Trong nhiều tài liệu chuyên ngành hoặc trên các máy tính pha loãng quốc tế, bạn sẽ thấy công thức được viết là:
M₁V₁ = M₂V₂
Đừng hoang mang. Ở đây, M đại diện cho Molarity (Nồng độ mol), được đo bằng mol/L hoặc ký hiệu là M.
- M₁: Nồng độ mol của dung dịch gốc.
- M₂: Nồng độ mol của dung dịch sau pha loãng.
Nồng độ của một dung dịch bằng nồng độ mol nhân với thể tích của dung dịch kia (M₁V₁ = M₂V₂). Điều kiện tiên quyết để phương trình này đúng là đơn vị phải không đổi ở cả hai phía của phương trình.
- Nếu C₁ là mg/mL, thì C₂ cũng phải là mg/mL.
- Nếu V₁ là mL, thì V₂ cũng phải là mL.
3. Nguyên lý hoạt động của máy tính pha loãng
Các nhà khoa học trong nhóm nghiên cứu của Synthace đã nhận ra rằng việc tính toán thủ công quá tốn thời gian, nên họ tạo ra công cụ tính toán trực tuyến này. Máy tính hoạt động bằng cách yêu cầu bạn nhập 3 trong 4 biến số đã biết, và nó sẽ giải phương trình để tìm biến số còn lại (thường là V₁ hoặc C₂).
Nó cho phép các nhà khoa học thực hiện việc pha loãng nhanh hơn bằng cách tính toán thể tích cho nhiều độ pha loãng cùng một lúc. Thậm chí, sau khi tính toán, bạn có thể xuất dữ liệu sang bảng tính dưới dạng tệp .csv chỉ bằng một cú nhấp chuột. Điều này cực kỳ hữu ích cho việc lưu trữ hồ sơ (GLP – Good Laboratory Practice) tại các phòng lab chuyên nghiệp như quy chuẩn mà Hoá Chất Doanh Tín luôn khuyến nghị khách hàng tuân thủ.
Hướng Dẫn Sử Dụng Máy Tính Pha Loãng: Quy Trình Step-by-Step
Quy trình 3 bước
1. Xác định dữ liệu (C₁, C₂, V₂).
2. Tính V₁ cần lấy: V₁ = (C₂ • V₂) / C₁.
3. Tính dung môi Vd cần thêm: Vd = V₂ – V₁.
Bây giờ, hãy xắn tay áo lên và đi vào thực hành. Sử dụng máy tính này để xác định nhiều nồng độ khác nhau của dung dịch gốc pha loãng mà bạn muốn tạo ra. Chúng ta sẽ đi qua từng bước cụ thể để đảm bảo không có sai sót nào xảy ra.
1
Bước 1: Xác định mục tiêu và thu thập dữ liệu (C₁, C₂, V₂)
Trước khi chạm vào bất kỳ dụng cụ thủy tinh nào, bạn cần xác định rõ:
- Dung dịch gốc (C₁): Bạn đang có gì? (Ví dụ: Axit HCl 3M, Glucose 50%,…).
- Nồng độ đích (C₂): Thí nghiệm cần nồng độ bao nhiêu? (Ví dụ: 1M, 10%…).
- Thể tích đích (V₂): Bạn cần bao nhiêu dung dịch để đủ làm thí nghiệm? (Ví dụ: 100mL, 60mL…).
Nếu thiếu một trong các thông số này, bạn không thể sử dụng máy tính pha loãng hiệu quả.
2
Bước 2: Thiết lập phương trình tìm thể tích dung dịch gốc (V₁)
Mặc dù máy tính sẽ làm việc này cho bạn, nhưng là một chuyên gia, bạn cần hiểu cơ chế “bên dưới nắp ca-pô”. Để tính toán cách tạo ra dung dịch này, ta sử dụng phương trình:
C₁ • V₁ = C₂ • V₂
Từ đó, suy ra công thức tính thể tích dung dịch gốc (V₁) cần hút:
V₁ = (C₂ • V₂) / C₁
Đây là con số quan trọng nhất. Nếu tính sai V₁, toàn bộ dung dịch sau pha sẽ sai nồng độ, dẫn đến kết quả thí nghiệm vô nghĩa.

3
Bước 3: Xác định thể tích chất pha loãng (Vd)
Máy tính pha loãng không chỉ cho bạn biết V₁, mà nó còn giúp bạn biết cần thêm bao nhiêu nước (hoặc dung môi). Nhưng bạn cũng cần thêm một ít chất pha loãng để tạo ra dung dịch mong muốn.
Để tính thể tích chất pha loãng V(d) cần thiết, chúng ta sử dụng phương trình:
V(d) = V₂ – V₁
- V(d): Thể tích dung môi (nước cất, buffer…) cần thêm vào.
- V₂: Tổng thể tích mong muốn.
- V₁: Thể tích dung dịch gốc đã tính ở Bước 2.
Lưu ý quan trọng:
Trong phòng thí nghiệm thực tế, đặc biệt là khi pha loãng axit đậm đặc vào nước, quy tắc an toàn là “Axit vào Nước” (Acid to Water), không bao giờ làm ngược lại. Dù máy tính cho bạn con số chính xác, kỹ thuật pha chế vẫn nằm ở tay nghề của bạn.
Case Study: Một Ví Dụ Thực Tế Áp Dụng Công Thức C₁V₁ = C₂V₂
Lý thuyết là màu xám, chỉ có cây đời mãi xanh. Để bạn hình dung rõ ràng nhất cách áp dụng công thức vào thực tế, hãy cùng tôi giải quyết một bài toán cụ thể mà chúng ta thường gặp hàng ngày tại phòng thí nghiệm.
Đề bài:
Ví dụ, giả sử bạn có dung dịch 3M trong phòng thí nghiệm – đây sẽ là dung dịch gốc ban đầu (C₁). Bạn quyết định pha loãng nó xuống còn 1M, đây sẽ là nồng độ dung dịch gốc mong muốn (C₂). Bạn muốn có 60mL dung dịch 1M này, vậy 60mL là thể tích dung dịch gốc mong muốn (V₂).
Giải quyết vấn đề từng bước:
Bước 1: Tính thể tích dung dịch gốc (V₁) cần lấy
Để tính toán cách tạo ra dung dịch 1M này, ta có thể sử dụng phương trình: C₁ • V₁ = C₂ • V₂.
Vì ta đã biết C₁, C₂ và V₂, ta có thể thay thế các giá trị này vào để tính V₁, ta được:
3 • V₁ = 1 • 60
Bằng cách đơn giản hóa phép tính này (chia cả hai vế cho 3), giờ bạn đã biết V₁ là 20 — có nghĩa là bạn cần chính xác 20mL dung dịch gốc để đạt được nồng độ mong muốn.
Bước 2: Tính lượng chất pha loãng (Vd) cần thêm vào
Nhiều người dừng lại ở bước 1 và cho rằng đã xong. Nhưng sai lầm nằm ở chỗ: Bạn lấy 20mL dung dịch gốc rồi thêm bao nhiêu nước? Nếu thêm 60mL nước, bạn sai. Nếu thêm nước “vừa đủ”, bạn thiếu chính xác.
Chúng ta sử dụng phương trình: V(d) = V₂ – V₁.
Vì ta đã biết cả V₂ (60mL) và V₁ (20mL) từ phép tính trước, ta có thể thay thế các giá trị này vào để được:
V(d) = 60 – 20
Vì V(d) là 40, điều này có nghĩa là bạn cần thêm 40mL chất pha loãng (thường là nước hoặc dung dịch đệm) vào 20mL dung dịch gốc 3M ban đầu (V₁) để tạo ra dung dịch 1M.
Kết quả pha chế cuối cùng:
Trong bình định mức hoặc ống đong, bạn sẽ có hỗn hợp gồm:
20mL dung dịch 3M + 40mL dung môi = 60mL dung dịch 1M.
Trong bình định mức hoặc ống đong, bạn sẽ có hỗn hợp gồm:
20mL dung dịch 3M + 40mL dung môi = 60mL dung dịch 1M.
So Sánh: Tính Nhẩm Thủ Công (Mental Math) vs. Công Cụ Trực Tuyến
Lời khuyên
Tính nhẩm dễ dẫn đến sai số tích lũy và stress khi xử lý nhiều mẫu. Công cụ trực tuyến đảm bảo tốc độ, độ chính xác và hỗ trợ lưu trữ dữ liệu (GLP).
Tại sao một chuyên gia 20 năm kinh nghiệm như tôi lại khuyên bạn dùng công cụ (Tools) thay vì tin vào khả năng tính nhẩm của mình?
1. Những vấn đề bạn có thể gặp phải khi tính toán độ pha loãng thủ công
Nếu bạn là một nhà sinh học làm việc trong lĩnh vực khoa học sự sống, và bạn đang cố gắng tính toán độ pha loãng từ nhiều mẫu gốc khác nhau, bạn sẽ cần phải tính toán nhẩm một chút. Điều này nghe có vẻ đơn giản với một mẫu, nhưng khi số lượng mẫu tăng lên hàng chục, hàng trăm, một “chút” tính nhẩm có thể biến thành “rất nhiều” rắc rối khi bạn tăng độ phức tạp của thí nghiệm.
Hệ quả là gì?
- Sai số tích lũy: Sai một con số thập phân ở bước đầu có thể làm hỏng toàn bộ chuỗi thí nghiệm phía sau.
- Mất thời gian: Bạn cần phải thử đi thử lại nhiều lần cho đến khi tìm ra kết quả tối ưu, lãng phí hóa chất và thời gian quý báu.
- Stress: Áp lực phải chính xác trong khi xử lý hàng loạt con số dễ dẫn đến mệt mỏi và nhầm lẫn.
2. Sức mạnh của Máy tính pha loãng trực tuyến (Như công cụ của Synthace)
Các nhà khoa học trong nhóm nghiên cứu của Synthace hiểu rõ việc tính toán độ pha loãng có thể tốn nhiều thời gian như thế nào. Đó là lý do tại sao họ đã tạo ra công cụ tính toán độ pha loãng trực tuyến này.
Lợi ích vượt trội bao gồm:
- Tốc độ xử lý: Họ muốn giúp các nhà khoa học như bạn thực hiện việc pha loãng nhanh hơn bằng cách cho phép bạn tính toán thể tích cho nhiều độ pha loãng cùng một lúc. Bạn nhập liệu một lần, máy tính trả về kết quả cho hàng loạt mẫu.
- Quản lý dữ liệu chuyên nghiệp: Sau khi tính toán độ pha loãng bằng máy tính, bạn cũng có thể xuất dữ liệu sang bảng tính bằng cách xuất kết quả tính toán dưới dạng tệp .csv — tất cả chỉ bằng một cú nhấp chuột. Tính năng này cực kỳ quan trọng để lưu trữ hồ sơ thí nghiệm, giúp bạn dễ dàng truy xuất lại quy trình pha chế khi cần báo cáo hoặc kiểm tra lại (Audit).
Góc Chuyên Gia: Các Yếu Tố “Ngầm” Ảnh Hưởng Đến Độ Chính Xác
Kỹ thuật phòng Lab
Chọn đúng dụng cụ (Pipette cho V nhỏ, Bình định mức cho pha loãng chuẩn) và hiểu rõ tính chất dung môi (pH, nhiệt phản ứng) là chìa khóa của độ chính xác.
Công thức C₁V₁ = C₂V₂ là chân lý toán học, nhưng để biến con số toán học thành dung dịch chuẩn trong bình tam giác lại là nghệ thuật của người làm hóa chất. Tại Hoá Chất Doanh Tín, chúng tôi luôn nhắc nhở khách hàng lưu ý các yếu tố sau:
1. Dụng cụ đo lường (Entities: Pipette, Bình định mức)
Máy tính bảo bạn lấy 2.54 mL. Bạn dùng dụng cụ gì?
- Ống đong (Graduated Cylinder): Sai số lớn, không dùng cho các phép pha loãng nồng độ thấp hoặc thể tích nhỏ (< 10mL).
- Pipette (Micropipette/Pipette bầu): Bắt buộc sử dụng khi V₁ nhỏ. Ví dụ trong bài toán trên, để lấy 20mL chính xác, bạn nên dùng Pipette bầu 20mL thay vì ống đong.
- Bình định mức (Volumetric Flask): Khi pha loãng, cách chuẩn nhất không phải là đong 40mL nước thêm vào. Cách chuẩn là: Cho 20mL dung dịch gốc vào bình định mức 60mL, sau đó thêm dung môi từ từ đến vạch định mức. Điều này loại trừ sai số do sự co/giãn thể tích khi trộn lẫn hai chất lỏng khác nhau.
2. Bản chất của dung môi (Solvent)
Trong công thức, Vd được gọi chung là chất pha loãng. Nhưng trong thực tế:
- Trong sinh học: Chất pha loãng thường là dung dịch đệm (Buffer) để ổn định pH, không phải nước cất thông thường.
- Trong hóa học: Phản ứng tỏa nhiệt hoặc thu nhiệt khi pha loãng (ví dụ pha loãng Axit Sulfuric H₂SO₄) có thể làm thay đổi thể tích thực. Hãy để dung dịch nguội về nhiệt độ phòng trước khi định mức thể tích cuối cùng V₂.
Câu Hỏi Thường Gặp (FAQs) – Giải Quyết Vấn Đề Của Bạn
Để nội dung này thực sự hữu ích, tôi đã tổng hợp những câu hỏi mà khách hàng thường gửi về Hotline 0965 200 571 của chúng tôi, liên quan đến vấn đề pha loãng.

Lời Kết
Việc pha loãng dung dịch tưởng chừng như một kỹ năng cơ bản của sinh viên năm nhất, nhưng để làm nó với độ chính xác cao, tốc độ nhanh và quản lý dữ liệu tốt lại là đẳng cấp của một chuyên gia. Công thức C₁V₁ = C₂V₂ chính là kim chỉ nam, và các Máy tính pha loãng (Dilution Calculator) là công cụ đắc lực giúp bạn hiện thực hóa công thức đó một cách hoàn hảo.
Đừng để những sai sót nhỏ trong tính toán phá hỏng cả công trình nghiên cứu hay lô hàng sản xuất của bạn. Hãy áp dụng công nghệ, sử dụng công thức chuẩn và luôn tuân thủ quy tắc an toàn phòng thí nghiệm.
Nếu bạn cần tư vấn thêm về các loại dung môi, hóa chất tinh khiết để pha chế dung dịch chuẩn (Standard Solutions) hoặc thực hiện chuẩn độ, hoặc cần hỗ trợ về kỹ thuật phòng lab, đừng ngần ngại liên hệ với chúng tôi.
Bài viết này được thực hiện dựa trên kinh nghiệm thực tế và các nguồn dữ liệu khoa học uy tín, nhằm mang lại giá trị thiết thực nhất cho cộng đồng nghiên cứu và sản xuất hóa chất tại Việt Nam.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →


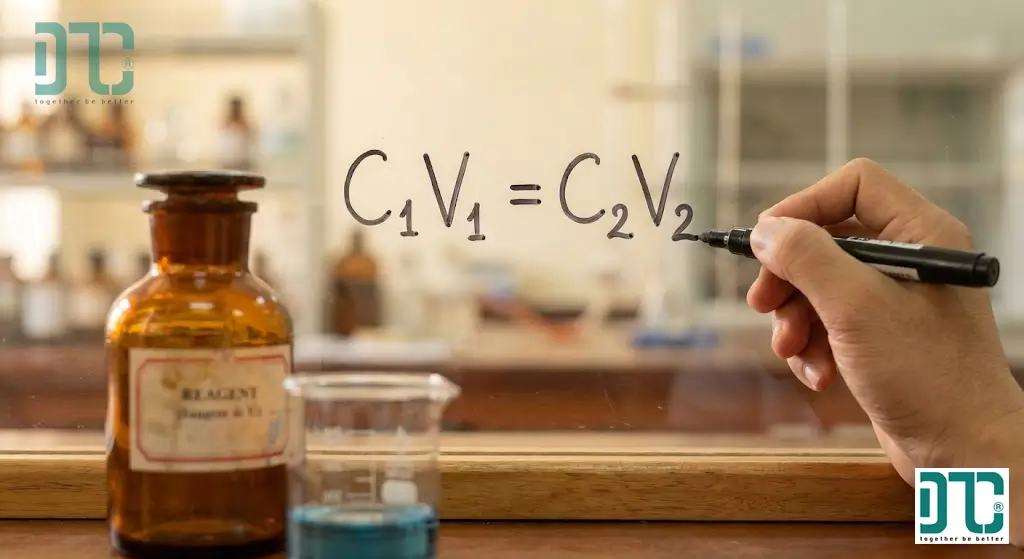
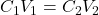 là nền tảng cho mọi phép tính pha chế từ dung dịch gốc.
là nền tảng cho mọi phép tính pha chế từ dung dịch gốc.




