Kiến thức chuyên môn
Graphite là gì? Cấu trúc, Tính chất và Ứng dụng Toàn diện
Graphite, hay còn gọi là than chì, là một dạng thù hình vô cùng đặc biệt của nguyên tố Carbon. Với cấu trúc phân lớp độc đáo, graphite sở hữu những đặc tính quý giá như khả năng dẫn điện, chịu nhiệt và độ trơn tuyệt vời. Vật liệu này không chỉ quen thuộc trong lõi bút chì mà còn là thành phần cốt lõi trong ngành công nghiệp luyện kim, pin lithium-ion và công nghệ vật liệu mới như graphene.
Hãy cùng khám phá chi tiết về vật liệu chiến lược này, từ cấu trúc phân tử đến các ứng dụng thực tiễn trong công nghiệp và đời sống.
Graphite là gì?
Graphite (than chì) là một dạng thù hình của cacbon (công thức hóa học: C), trong đó các nguyên tử được sắp xếp theo cấu trúc phân lớp. Nó nổi bật nhờ khả năng dẫn điện, mềm, trơn và chịu nhiệt độ rất cao.
- Công thức hóa học: C
- Nguồn gốc tên gọi: Xuất phát từ tiếng Hy Lạp “graphein” (có nghĩa là “viết”), vì ứng dụng phổ biến và lâu đời nhất của nó là làm lõi bút chì.
- Hiểu nhầm thường gặp: Mặc dù được dùng làm “lõi bút chì”, graphite không chứa kim loại Chì (Pb). Đây là một nhầm lẫn lịch sử phổ biến.

Các loại Graphite chính
Graphite được phân thành hai loại chính: Graphite tự nhiên (khai thác từ mỏ khoáng sản dưới các dạng vảy, khối, hoặc vô định hình) và Graphite nhân tạo (sản xuất công nghiệp bằng cách nung vật liệu cacbon ở nhiệt độ cực cao).
Graphite tự nhiên
Graphite tự nhiên là khoáng sản được khai thác trực tiếp từ vỏ Trái Đất, tồn tại dưới 3 dạng chính: graphite tinh thể vảy, graphite khối (vein) và graphite vô định hình.
Graphite tự nhiên là khoáng sản được khai thác trực tiếp từ vỏ Trái Đất. Nó thường được tìm thấy dưới dạng các vảy, khối hoặc hạt mịn và được phân loại thành:

- Graphite tinh thể vảy: Có độ tinh khiết cao, dùng trong điện cực, pin và làm chất bôi trơn cao cấp.
- Graphite khối (Vein graphite): Dạng hiếm và chất lượng cao nhất, chủ yếu dùng trong các ứng dụng điện và nhiệt.
- Graphite vô định hình: Thực chất là các tinh thể rất nhỏ, thường dùng trong công nghiệp luyện kim và sản xuất bút chì. Đây là dạng phổ biến của than hoạt tính (một dạng carbon vô định hình khác).
Graphite nhân tạo
Graphite nhân tạo (Synthetic Graphite) được sản xuất bằng cách xử lý nhiệt các vật liệu giàu cacbon (như than cốc dầu mỏ) ở nhiệt độ khoảng 3000°C. Loại này có độ tinh khiết vượt trội, lý tưởng cho các ứng dụng công nghệ cao.
Graphite nhân tạo được sản xuất bằng cách xử lý nhiệt các vật liệu giàu cacbon (như than cốc dầu mỏ) ở nhiệt độ cực cao (khoảng 3000°C) trong môi trường không có oxy.
Loại này có độ tinh khiết vượt trội so với graphite tự nhiên, cho phép kiểm soát chính xác kích thước hạt và cấu trúc, khiến nó trở nên lý tưởng cho các ứng dụng công nghệ cao như cực âm pin lithium-ion và điện cực lò hồ quang.
Cấu trúc của Graphite
Cấu trúc của graphite là cấu trúc phân lớp. Các nguyên tử cacbon liên kết sp² tạo thành các mặt phẳng lục giác. Các mặt phẳng này liên kết yếu với nhau bằng lực Van der Waals, cho phép chúng trượt lên nhau, tạo ra tính mềm, trơn và khả năng dẫn điện.
Cấu trúc phân lớp (sp²)
Sự độc đáo của graphite nằm hoàn toàn ở cấu trúc của nó. Không giống như kim cương (liên kết sp³), các nguyên tử cacbon trong graphite liên kết với nhau theo dạng lai hóa sp².
- Trong mỗi lớp: Mỗi nguyên tử cacbon tạo liên kết cộng hóa trị bền vững với 3 nguyên tử cacbon khác, hình thành một mạng lưới lục giác phẳng (tương tự cấu trúc của Graphene).
- Giữa các lớp: Các lớp phẳng này xếp chồng lên nhau và chỉ liên kết với nhau bằng lực Van der Waals yếu.
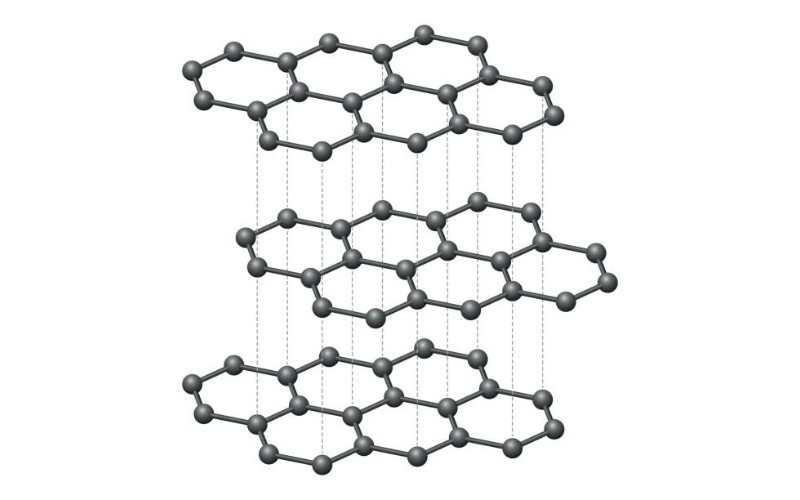
Đặc điểm nổi bật từ cấu trúc
Cấu trúc phân lớp này quyết định trực tiếp đến các tính chất vật lý đặc trưng của graphite:
- Tính mềm và trơn: Do lực liên kết giữa các lớp yếu, chúng có thể dễ dàng trượt lên nhau. Điều này khiến graphite rất mềm (chỉ 1-2 trên thang Mohs, tương tự như các kim loại mềm như Kali) và có đặc tính bôi trơn tuyệt vời.
- Tính dẫn điện: Trong mỗi nguyên tử C, chỉ có 3 electron tham gia liên kết sp². Electron thứ 4 (trong obitan p) trở thành electron tự do, có khả năng di chuyển linh hoạt trên toàn bộ lớp, tạo ra khả năng dẫn điện và ảnh hưởng đến cường độ dòng điện.
Tính chất của Graphite
Graphite có tính chất vật lý nổi bật là mềm, màu xám đen, trơn, dẫn điện và nhiệt tốt. Về mặt hóa học, nó rất bền nhiệt (nóng chảy ~3650°C), trơ với hóa chất ở nhiệt độ thường, nhưng sẽ cháy trong oxy ở nhiệt độ cao (>700°C) tạo ra CO2.
Tính chất vật lý
- Màu sắc: Xám đen đến đen, có ánh kim.
- Độ cứng: Rất mềm (1-2 Mohs), dễ dàng để lại vệt trên giấy.
- Tính trơn: Là một trong những chất bôi trơn rắn hiệu quả nhất.
- Dẫn điện và nhiệt: Dẫn điện tốt (nhưng kém hơn hầu hết kim loại) và dẫn nhiệt tốt.
- Khối lượng riêng: Khoảng 2.2 g/cm³, tương đối nhẹ.
Tính chất hóa học
- Bền nhiệt: Graphite có điểm nóng chảy cực cao (khoảng 3650°C), khiến nó trở thành vật liệu lý tưởng cho các ứng dụng cần nhiệt năng lớn và nhiệt dung riêng ổn định.
- Tính trơ hóa học: Ở nhiệt độ thường, graphite khá trơ, chống lại sự ăn mòn của hầu hết các axit và bazơ.
- Tính khử (Phản ứng oxy hóa): Mặc dù bền, graphite sẽ phản ứng với các chất oxy hóa mạnh. Khi bị nung nóng trong không khí (oxy) ở nhiệt độ cao (>700°C), nó sẽ cháy tạo ra khí CO2 (Cacbon Đioxit) hoặc CO.
Ứng dụng của Graphite
Graphite có 5 ứng dụng chính: 1. Công nghiệp luyện kim (điện cực lò hồ quang, nồi nấu kim loại). 2. Pin và năng lượng (cực âm pin Lithium-ion). 3. Chất bôi trơn (bôi trơn khô ở nhiệt độ cao). 4. Công nghệ vật liệu (sản xuất Graphene). 5. Sản xuất bút chì.

Công nghiệp luyện kim
Đây là lĩnh vực tiêu thụ graphite lớn nhất.
- Điện cực lò hồ quang điện (EAF): Dùng để nấu chảy thép phế liệu. Graphite là vật liệu duy nhất chịu được nhiệt độ cực cao của hồ quang điện và dẫn điện đủ tốt để thực hiện quy trình này.
- Nồi nấu kim loại, khuôn đúc: Dùng để chứa kim loại nóng chảy (như trong sản xuất gang hoặc nhôm) nhờ khả năng chịu nhiệt và không phản ứng với kim loại lỏng.
Công nghiệp pin và năng lượng
Graphite là vật liệu then chốt cho ngành công nghiệp lưu trữ năng lượng.
- Cực âm (Anode) pin Lithium-ion: Hầu hết mọi pin Li-ion (trong điện thoại, laptop, xe điện) đều sử dụng graphite (chủ yếu là graphite nhân tạo) làm vật liệu cho cực âm. Cấu trúc lớp của nó cho phép các ion Liti (Lithium) xen kẽ vào và đi ra trong quá trình sạc và xả, lưu trữ hóa năng hiệu quả.
- Pin nhiên liệu: Graphite được dùng làm tấm lưỡng cực (bipolar plates) do khả năng dẫn điện và chống ăn mòn.
Chất bôi trơn
Do đặc tính trơn trượt giữa các lớp, graphite là một chất bôi trơn khô hiệu quả, đặc biệt trong các môi trường có nhiệt độ quá cao hoặc quá thấp mà dầu mỡ lỏng không thể hoạt động. Nó giúp giảm lực ma sát trong các ổ trục, bánh răng và các cơ cấu cơ khí. Đôi khi, nó được phân tán trong dung môi để tạo thành chất bôi trơn dạng lỏng.
Công nghệ vật liệu mới
- Graphene: Về cơ bản, Graphene là một lớp graphite duy nhất. Việc tách thành công graphene đã mở ra một kỷ nguyên mới cho công nghệ nano, điện tử dẻo và vật liệu siêu bền.
- Vật liệu chịu lửa và cách nhiệt: Graphite được thêm vào gạch chịu lửa, vật liệu cách nhiệt để tăng khả năng chống sốc nhiệt.
Sản xuất bút chì
Ứng dụng truyền thống nhất là trộn bột graphite với đất sét và nước, sau đó ép và nung để tạo ra lõi bút chì. Tỷ lệ đất sét/graphite sẽ quyết định độ cứng của bút (HB, 2B, 6B…).
Ứng dụng trong y học
Nhờ tính trơ sinh học và tương thích cơ thể, các dạng carbon (bao gồm cả graphite) đang được nghiên cứu và sử dụng trong một số thiết bị y tế như van tim nhân tạo hoặc trong các hệ thống dẫn truyền thuốc.
So sánh Graphite và Kim Cương
Graphite và Kim cương đều là thù hình của Cacbon nhưng trái ngược nhau: Graphite (liên kết sp²) thì mềm, dẫn điện, màu đen; trong khi Kim cương (liên kết sp³) thì siêu cứng, cách điện và thường trong suốt.
Graphite và Kim Cương đều là các dạng thù hình của Cacbon, nhưng lại có tính chất trái ngược nhau một trời một vực, tất cả là do sự khác biệt trong cấu trúc liên kết.
| Tiêu chí | Graphite | Kim cương |
|---|---|---|
| Cấu trúc liên kết | Phân lớp (Lai hóa sp²) | Tứ diện (Lai hóa sp³) |
| Độ cứng | Rất mềm (1-2 Mohs) | Cứng nhất (10 Mohs) |
| Dẫn điện | Dẫn điện tốt | Không dẫn điện (Cách điện) |
| Màu sắc | Xám đen, mờ đục | Thường trong suốt, lấp lánh |
| Ứng dụng chính | Bôi trơn, điện cực, pin, bút chì | Trang sức, công cụ cắt, mài |
Kết luận
Graphite là một vật liệu đa năng với cấu trúc phân lớp độc đáo, mang lại sự kết hợp hiếm có giữa khả năng dẫn điện, độ trơn và khả năng chịu nhiệt vượt trội. Từ những ứng dụng hàng ngày như lõi bút chì đến việc cung cấp năng lượng cho xe điện qua pin lithium-ion, graphite đóng vai trò cốt lõi trong nhiều ngành công nghiệp và công nghệ hiện đại.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









