Kiến thức chuyên môn
Gốc Axit Mạnh: Phân Loại, Ứng Dụng & An Toàn | Hóa Chất Doanh Tín
Bài viết được thẩm định chuyên môn bởi Ông Nguyễn Văn An, Kỹ sư Hóa với 15 năm kinh nghiệm trong ngành hóa chất công nghiệp.
Trong bối cảnh công nghiệp hóa, việc hiểu rõ và sử dụng an toàn các loại hóa chất nền tảng là yếu tố sống còn. Theo thống kê, các axit mạnh như Axit Sunfuric (H₂SO₄) và Axit Clohidric (HCl) chiếm hơn 60% tổng sản lượng axit vô cơ được sử dụng toàn cầu. Nhưng điều gì thực sự định nghĩa một “gốc axit mạnh”? Và làm thế nào để khai thác sức mạnh của chúng một cách hiệu quả và an toàn tuyệt đối?
Bài viết này từ các chuyên gia của Hóa Chất Doanh Tín sẽ không chỉ dừng lại ở định nghĩa. Chúng tôi sẽ đi sâu vào bản chất hóa học, phân tích ứng dụng thực tiễn và cung cấp những hướng dẫn an toàn bắt buộc, giúp doanh nghiệp của bạn làm chủ hoàn toàn nhóm hóa chất quan trọng này.
Góc nhìn chuyên gia – Nguyễn Thị Mỹ Linh, Trưởng phòng Kỹ thuật Hóa Chất Doanh Tín:
“Nhiều khách hàng tìm đến chúng tôi chỉ với yêu cầu ‘cung cấp axit’. Nhưng nhiệm vụ của Doanh Tín là hỏi ‘để làm gì?’. Việc hiểu rõ ứng dụng cuối cùng cho phép chúng tôi tư vấn đúng nồng độ, cấp độ tinh khiết và quan trọng nhất là các biện pháp an toàn đi kèm. Một sai sót nhỏ trong việc lựa chọn hay sử dụng axit mạnh có thể dẫn đến tác hại của hóa chất và gây thiệt hại lớn về thiết bị và con người. Đó là lý do chúng tôi xây dựng cẩm nang này.”
1. Gốc Axit Mạnh là gì và được hình thành như thế nào?
Gốc axit mạnh là anion (ion âm) có nguồn gốc từ một axit mạnh, được hình thành khi axit đó phân ly hoàn toàn trong dung môi (như nước) để giải phóng toàn bộ ion H⁺.
Để vận hành an toàn, chúng ta cần bắt đầu từ những khái niệm cốt lõi. Một **gốc axit** là phần còn lại của phân tử axit sau khi đã nhường đi một hay nhiều proton (H⁺). Độ mạnh của gốc axit này được quyết định bởi chính axit tạo ra nó.
Đặc điểm then chốt của axit mạnh là khả năng phân ly hoàn toàn trong một dung môi (thường là nước), giải phóng toàn bộ ion H⁺ mà nó có.
Phương trình tổng quát: HA (axit mạnh) → H⁺ + A⁻ (gốc axit mạnh)
Ví dụ điển hình:
Điều này tạo ra một hệ quả quan trọng: Gốc axit mạnh chính là một bazơ liên hợp cực kỳ yếu. Nó gần như không có khả năng nhận lại proton H⁺ trong dung dịch.
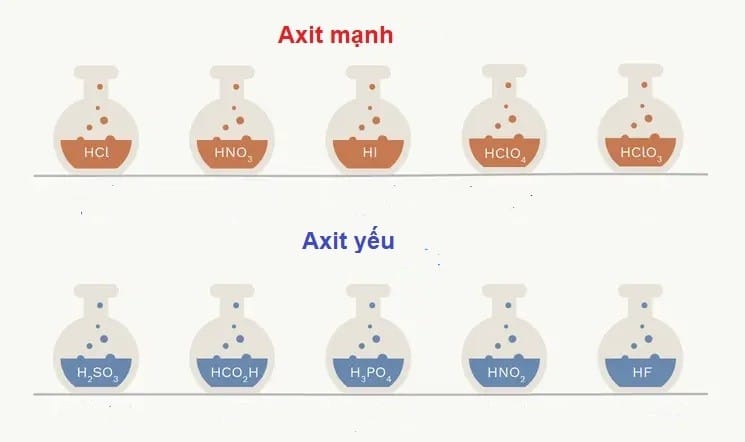
2. Có những phương pháp nào để xác định độ mạnh của axit?
Có hai phương pháp chính để xác định độ mạnh của axit: Phân tích định tính (dựa vào cấu trúc phân tử, số nguyên tử Oxy, độ âm điện) và Phân tích định lượng (dựa vào hằng số phân ly axit Ka).
Việc xác định một axit là mạnh hay yếu không chỉ là kiến thức học thuật mà còn mang ý nghĩa sống còn trong ứng dụng công nghiệp, giúp lựa chọn hóa chất phù hợp và đảm bảo an toàn.
Làm thế nào để phân tích định tính độ mạnh của axit dựa trên cấu trúc phân tử?
Phân tích định tính dự đoán độ mạnh của axit dựa trên các quy luật về cấu trúc hóa học, bao gồm việc xem xét số lượng nguyên tử Oxy, độ âm điện của nguyên tố trung tâm và bán kính nguyên tử.
Đối Với Axit Có Oxi (Oxyacid):
- Số lượng nguyên tử Oxi: Cùng một nguyên tố trung tâm, axit có càng nhiều nguyên tử Oxygen thì tính axit càng mạnh. Ví dụ: Độ mạnh tăng dần: HClO < HClO₂ < HClO₃ < HClO₄
- Độ âm điện của nguyên tố trung tâm: Trong cùng một chu kỳ của bảng tuần hoàn hóa học, nguyên tố trung tâm có độ âm điện càng lớn, tính axit càng mạnh. Ví dụ: H₃PO₄ < H₂SO₄ < HClO₄
Đối Với Axit Không Có Oxi (Hydracid):
Trong cùng một nhóm Halogen, tính axit tăng từ trên xuống dưới do bán kính nguyên tử tăng làm liên kết H-X yếu đi. Ví dụ: Độ mạnh tăng dần: HF (yếu) < HCl < HBr < **HI**.
Làm thế nào để phân tích định lượng độ mạnh của axit một cách chính xác?
Phân tích định lượng là phương pháp chính xác nhất, sử dụng hằng số phân ly axit (Ka). Giá trị Ka càng lớn thì tính axit của axit đó càng mạnh.
Trong dung dịch, mỗi axit có một hằng số cân bằng cho phản ứng phân ly của nó, gọi là hằng số phân ly axit (Ka). Đối với các axit mạnh, giá trị Ka là rất lớn (thường > 1), cho thấy sự phân ly gần như 100%.
3. Đâu là 5 gốc axit mạnh và ứng dụng then chốt trong công nghiệp?
5 gốc axit mạnh phổ biến nhất là Sunfat (SO₄²⁻), Clorua (Cl⁻), Nitrat (NO₃⁻), Bromua (Br⁻), và Perclorat (ClO₄⁻). Chúng là nền tảng cho nhiều ngành công nghiệp như sản xuất phân bón, luyện kim, hóa dược, và xử lý nước.
Thị trường hóa chất công nghiệp toàn cầu, đặc biệt là các axit vô cơ, dự kiến sẽ tiếp tục tăng trưởng ổn định ở mức 4-5% hàng năm trong giai đoạn 2025-2027, cho thấy vai trò không thể thiếu của các hóa chất nền tảng này trong nền kinh tế hiện đại.
| Đặc Điểm | Axit Sunfuric (H₂SO₄) | Axit Clohidric (HCl) | Axit Nitric (HNO₃) | Axit Bromhidric (HBr) | Axit Percloric (HClO₄) |
|---|---|---|---|---|---|
| Tính Chất Nổi Bật | Háo nước, oxy hóa mạnh | Ăn mòn kim loại, bay hơi | Oxy hóa rất mạnh | Axit mạnh, khử | Siêu axit, oxy hóa |
| Nồng Độ Phổ Biến | 98%, 70%, 50% | 32%, 35% | 68%, 55% | 48% | 70% |
| Ứng Dụng Chính | Phân bón, ắc quy, tẩy gỉ | Tẩy gỉ, xử lý nước, thực phẩm | Phân bón, thuốc nổ, xi mạ | Hóa dược, tổng hợp hữu cơ | Nhiên liệu tên lửa, xúc tác |
| Lưu Ý An Toàn | Cực kỳ nguy hiểm khi pha loãng | Bay hơi gây độc hô hấp | Ăn mòn da, dễ cháy | Ăn mòn mạnh | Nguy cơ nổ khi khan nước |
Gốc Sunfat (SO₄²⁻) từ Axit Sunfuric (H₂SO₄) có ứng dụng gì?
Gốc Sunfat từ Axit Sunfuric là hóa chất công nghiệp hàng đầu, ứng dụng trong sản xuất phân bón, luyện kim, ắc quy và xử lý nước thải.
Được mệnh danh là “vua của các loại hóa chất”, H₂SO₄ 98% là axit được tiêu thụ nhiều nhất thế giới. Các ứng dụng chính bao gồm sản xuất phân bón supephotphat, tẩy gỉ thép trong ngành luyện kim, làm dung dịch điện ly trong ắc quy axit-chì, và điều chỉnh độ pH trong xử lý nước thải.
Gốc Clorua (Cl⁻) từ Axit Clohidric (HCl) có ứng dụng gì?
Gốc Clorua từ Axit Clohidric là một hóa chất đa năng, được dùng để tẩy gỉ kim loại, xử lý nước, sản xuất thực phẩm và khai thác dầu khí.
Đây là một trong những hóa chất cơ bản và linh hoạt nhất. Các ứng dụng chính bao gồm tẩy gỉ kim loại, xử lý nước hồ bơi, sản xuất gelatin trong công nghiệp thực phẩm, và hòa tan đá vôi trong khai thác dầu khí.
Case Study Thực Tế từ Doanh Tín:
Thách thức: Một nhà máy kết cấu thép tại Bình Dương đối mặt với hiệu suất tẩy gỉ thấp và chi phí hóa chất cao.
Giải pháp: Đội ngũ kỹ thuật của Doanh Tín đã tư vấn sử dụng dung dịch HCl 32% có pha sẵn chất ức chế ăn mòn chuyên dụng.
Kết quả: Thời gian tẩy gỉ giảm 30%, lượng axit tiêu thụ giảm 15%, bề mặt thép sau xử lý sáng bóng.
Gốc Nitrat (NO₃⁻) từ Axit Nitric (HNO₃) có ứng dụng gì?
Gốc Nitrat từ Axit Nitric là một chất oxy hóa mạnh, chủ yếu được dùng để sản xuất phân đạm, thuốc nổ và trong ngành xi mạ kim loại.
Là một chất oxy hóa mạnh, HNO₃ đóng vai trò quan trọng trong việc sản xuất phân đạm amoni nitrat (NH₄NO₃), sản xuất thuốc nổ (TNT), xi mạ và khắc kim loại.
Gốc Bromua (Br⁻) từ Axit Bromhidric (HBr) có ứng dụng gì?
Gốc Bromua từ Axit Bromhidric là hóa chất quan trọng trong tổng hợp hữu cơ, đặc biệt là sản xuất dược phẩm và chất chống cháy.
Axit này giữ vai trò quan trọng trong các phản ứng tổng hợp hữu cơ chuyên sâu, đặc biệt là sản xuất các hợp chất chứa Brom. Ứng dụng chính của nó là làm xúc tác trong hóa dược và tổng hợp các hợp chất cơ-brôm, chất chống cháy.
Gốc Perclorat (ClO₄⁻) từ Axit Percloric (HClO₄) có ứng dụng gì?
Gốc Perclorat từ Axit Percloric là một siêu axit, được ứng dụng trong các lĩnh vực đặc thù như làm nhiên liệu tên lửa và chất xúc tác trong phòng thí nghiệm.
Là một trong những axit mạnh nhất được biết đến, HClO₄ có tính oxy hóa mãnh liệt. Ứng dụng của nó rất đặc thù, bao gồm làm thành phần nhiên liệu tên lửa, chất xúc tác trong phòng thí nghiệm và dùng để phá mẫu quặng phức tạp để phân tích.
4. Các nguyên tắc an toàn và tuân thủ khi làm việc với axit mạnh là gì?
Các nguyên tắc vàng bao gồm: trang bị đầy đủ đồ bảo hộ cá nhân (PPE) theo tiêu chuẩn, tuân thủ nghiêm ngặt quy tắc pha loãng “Axit vào Nước”, và bảo quản hóa chất đúng cách.
Sức mạnh luôn đi kèm trách nhiệm. Việc tuân thủ quy trình nghiêm ngặt là yêu cầu bắt buộc để đảm bảo an toàn.
Trang Bị Bảo Hộ Cá Nhân (PPE) Bắt Buộc:
Theo quy định tại TCVN và Nghị định 113/2017/NĐ-CP, khi tiếp xúc với axit mạnh, nhân viên bắt buộc phải trang bị đầy đủ PPE và hiểu rõ các quy tắc ghi nhãn hóa chất theo GHS.
Quy Tắc Pha Loãng Axit: “A-vào-N”:
Đây là quy tắc an toàn cơ bản nhất: **Luôn luôn cho từ từ AXIT vào NƯỚC, không bao giờ làm ngược lại.** Hành động cho nước vào axit đặc sẽ gây ra một phản ứng tỏa nhiệt cực mạnh, làm nước sôi và bắn dung dịch axit nóng ra ngoài, gây bỏng nặng.
[Video Nhúng: Minh họa quy tắc pha loãng axit sunfuric an toàn, so sánh hai kịch bản sai (nước vào axit gây sôi bùng) và đúng (axit vào nước tỏa nhiệt có kiểm soát).]
[TẢI NGAY] Checklist An Toàn Khi Làm Việc Với Axit Mạnh (PDF)
Để hỗ trợ khách hàng, chúng tôi đã biên soạn một checklist chi tiết về quy trình làm việc và sơ cứu khẩn cấp.
5. Giải đáp các thắc mắc chuyên môn thường gặp (FAQ)
Phần này sẽ giải đáp các câu hỏi phổ biến về việc phân biệt gốc axit mạnh/yếu, lý do đặc biệt của một số axit, cách xử lý sự cố và thời hạn sử dụng của chúng.
Gốc Carbonat (CO₃²⁻) là mạnh hay yếu?
CO₃²⁻ là gốc của axit cacbonic (H₂CO₃), một axit rất yếu. Do đó, CO₃²⁻ là một bazơ liên hợp tương đối mạnh.
Tại sao Axit Flohidric (HF) được coi là axit yếu?
Mặc dù Flo (F) có độ âm điện cao nhất, nhưng liên kết H-F rất bền vững do độ dài liên kết ngắn, làm cho HF khó phân ly. Dù là axit yếu, HF cực kỳ nguy hiểm và ăn mòn thủy tinh.
Làm thế nào để xử lý sự cố tràn đổ axit mạnh quy mô nhỏ?
- Cách ly: Phong tỏa khu vực.
- Trung hòa: Sử dụng các chất kiềm yếu như Natri Bicarbonat (NaHCO₃) hoặc vôi bột (Ca(OH)₂) rắc từ từ vào vết tràn.
- Thu gom: Dùng vật liệu thấm hút trơ (cát) để thu gom.
- Xử lý: Xử lý theo quy định về chất thải nguy hại.
Axit mạnh có hạn sử dụng không?
Các axit vô cơ mạnh như H₂SO₄, HCl rất bền và gần như không có hạn sử dụng. Tuy nhiên, axit nitric (HNO₃) có thể bị phân hủy dần dưới tác động của ánh sáng.
Kết Luận: Từ Kiến Thức Nền Tảng Đến Đối Tác Tin Cậy
Hiểu rõ về **gốc axit mạnh** là chìa khóa để tối ưu hóa sản xuất và đảm bảo an toàn lao động. Hợp tác với một nhà cung cấp uy tín là quyết định mang tính chiến lược.
**Hóa Chất Doanh Tín** không chỉ cung cấp các sản phẩm trong cửa hàng với chất lượng cao mà còn cam kết đồng hành cùng khách hàng với vai trò là một nhà tư vấn kỹ thuật chuyên sâu.
Hãy liên hệ với chúng tôi ngay hôm nay để nhận báo giá và sự tư vấn từ các chuyên gia hàng đầu.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









