Kiến thức chuyên môn
Fluor (F) là gì? Từ A-Z về Tính chất, Ứng dụng & Tác hại
Fluor, hay Flo, là một nguyên tố không còn xa lạ trong cuộc sống, đặc biệt là trong các sản phẩm chăm sóc răng miệng. Tuy nhiên, không phải ai cũng hiểu rõ Fluor là gì, bản chất hóa học, những ứng dụng quan trọng trong công nghiệp và cả những nguy cơ tiềm ẩn nếu sử dụng sai cách.
Bài viết này, được biên soạn bởi các chuyên gia hóa học tại Hóa chất Doanh Tín, sẽ cung cấp cho bạn cái nhìn toàn diện từ A-Z về nguyên tố hóa học đặc biệt này.
Fluor là gì?
Fluor (ký hiệu F) là nguyên tố hóa học phi kim thuộc nhóm Halogen, có độ âm điện cao nhất và hoạt động hóa học mạnh nhất. Nó tồn tại trong tự nhiên dưới dạng hợp chất và có vai trò quan trọng trong nha khoa và công nghiệp.
Fluor là một nguyên tố hóa học có ký hiệu F, số nguyên tử 9. Trong bảng tuần hoàn hóa học, Fluor thuộc nhóm VIIA, chu kỳ 2, và là nguyên tố đứng đầu trong nhóm Halogen. Ở dạng đơn chất, phân tử của nó là F₂, một chất khí màu vàng lục nhạt, có mùi hắc và cực kỳ độc.
Với độ âm điện cao nhất trong tất cả các nguyên tố (3.98), Fluor là phi kim hoạt động mạnh nhất, có khả năng phản ứng với hầu hết các nguyên tố khác, kể cả các khí trơ như xenon và radon. Do tính phản ứng cao, Fluor không tồn tại ở dạng tự do trong tự nhiên mà thường được tìm thấy trong các hợp chất vô cơ như fluorit (CaF₂) và cryolite (Na₃AlF₆).
Dưới đây là cấu trúc của một số hợp chất chứa Fluor phổ biến:
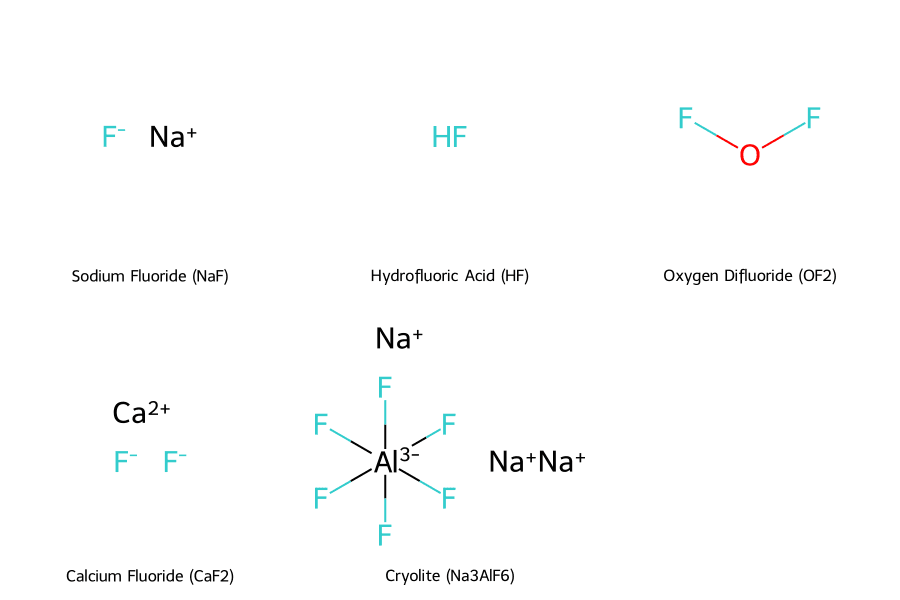
Lịch sử phát hiện nguyên tố Fluor
Nguyên tố Fluor được nhà hóa học người Pháp Henri Moissan chính thức phân lập thành công vào năm 1886 thông qua phương pháp điện phân, một thành tựu đã mang lại cho ông giải Nobel Hóa học vào năm 1906.
Thế kỷ 16: Khoáng chất fluorit (lúc đó gọi là “fluorspar”) được mô tả lần đầu tiên, sử dụng làm chất trợ chảy để giúp kim loại nóng chảy dễ dàng hơn.
Năm 1670: Schwanhard, một thợ cắt kính người Đức, phát hiện ra rằng khi fluorit tiếp xúc với axit sunfuric (H₂SO₄), nó tạo ra một loại khí có khả năng ăn mòn kính.
Năm 1886: Sau nhiều nỗ lực thất bại của các nhà hóa học khác (một số đã tử vong hoặc bị mù do tai nạn), nhà hóa học người Pháp Henri Moissan đã thành công trong việc phân lập Fluor nguyên chất bằng phương pháp điện phân dung dịch kali florua (KF) trong hydro florua (HF) lỏng. Thành tựu này đã mang về cho ông giải Nobel Hóa học năm 1906.
Tính chất vật lý của Fluor (F)
Ở điều kiện thường, Fluor là một chất khí độc, màu vàng lục nhạt, có nhiệt độ nóng chảy -219.6°C và nhiệt độ sôi -188.1°C, nặng hơn không khí và có tính ăn mòn cao.
- Trạng thái: Ở điều kiện thường, Fluor là một chất khí có màu vàng lục nhạt.
- Nhiệt độ nóng chảy: -219.6°C (53.5 K).
- Nhiệt độ sôi: -188.1°C (85.0 K).
- Mật độ: 1.696 g/L (hơi nặng hơn không khí một chút).
- Độc tính: Fluor cực kỳ độc và có tính ăn mòn cao. Tiếp xúc trực tiếp có thể gây bỏng da nghiêm trọng và tổn thương hệ hô hấp. Việc xử lý và bảo quản hóa chất này đòi hỏi các biện pháp an toàn nghiêm ngặt.
Tính chất hóa học của Fluor
Fluor là phi kim hoạt động mạnh nhất với tính oxy hóa cực mạnh, chỉ có số oxy hóa duy nhất là -1. Nó có thể phản ứng mãnh liệt với hầu hết các nguyên tố kim loại, phi kim và nhiều hợp chất khác.
Fluor được mệnh danh là “con hổ” của bảng tuần hoàn vì tính oxy hóa cực mạnh, chỉ đứng sau một số hợp chất không bền. Nó chỉ có một số oxy hóa duy nhất là -1.
Tác dụng với kim loại
Fluor phản ứng dữ dội, thường kèm theo nổ và tỏa nhiệt mạnh, với hầu hết các kim loại (kể cả kim loại quý) để tạo ra các muối florua.
Fluor phản ứng mãnh liệt, thường gây nổ, với hầu hết các kim loại, kể cả vàng và bạch kim ở nhiệt độ cao. Phản ứng với kim loại kiềm như Natri (Na) xảy ra ngay lập tức.
2Na + F₂ ⟶ 2NaF (Natri florua)
Tác dụng với phi kim
Fluor phản ứng trực tiếp với hầu hết các phi kim như lưu huỳnh, photpho, hydro, silic… (trừ Oxygen, Nitơ và các khí trơ nhẹ) để tạo ra các hợp chất florua cộng hóa trị.
Fluor phản ứng trực tiếp với hầu hết các phi kim (trừ Oxygen, Nitơ và các khí trơ nhẹ) để tạo ra florua.
S + 3F₂ ⟶ SF₆ (Lưu huỳnh hexaflorua)
2P + 5F₂ ⟶ 2PF₅ (Photpho pentaflorua)
Tác dụng với Hydro
Phản ứng giữa hydro và fluor tạo ra hydro florua (HF) là một phản ứng nổ, xảy ra tức thì ngay cả trong điều kiện nhiệt độ rất thấp và không cần ánh sáng.
Phản ứng giữa hydro và fluor gây nổ ngay cả trong bóng tối và ở nhiệt độ rất thấp, tạo ra hydro florua (HF).
H₂ + F₂ ⟶ 2HF
Dung dịch HF trong nước được gọi là axit flohidric, một axit có khả năng ăn mòn thủy tinh độc đáo, được ứng dụng trong khắc và làm mờ kính.
Tác dụng với nước
Fluor có khả năng oxy hóa nước một cách mạnh mẽ, phân hủy nước và giải phóng khí oxy, đây là một phản ứng độc nhất trong nhóm Halogen.
Fluor oxy hóa nước một cách mạnh mẽ khi sục qua, tạo ra oxy và axit flohidric.
2F₂ + 2H₂O ⟶ 4HF + O₂
Ứng dụng quan trọng của Fluor và hợp chất
Các hợp chất của Fluor có ứng dụng đa dạng và quan trọng trong nhiều lĩnh vực như chăm sóc nha khoa, sản xuất polymer hiệu suất cao (Teflon), công nghiệp hạt nhân, và tổng hợp hóa chất dược phẩm.
Mặc dù nguy hiểm ở dạng nguyên chất, Fluor và các hợp chất của nó lại có vô số ứng dụng thiết thực.
- Chăm sóc nha khoa: Ion F⁻ có khả năng củng cố men răng và ngăn ngừa sâu răng. Nó là thành phần chính trong kem đánh răng, nước súc miệng và các sản phẩm nha khoa chuyên nghiệp.
- Công nghiệp Polymer: Hợp chất polytetrafluoroethylene (PTFE), hay còn gọi là Teflon, được tạo ra từ Fluor. Đây là một loại polymer siêu bền, chống dính và chịu nhiệt, dùng trong sản xuất chảo chống dính, vật liệu cách điện.
- Sản xuất Freon và chất làm lạnh: Các hợp chất CFC (chlorofluorocarbon) trước đây được dùng rộng rãi làm chất làm lạnh, nhưng hiện đang được thay thế do tác động tiêu cực đến tầng ozon.
- Công nghiệp hạt nhân: Hợp chất Uranium hexafluoride (UF₆) được dùng trong quá trình làm giàu uranium để sản xuất nhiên liệu cho các nhà máy điện hạt nhân.
- Tổng hợp hóa chất: Fluor được dùng để sản xuất các dung môi và các hợp chất hữu cơ chứa flo có ứng dụng trong dược phẩm và nông nghiệp.
Nguy hiểm và tác hại của Fluor cần lưu ý
Việc tiếp xúc với Fluor cần được kiểm soát chặt chẽ. Thiếu Fluor gây sâu răng, nhưng thừa Fluor (nhiễm độc Fluor) lại gây hại cho men răng, xương, và các cơ quan nội tạng khác.
Việc cân bằng liều lượng Fluor là cực kỳ quan trọng. Cả thiếu và thừa Fluor đều gây ra những vấn đề sức khỏe.
- Thiếu Fluor: Làm tăng nguy cơ sâu răng, đặc biệt ở trẻ em, và có thể ảnh hưởng đến độ chắc khỏe của xương.
- Thừa Fluor (Nhiễm độc Fluor):
- Ảnh hưởng đến răng: Gây ra tình trạng “răng nhiễm fluor”, biểu hiện bằng các đốm trắng đục hoặc nâu trên men răng, làm men răng giòn, dễ vỡ.
- Ảnh hưởng đến xương: Nhiễm độc fluor mãn tính có thể dẫn đến bệnh giòn xương, làm xương dễ gãy và biến dạng.
- Ảnh hưởng khác: Liều lượng rất cao có thể gây tổn thương thận, gan và hệ thần kinh.
So sánh Fluor với các Halogen khác
So với các Halogen khác, Fluor là nguyên tố có độ âm điện và tính oxy hóa mạnh nhất. Tính chất hóa học của nó có nhiều điểm khác biệt rõ rệt, đặc biệt là khả năng phản ứng với nước và việc chỉ có một số oxy hóa duy nhất.
| Đặc điểm | Fluor (F) | Clo (Cl) | Brom (Br) | Iot (I) |
|---|---|---|---|---|
| Trạng thái (đk thường) | Khí vàng nhạt | Khí xanh vàng | Lỏng đỏ nâu | Rắn tím đen |
| Độ âm điện | 3.98 (Cao nhất) | 3.16 | 2.96 | 2.66 |
| Tính oxy hóa | Mạnh nhất | Mạnh | Trung bình | Yếu |
| Phản ứng với nước | Oxi hóa H₂O | Phản ứng thuận nghịch | Chậm | Hầu như không |
| Axit tương ứng | HF (Axit yếu) | HCl (Axit mạnh) | HBr (Axit rất mạnh) | HI (Axit cực mạnh) |
| Ứng dụng chính | Nha khoa, Teflon | Khử trùng nước (Cloramin B), PVC | Thuốc trừ sâu, chống cháy | Sát khuẩn (Iodine) |
Xem thêm: Brom là chất gì? và Hóa trị của Clo là bao nhiêu?
Câu hỏi thường gặp (FAQ)
1. Fluor có gây ung thư không?
Không. Các tổ chức y tế uy tín thế giới như WHO và CDC, dựa trên nhiều nghiên cứu khoa học lớn, đã kết luận rằng không có bằng chứng thuyết phục nào cho thấy Fluor ở liều lượng khuyến cáo gây ung thư.
2. Làm thế nào để bổ sung Fluor an toàn?
Cách an toàn và hiệu quả nhất là sử dụng kem đánh răng chứa Fluor (nồng độ tiêu chuẩn 1000-1500 ppm) hai lần mỗi ngày và sử dụng nước uống được fluor hóa theo tiêu chuẩn (khoảng 0.7 mg/L).
3. Răng bị nhiễm fluor có thể khắc phục được không?
Có, tùy thuộc vào mức độ nghiêm trọng. Các trường hợp nhẹ có thể được cải thiện bằng phương pháp tẩy trắng hoặc vi mài mòn men răng. Các trường hợp nặng hơn có thể cần đến các giải pháp thẩm mỹ như dán sứ veneer.
Kết luận
Fluor là một nguyên tố hóa học đầy mâu thuẫn: cực kỳ nguy hiểm ở dạng tinh khiết nhưng lại vô cùng có lợi ở dạng hợp chất với liều lượng phù hợp. Hiểu rõ “Fluor là gì”, tính chất và cách sử dụng an toàn là chìa khóa để tận dụng lợi ích của nó trong việc bảo vệ sức khỏe và phát triển công nghiệp.
Nếu bạn có nhu cầu tìm hiểu thêm hoặc cần tư vấn về các loại hóa chất công nghiệp và dung môi an toàn, đừng ngần ngại liên hệ với Hóa chất Đoàn Tin. Với đội ngũ chuyên gia giàu kinh nghiệm, chúng tôi luôn sẵn sàng cung cấp những giải pháp và sản phẩm chất lượng nhất.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









