Kiến thức chuyên môn
Đơn Vị Điện Tích Hạt Nhân Là Gì? Công Thức & Cách Tính Chi Tiết
Trong thế giới hóa học, mọi thứ bắt đầu từ nguyên tử. Và trái tim của mỗi nguyên tử chính là hạt nhân, nơi chứa đựng một trong những khái niệm nền tảng nhất: đơn vị điện tích hạt nhân.
Hiểu rõ về điện tích hạt nhân không chỉ giúp bạn giải quyết các bài tập hóa học mà còn là chìa khóa để khám phá bản chất của các nguyên tố và phản ứng hóa học.
Vậy đơn vị điện tích hạt nhân là gì và làm thế nào để xác định nó một cách chính xác? Hãy cùng Hóa Chất Doanh Tín tìm hiểu chi tiết trong bài viết này.
Định Nghĩa Đơn Vị Điện Tích Hạt Nhân
Đơn vị điện tích hạt nhân (ký hiệu Z) là tổng số proton trong hạt nhân nguyên tử, quyết định điện tích dương và là đặc trưng cơ bản của một nguyên tố hóa học.
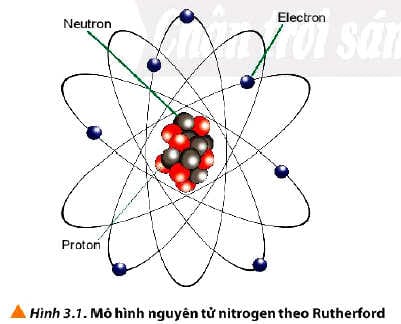
Đơn vị điện tích hạt nhân, ký hiệu là Z, chính là tổng số proton có trong hạt nhân của một nguyên tử. Vì mỗi proton mang một điện tích dương cơ bản (+1), nên số Z trực tiếp quyết định độ lớn điện tích dương của hạt nhân.
Ví dụ, một nguyên tử có 8 proton trong hạt nhân thì sẽ có điện tích hạt nhân là +8.
Trong một nguyên tử trung hòa về điện, số proton (Z) luôn bằng số electron quay quanh hạt nhân. Đây là một khái niệm cốt lõi trong cấu tạo nguyên tử.
Điểm mấu chốt: Điện tích hạt nhân luôn luôn dương.
Các Đơn Vị Đo Lường Điện Tích Hạt Nhân
Điện tích hạt nhân được đo bằng hai đơn vị chính: số đơn vị điện tích hạt nhân (Z, không thứ nguyên) dùng trong hóa học thông thường, và Coulomb (C) dùng để tính toán giá trị vật lý thực tế.
Tùy vào mục đích sử dụng, điện tích hạt nhân có thể được biểu thị theo hai đơn vị chính:
1. Số Đơn Vị Điện Tích Hạt Nhân (Z)
Đây là cách biểu diễn phổ biến và đơn giản nhất. Z là một số nguyên không có thứ nguyên, chỉ đơn thuần là số lượng proton.
- Ví dụ: Nguyên tử Oxygen (Oxi) có Z = 8. Ta nói điện tích hạt nhân của Oxi là +8.
2. Đơn Vị SI (Coulomb – C)
Để biểu diễn giá trị vật lý thực tế của điện tích, ta sử dụng đơn vị Coulomb (C). Điện tích của một proton là +1,602 × 10⁻¹⁹ C.
Do đó, công thức tính điện tích hạt nhân theo Coulomb là:
Đơn vị này rất quan trọng trong các tính toán liên quan đến lực hút tĩnh điện giữa hạt nhân và electron.
Làm Thế Nào Để Xác Định Điện Tích Hạt Nhân? (3 Bước Đơn Giản)
Để xác định điện tích hạt nhân, bạn chỉ cần tìm số hiệu nguyên tử (Z) của nguyên tố đó trong Bảng Tuần Hoàn Hóa Học. Giá trị Z chính là số đơn vị điện tích hạt nhân.
Việc xác định điện tích hạt nhân vô cùng dễ dàng nếu bạn biết cách tra cứu thông tin.
Bước 1: Tìm Số Hiệu Nguyên Tử (Z)
Cách nhanh nhất để tìm Z là tra cứu trong Bảng Tuần Hoàn Hóa Học. Số hiệu nguyên tử của một nguyên tố chính là giá trị Z của nó.
Bước 2: Ghi Lại Giá Trị Z
Giá trị Z bạn vừa tìm được chính là số đơn vị điện tích hạt nhân.
Bước 3 (Tùy chọn): Quy Đổi Ra Coulomb
Nếu cần tính toán giá trị vật lý, hãy nhân Z với hằng số điện tích cơ bản 1,602 × 10⁻¹⁹ C.
Ví dụ Minh Họa:
- Nguyên tử Natri (Na):
- Tra bảng tuần hoàn, ta thấy Natri (Na) có số hiệu nguyên tử là 11.
- Vậy, điện tích hạt nhân của Natri là +11.
- Tính theo Coulomb:
11 × 1,602 × 10⁻¹⁹ C ≈ 17,622 × 10⁻¹⁹ C.
- Nguyên tử Carbon (C):
- Cacbon (C) có số hiệu nguyên tử là 6.
- Điện tích hạt nhân là +6.
- Tính theo Coulomb:
6 × 1,602 × 10⁻¹⁹ C ≈ 9,612 × 10⁻¹⁹ C.
Một lưu ý quan trọng về các đồng vị: Các đồng vị của cùng một nguyên tố có số neutron khác nhau nhưng luôn có cùng số proton. Do đó, tất cả các đồng vị của một nguyên tố đều có cùng một điện tích hạt nhân Z.
Phân Biệt Điện Tích Hạt Nhân (Z) và Điện Tích Hạt Nhân Hiệu Dụng (Z_eff)
Điện tích hạt nhân (Z) là tổng điện tích thực của hạt nhân, trong khi điện tích hạt nhân hiệu dụng (Z_eff) là lực hút mà electron lớp ngoài cùng thực sự cảm nhận được sau khi đã bị các electron lớp trong che chắn bớt.
Đây là một khái niệm nâng cao hơn nhưng rất dễ gây nhầm lẫn.
| Đặc Điểm | Điện Tích Hạt Nhân (Z) | Điện Tích Hạt Nhân Hiệu Dụng (Z_eff) |
|---|---|---|
| Bản chất | Là tổng điện tích thực tế của tất cả proton trong hạt nhân. | Là lực hút cảm nhận bởi một electron ở lớp ngoài cùng sau khi bị các electron lớp trong che chắn. |
| Giá trị | Luôn là một số nguyên (Z). | Luôn nhỏ hơn Z (Z_eff < Z). |
| Ứng dụng | Xác định một nguyên tố hóa học. | Giải thích bán kính nguyên tử, năng lượng ion hóa, và độ âm điện. |
| Ví dụ (Oxi) | Z = 8 | Z_eff ≈ 4,45 cho electron lớp ngoài cùng. |
Nói một cách đơn giản, Z là lực hút “tối đa” của hạt nhân, trong khi Z_eff là lực hút “thực tế” mà electron ở xa nhất cảm nhận được.
Những Điều Cần Ghi Nhớ
- Không nhầm lẫn Z với Số khối A: Số khối A là tổng của proton và neutron (A = Z + N).
- Điện tích hạt nhân quyết định danh tính của nguyên tố: Nếu Z thay đổi, đó sẽ là một nguyên tố khác.
- Trong các phản ứng hóa học thông thường, điện tích hạt nhân (Z) của một nguyên tử không thay đổi.
Câu Hỏi Thường Gặp (FAQs)
1. Đơn vị điện tích hạt nhân có phải luôn là Coulomb không?
Không. Trong hóa học, đơn vị Z (số proton) được dùng phổ biến hơn vì tính đơn giản. Coulomb (C) được dùng cho các tính toán vật lý chuyên sâu.
2. Điện tích hạt nhân có thể âm không?
Không bao giờ. Điện tích hạt nhân được quyết định bởi các hạt proton mang điện dương, do đó nó luôn là một giá trị dương.
3. Làm thế nào để tính điện tích hạt nhân hiệu dụng (Z_eff)?
Z_eff được tính bằng công thức Z_eff = Z – S, trong đó Z là điện tích hạt nhân và S là hằng số chắn được xác định bằng các quy tắc phức tạp như Quy tắc Slater.
Hy vọng bài viết này đã cung cấp cho bạn một cái nhìn chi tiết và dễ hiểu về đơn vị điện tích hạt nhân. Đây là kiến thức nền tảng giúp bạn tự tin hơn trên con đường chinh phục môn hóa học.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









