Kiến thức chuyên môn
Định Luật Bảo Toàn Khối Lượng: Công Thức, Ý Nghĩa & Bài Tập Vận Dụng [Chi Tiết]
Định luật bảo toàn khối lượng là một trong những nguyên tắc nền tảng và quan trọng bậc nhất của hóa học hiện đại. Nó không chỉ giúp học sinh giải quyết các bài toán định lượng một cách nhanh chóng mà còn là cơ sở để hiểu sâu về bản chất của mọi phản ứng hóa học.
Bài viết này sẽ phân tích chi tiết từ A-Z về định luật Lomonosov-Lavoisier, công thức tính và các dạng bài tập ứng dụng thực tế để bạn hoàn toàn chinh phục chủ đề này.
Định Luật Bảo Toàn Khối Lượng Là Gì?
Định luật bảo toàn khối lượng phát biểu rằng: “Trong một phản ứng hóa học kín, tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các sản phẩm tạo thành.”
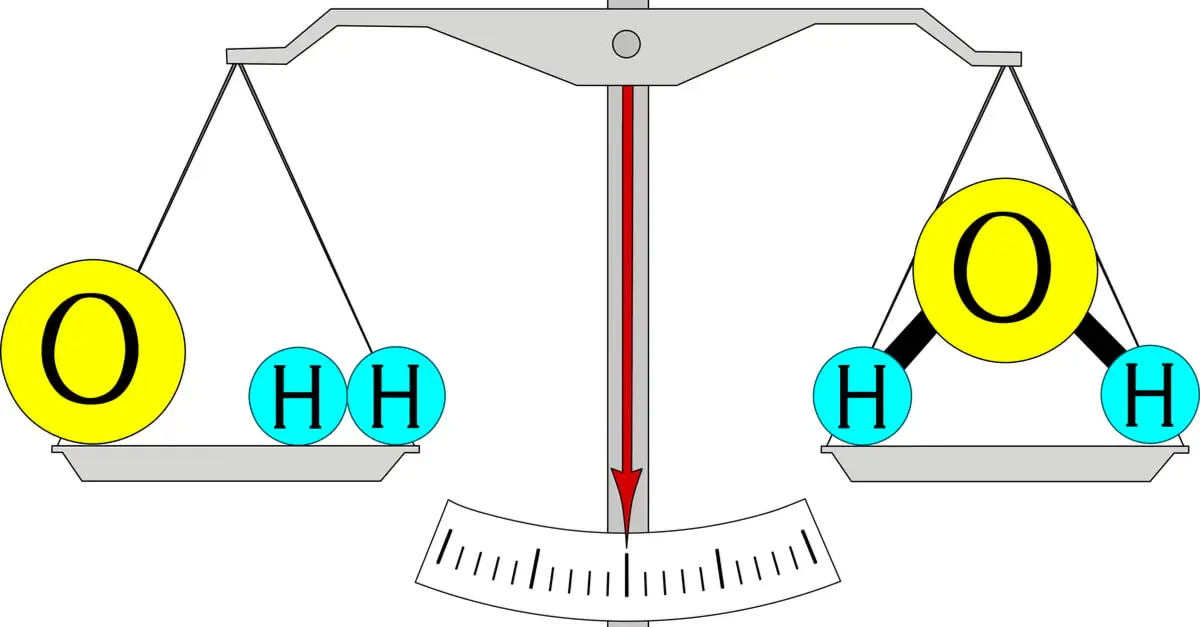
Nói một cách đơn giản, vật chất không tự nhiên sinh ra cũng không tự nhiên mất đi trong một phản ứng hóa học, chúng chỉ chuyển đổi từ dạng này sang dạng khác.
Ví dụ kinh điển: Khi cho Bari Clorua (BaCl₂) phản ứng với Natri Sunphat (Na₂SO₄), tổng khối lượng của ![]() và
và ![]() ban đầu sẽ chính xác bằng tổng khối lượng của Bari Sunphat (
ban đầu sẽ chính xác bằng tổng khối lượng của Bari Sunphat (![]() ) và Natri Clorua (NaCl) tạo thành.
) và Natri Clorua (NaCl) tạo thành.
Bản Chất và Ý Nghĩa Của Định Luật
Bản chất của định luật là do trong phản ứng hóa học, số lượng và khối lượng của nguyên tử mỗi nguyên tố được bảo toàn. Ý nghĩa của nó là giúp tính toán định lượng và khẳng định vật chất không tự mất đi hay sinh ra.
Bản Chất Cốt Lõi Của Định Luật
Bản chất của định luật này nằm ở cấp độ nguyên tử. Trong một phản ứng hóa học, chỉ có sự thay đổi về liên kết giữa các nguyên tử.
- Số lượng nguyên tử của mỗi nguyên tố và khối lượng của chúng không hề thay đổi (ví dụ, một nguyên tử Cacbon luôn có khối lượng là 12u).
- Vì tổng số nguyên tử của mỗi nguyên tố được bảo toàn, nên tổng khối lượng của chúng cũng phải được bảo toàn.
Ý Nghĩa Thực Tiễn
Định luật này khẳng định một chân lý: vật chất không mất đi hay sinh ra trong quá trình biến đổi hóa học. Ý nghĩa của nó vô cùng to lớn:
- Tính toán định lượng: Cho phép chúng ta tính toán khối lượng của một chất trong phản ứng khi biết khối lượng của các chất còn lại.
- Cân bằng phương trình: Là cơ sở để cân bằng số lượng nguyên tử trong các phương trình phản ứng.
- Sản xuất công nghiệp: Giúp tính toán hiệu suất phản ứng, lượng nguyên liệu cần dùng và lượng sản phẩm thu được trong sản xuất hóa chất.
Hướng Dẫn Cách Tính (Công Thức Áp Dụng)
Công thức tổng quát là
. Quy tắc là: nếu biết khối lượng của (n-1) chất trong phản ứng có n chất, ta luôn có thể tính được khối lượng của chất còn lại.
Công Thức Tổng Quát
Giả sử có phản ứng hóa học tổng quát:
![]()
Theo Định luật bảo toàn khối lượng, ta luôn có phương trình khối lượng:
![]()
Trong đó:
 : Khối lượng của các chất tham gia phản ứng A và B.
: Khối lượng của các chất tham gia phản ứng A và B. : Khối lượng của các sản phẩm C và D.
: Khối lượng của các sản phẩm C và D.
Quy Tắc Áp Dụng
Trong một phản ứng có ![]() chất (bao gồm cả chất tham gia và sản phẩm), nếu chúng ta biết khối lượng của (
chất (bao gồm cả chất tham gia và sản phẩm), nếu chúng ta biết khối lượng của (![]() ) chất, ta luôn có thể tìm được khối lượng của chất còn lại.
) chất, ta luôn có thể tìm được khối lượng của chất còn lại.
- Ví dụ: Phản ứng

- Phương trình khối lượng:

Các Dạng Bài Tập Ứng Dụng Định Luật Bảo Toàn Khối Lượng
Dưới đây là các bài tập vận dụng từ cơ bản đến nâng cao, bao gồm lý thuyết, tính toán, phản ứng cháy, và giải thích hiện tượng thực tế để bạn thực hành thành thạo.
Dưới đây là các bài tập vận dụng từ cơ bản đến nâng cao giúp bạn hiểu sâu và thực hành thành thạo.
Bài 1: Lý thuyết cơ bản
Phát biểu: Trong một phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các sản phẩm tạo thành.
Giải thích: Do số lượng và khối lượng của các nguyên tử không đổi, chỉ thay đổi liên kết.
- a. Phát biểu định luật bảo toàn khối lượng:
Trong một phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các sản phẩm tạo thành. - b. Giải thích vì sao khối lượng được bảo toàn:
Trong phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi, còn số lượng và khối lượng của mỗi nguyên tử không đổi. Do đó, tổng khối lượng các chất trước và sau phản ứng luôn bằng nhau.
Bài 2: Tính toán cơ bản
Đáp án:
Đề bài: Phản ứng BaCl₂ + Na₂SO₄ ![]()
![]() + 2NaCl. Cho biết
+ 2NaCl. Cho biết ![]() ,
, ![]() ,
, ![]() . Tính
. Tính ![]() .
.
Giải:
Áp dụng định luật:
![]()
![]()
![]()
![]()
Bài 3: Phản ứng cháy với Oxi
Đáp án:
Đề bài: Đốt cháy 9g Magie (Mg) trong không khí (chứa Oxygen), thu được 15g Magie Oxit (MgO).
a. Phản ứng hóa học:
![]()
b. Công thức khối lượng:
![]()
![]()
c. Tính ![]() :
:
![]()
Bài 4: Tính khối lượng chất tham gia
Đáp án:
Đề bài: Đốt cháy ![]() Cacbon (C) với 16g Oxi (O₂), thu được 22g Cacbon Đioxit (CO₂). Tính
Cacbon (C) với 16g Oxi (O₂), thu được 22g Cacbon Đioxit (CO₂). Tính ![]() .
.
Giải:
Phản ứng: ![]()
Áp dụng định luật:
![]()
![]()
![]()
Bài 5: Phản ứng tạo Oxit Axit
Đáp án:
Đề bài: Đốt cháy 3,2g Lưu huỳnh (S) trong không khí, thu được 6,4g Lưu huỳnh Đioxit (SO₂). Tính ![]() .
.
Giải:
Phản ứng: ![]()
Áp dụng định luật:
![]()
![]()
![]()
Bài 6: Bài toán tỉ lệ khối lượng
Đáp án:
và
Đề bài: Đốt cháy ![]() Mg, thu được 8g MgO. Biết
Mg, thu được 8g MgO. Biết ![]() .
.
a. Phản ứng hóa học:
![]()
b. Tính ![]() và
và ![]() :
:
Gọi ![]() , thì
, thì ![]() .
.
Áp dụng định luật:
![]()
![]()
![]()
![]()
Vậy: ![]() và
và ![]() .
.
Bài 7: Phản ứng nhiệt phân (Bài toán thực tế)
Đáp án:
Đề bài: Nung đá đôlomit (hỗn hợp CaCO₃ và MgCO₃), tạo ra CaO (Vôi sống), MgO và CO₂.
a. Phản ứng và phương trình khối lượng:
![]()
![]()
Phương trình khối lượng tổng:
![]()
Hay: ![]()
b. Tính ![]() :
:
Cho ![]() ,
, ![]() .
.
![]()
Bài 8: Giải thích hiện tượng (Tăng/Giảm khối lượng)
Nung thanh sắt: Khối lượng TĂNG, vì sắt phản ứng cộng thêm khối lượng Oxi từ không khí (
).
Nung đá vôi: Khối lượng GIẢM, vìphân hủy, giải phóng khí
bay đi (
).
- Nung thanh sắt: Khối lượng tăng lên.
Giải thích: Sắt phản ứng với Oxi trong không khí, tạo ra Oxit Sắt (Fe₂O₃). Khối lượng thanh sắt sau khi nung bằng khối lượng Sắt ban đầu CỘNG với khối lượng Oxi đã phản ứng. - Nung đá vôi (CaCO₃): Khối lượng giảm đi.
Giải thích: phân hủy thành CaO (chất rắn) và CO₂ (chất khí). Khí
phân hủy thành CaO (chất rắn) và CO₂ (chất khí). Khí  bay ra khỏi hệ, làm cho khối lượng chất rắn còn lại (CaO) nhỏ hơn khối lượng
bay ra khỏi hệ, làm cho khối lượng chất rắn còn lại (CaO) nhỏ hơn khối lượng  ban đầu.
ban đầu.
Bài 9: Phản ứng tạo khí (Hệ hở)
Đáp án:
(tương đương 9ml nước).
Đề bài: Hòa tan CaC₂ trong ![]() , thu được Axetilen (C₂H₂) và Canxi Hidroxit (Ca(OH)₂).
, thu được Axetilen (C₂H₂) và Canxi Hidroxit (Ca(OH)₂).
a. Phương trình khối lượng:
![]()
![]()
b. Tính ![]() :
:
Cho ![]() ,
, ![]() ,
, ![]() .
.
![]()
![]()
![]()
(Tương đương ![]() nước)
nước)
Bài 10: Phản ứng trong dung dịch
Giải thích: Điều này KHÔNG vi phạm định luật. Khối lượng dung dịch giảm là vì khí
đã thoát ra. Tổng khối lượng của (dung dịch sau phản ứng + khí
) vẫn bằng tổng khối lượng ban đầu.
Giải thích:
Phản ứng: Mg + 2HCl ![]() MgCl₂ +
MgCl₂ + ![]()
Khối lượng dung dịch ![]() thu được nhỏ hơn tổng khối lượng của Mg và dung dịch HCl ban đầu. Điều này KHÔNG vi phạm định luật.
thu được nhỏ hơn tổng khối lượng của Mg và dung dịch HCl ban đầu. Điều này KHÔNG vi phạm định luật.
- Lý do: Khí
 đã thoát ra khỏi dung dịch.
đã thoát ra khỏi dung dịch. - Chứng minh định luật:

Định luật bảo toàn khối lượng vẫn được áp dụng chính xác nếu ta tính cả khối lượng của khí đã bay hơi.
đã bay hơi.
Tổng Kết
Chìa khóa của định luật là “tổng khối lượng chất tham gia luôn bằng tổng khối lượng sản phẩm”. Nắm vững nguyên tắc này là bạn có thể giải quyết mọi bài toán định lượng trong hóa học một cách logic và chính xác.
Định luật bảo toàn khối lượng là một công cụ vô giá trong hóa học. Bằng cách hiểu rằng tổng khối lượng chất tham gia luôn bằng tổng khối lượng sản phẩm, bạn có thể giải quyết mọi bài toán định lượng một cách logic và chính xác.
Hy vọng bài viết đã giúp bạn hiểu rõ định luật bảo toàn khối lượng. Hãy tiếp tục thực hành và khám phá thêm các hóa chất công nghiệp và kiến thức chuyên sâu tại Hóa chất Doanh để củng cố nền tảng của mình!
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










