Kiến thức chuyên môn
Clo Hóa Trị Mấy? [Giải Đáp] Tất Tần Tật Về Số Oxi Hóa Của Clo (Cl)
Clo (Cl) hóa trị mấy là câu hỏi nền tảng nhưng vô cùng quan trọng trong hóa học, bởi nó quyết định cách nguyên tố này tương tác và hình thành nên vô số hợp chất. Mặc dù hóa trị phổ biến nhất của Clo là 1, nhưng số oxi hóa của nó lại cực kỳ linh hoạt, dao động từ -1, +1, +3, +5, cho đến +7.
Sự đa dạng này cho phép Clo góp mặt trong mọi thứ, từ muối ăn hàng ngày (Natri Clorua – NaCl) đến các chất tẩy rửa mạnh mẽ như Javen (NaClO). Bài viết này sẽ phân tích chi tiết, giúp bạn nắm vững cách xác định hóa trị và số oxi hóa của Clo một cách chính xác nhất.
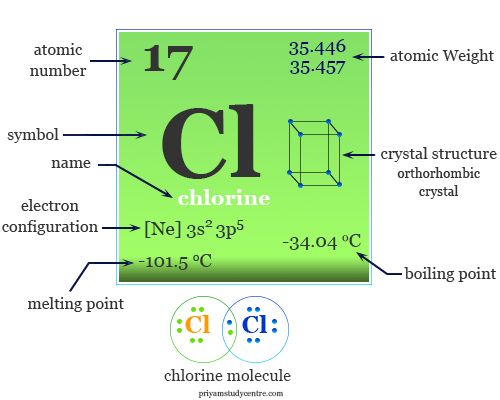
Sự Khác Biệt Then Chốt: Hóa Trị vs. Số Oxi Hóa Của Clo
Hóa trị của Clo hầu như luôn là 1 trong các hợp chất cộng hóa trị đơn giản, trong khi số oxi hóa linh hoạt từ -1 đến +7.
Nhiều người thường nhầm lẫn giữa hai khái niệm này. Để hiểu đúng “Clo hóa trị mấy”, ta cần phân biệt rõ:
- Hóa trị (Valency): Là số liên kết mà một nguyên tử Clo tạo ra với các nguyên tử khác trong một phân tử. Hóa trị của Clo hầu như luôn là 1 trong các hợp chất cộng hóa trị đơn giản.
- Số Oxi Hóa (Oxidation State): Là điện tích giả định của nguyên tử Clo nếu các liên kết cộng hóa trị được xem là liên kết ion. Đây là giá trị thể hiện sự đa dạng và linh hoạt của Clo.
Nguyên nhân của sự đa dạng này? Clo thuộc nhóm Halogen (nhóm 17) trong bảng tuần hoàn hóa học, có 7 electron ở lớp ngoài cùng. Nó có xu hướng nhận thêm 1 electron để đạt cấu hình bền vững, do đó thường có số oxi hóa -1. Tuy nhiên, khi kết hợp với các nguyên tố có độ âm điện lớn hơn (như Oxi, Flo), Clo có thể “nhường” electron và thể hiện các số oxi hóa dương.
Các Số Oxi Hóa Phổ Biến Của Clo
Số oxi hóa của Clo dao động từ -1 (phổ biến nhất) đến +7, tùy thuộc vào hợp chất.
Hãy cùng xét các trường hợp cụ thể để thấy rõ sự biến thiên số oxi hóa của Clo.
1. Số Oxi Hóa -1 (Phổ biến nhất)
Số oxi hóa -1 xuất hiện khi Clo liên kết với kim loại hoặc Hydro, như trong HCl và NaCl.
Đây là trạng thái ổn định và thường gặp nhất của Clo, khi nó liên kết với kim loại hoặc Hydro.
- Ví dụ 1: Axit Clohidric (HCl)
- Hydro (H) có số oxi hóa +1.
- Để phân tử trung hòa về điện, Clo phải có số oxi hóa -1.
- Đây là một axit mạnh, là một trong những hóa chất công nghiệp cơ bản.
- Ví dụ 2: Natri Clorua (NaCl)
- Natri (Na) là kim loại kiềm có số oxi hóa +1.
- Do đó, Clo có số oxi hóa -1.
2. Số Oxi Hóa 0
Trong dạng đơn chất Cl₂, số oxi hóa của Clo là 0.
Ở dạng đơn chất, phân tử Clo (Cl₂) bao gồm hai nguyên tử Clo liên kết với nhau. Vì không có sự chênh lệch độ âm điện, số oxi hóa của mỗi nguyên tử Clo là 0.
3. Các Số Oxi Hóa Dương (+1, +3, +5, +7)
Các số oxi hóa dương xuất hiện khi Clo kết hợp với Oxi, như +1 trong NaClO, +3 trong HClO₂, +5 trong KClO₃, và +7 trong HClO₄ hoặc Cl₂O₇.
Khi Clo kết hợp với Oxi (một chất oxi hóa rất mạnh), nó sẽ mang các số oxi hóa dương.
- Số Oxi Hóa +1: Natri Hypoclorit (NaClO)
- Đây là thành phần chính của nước Javen.
- Na (+1), O (-2) ⟶ Cl có số oxi hóa +1.
- Số Oxi Hóa +3: Axit Clorơ (HClO₂)
- H (+1), O (-2) x 2 = -4 ⟶ Cl có số oxi hóa +3.
- Số Oxi Hóa +5: Kali Clorat (KClO₃)
- Kali (K) (+1), O (-2) x 3 = -6 ⟶ Cl có số oxi hóa +5.
- Số Oxi Hóa +7: Axit Pecloric (HClO₄) và Dichlor Heptoxide (Cl₂O₇)
- Đây là số oxi hóa cao nhất của Clo.
- Trong Cl₂O₇: O (-2) x 7 = -14 ⟶ 2Cl phải là +14 ⟶ Mỗi Cl có số oxi hóa +7.
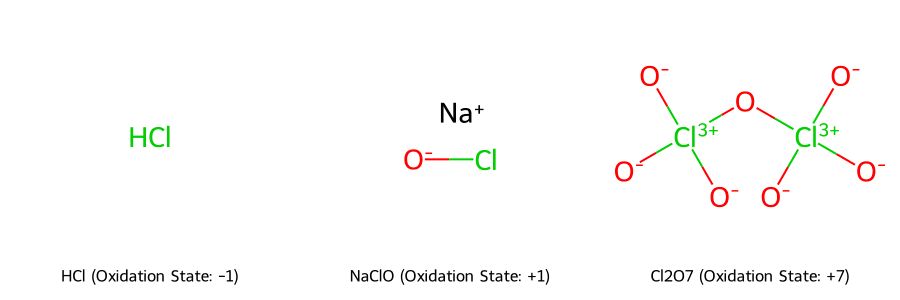
Bảng Tổng Hợp Hóa Trị và Số Oxi Hóa Của Clo
Hóa trị của Clo thường là 1, với số oxi hóa từ -1 đến +7 trong các hợp chất khác nhau.
Để dễ dàng tham khảo, bảng dưới đây tóm tắt các trạng thái oxi hóa chính của Clo trong một số hợp chất tiêu biểu.
| Hợp Chất | Công Thức Hóa Học | Hóa Trị Của Clo | Số Oxi Hóa Của Clo | Ghi Chú Tính Toán |
|---|---|---|---|---|
| Axit Clohidric | HCl | 1 | -1 | H là +1, tổng phân tử bằng 0 ⟶ Cl là -1 |
| Đơn chất Clo | Cl₂ | 1 | 0 | Phân tử đơn chất |
| Natri Hypoclorit | NaClO | 1 | +1 | Na (+1), O (-2) ⟶ Cl là +1 |
| Axit Clorơ | HClO₂ | 1 | +3 | H (+1), O (-4) ⟶ Cl là +3 |
| Kali Clorat | KClO₃ | 1 | +5 | K (+1), O (-6) ⟶ Cl là +5 |
| Dichlor Heptoxide | Cl₂O₇ | 1 | +7 | O (-14) ⟶ 2Cl là +14 ⟶ Cl là +7 |
Kết Luận
Hóa trị của Clo là 1, nhưng số oxi hóa đa dạng từ -1 đến +7.
Vậy Clo hóa trị mấy? Câu trả lời ngắn gọn là hóa trị 1. Tuy nhiên, câu hỏi sâu hơn về số oxi hóa của Clo lại mở ra một bức tranh đa dạng hơn nhiều, với các giá trị từ -1 đến +7. Việc hiểu rõ sự khác biệt này và cách xác định số oxi hóa trong từng hợp chất là kỹ năng cốt lõi giúp bạn chinh phục môn hóa học và ứng dụng vào thực tiễn.
Tại Đoàn Tín Chem, chúng tôi không chỉ cung cấp các loại hóa chất chứa Clo chất lượng cao mà còn sẵn sàng tư vấn kỹ thuật chuyên sâu, giúp bạn hiểu rõ và sử dụng sản phẩm một cách an toàn, hiệu quả nhất.
Nếu bạn có nhu cầu về HCl, Javen, hoặc các hóa chất công nghiệp khác, hãy truy cập website hoachatdoanhtin.com hoặc liên hệ trực tiếp để được hỗ trợ tốt nhất!
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









