Kiến thức chuyên môn
Oxi Hóa Là Gì? Mọi Điều Bạn Cần Biết Về Phản Ứng Oxi Hóa – Khử
Oxi hóa là một trong những khái niệm nền tảng và quan trọng nhất trong hóa học, xuất hiện trong vô số quá trình từ công nghiệp sản xuất đến các hoạt động sống hàng ngày. Vậy thực chất oxi hóa là gì? Làm thế nào để nhận biết và ứng dụng nó?
Bài viết này sẽ cung cấp cho bạn cái nhìn toàn diện, từ định nghĩa cơ bản, các loại phản ứng, ví dụ minh họa trực quan đến những ứng dụng thực tiễn không thể thiếu của quá trình này.
Oxi Hóa Là Gì?
Oxi hóa là quá trình một chất bị mất electron, dẫn đến số oxi hóa của nó tăng lên. Quá trình này luôn xảy ra đồng thời với quá trình khử (nhận electron) trong một phản ứng oxi hóa – khử.
Oxi hóa là quá trình một nguyên tử, ion, hoặc phân tử bị mất đi electron khi tham gia vào một phản ứng hóa học. Quá trình này dẫn đến sự gia tăng số oxi hóa của chất đó.
Một cách hiểu đơn giản hơn, chất bị oxi hóa được gọi là chất khử. Ngược lại, quá trình một chất nhận electron được gọi là quá trình khử, và chất nhận electron đó là chất oxi hóa. Hai quá trình này luôn xảy ra đồng thời trong một phản ứng duy nhất gọi là phản ứng oxi hóa – khử (redox).
Ví dụ kinh điển: Sự rỉ sét của sắt. Nguyên tử sắt (Fe) bị mất electron để tạo thành ion sắt (Fe²⁺ hoặc Fe³⁺).
Fe ⟶ Fe²⁺ + 2e⁻Các Loại Phản Ứng Oxi Hóa Phổ Biến
Câu trả lời ngắn: Có hai loại phản ứng oxi hóa chính: phản ứng kết hợp trực tiếp với oxy (như sự cháy) và phản ứng oxi hóa – khử (redox) không cần oxy, nơi các chất trao đổi electron.
Oxi hóa không chỉ là sự tương tác với oxy (Oxygen), mà còn bao gồm nhiều dạng phản ứng khác nhau.
Phản ứng kết hợp với Oxy
Đây là dạng phản ứng oxi hóa nguyên thủy và dễ nhận biết nhất, trong đó một chất tác dụng trực tiếp với khí oxy để tạo ra oxit.
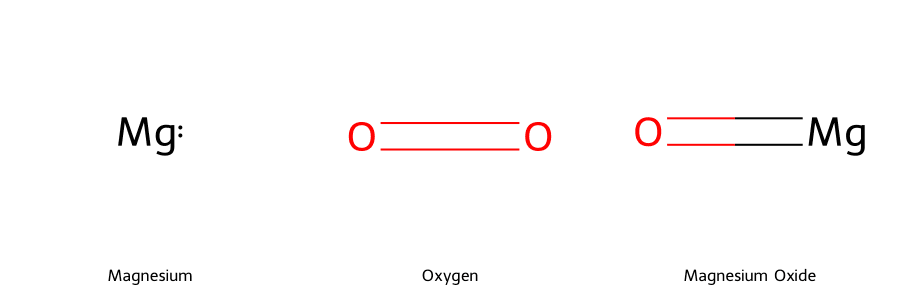
- Ví dụ: Đốt cháy kim loại Magie (Mg) trong không khí. Magie mất 2 electron và bị oxi hóa mạnh, phát ra ánh sáng chói lọi.
2Mg + O₂ ⟶ 2MgO- Ứng dụng: Quá trình đốt cháy nhiên liệu hóa thạch (xăng, than, khí gas) để tạo ra năng lượng là một ví dụ điển hình.
 Phản ứng oxi hóa của Magie tỏa nhiệt và ánh sáng mạnh.
Phản ứng oxi hóa của Magie tỏa nhiệt và ánh sáng mạnh.
Phản ứng khử-oxi hóa (Redox)
Đây là bản chất thực sự của hầu hết các phản ứng hóa học. Trong một phản ứng redox, quá trình oxi hóa (mất e⁻) của một chất luôn đi kèm với quá trình khử (nhận e⁻) của một chất khác.
- Ví dụ: Dùng khí Hydro (H₂) để khử Đồng(II) oxit (CuO) thành đồng kim loại.
CuO + H₂ ⟶ Cu + H₂OTrong phản ứng này:
– H₂ bị oxi hóa: Số oxi hóa tăng từ 0 lên +1 (trong H₂O).
– CuO bị khử: Số oxi hóa của Cu giảm từ +2 xuống 0.
- Ứng dụng: Tinh chế kim loại từ quặng, hoạt động của pin điện hóa, các quá trình mạ điện.
Cách Nhận Biết Phản Ứng Oxi Hóa
Để nhận biết quá trình oxi hóa, hãy kiểm tra sự thay đổi số oxi hóa. Nếu số oxi hóa của một nguyên tố tăng lên sau phản ứng, nó đã bị oxi hóa. Các dấu hiệu khác bao gồm sự mất electron, kết hợp với oxy, hoặc mất hydro (trong hóa hữu cơ).
Để xác định chính xác một chất có bị oxi hóa hay không, bạn có thể dựa vào các dấu hiệu sau:
- Sự thay đổi số oxi hóa: Đây là phương pháp chính xác và tổng quát nhất. Nếu số oxi hóa của một nguyên tố tăng lên sau phản ứng, nguyên tố đó đã bị oxi hóa.
Ví dụ: Trong phản ứngZn + 2HCl ⟶ ZnCl₂ + H₂, số oxi hóa của Kẽm (Zn) tăng từ 0 lên +2, do đó Zn bị oxi hóa. - Sự cho – nhận electron: Chất mất electron là chất bị oxi hóa.
Ví dụ: Natri (Na) phản ứng với Clo:Na ⟶ Na⁺ + e⁻. Natri đã mất 1 electron. - Sự kết hợp với oxy hoặc mất đi hydro: Trong hóa học hữu cơ, một hợp chất bị oxi hóa khi nó kết hợp thêm oxy hoặc mất đi nguyên tử hydro.
Ví dụ: Ancol etylic (Ethanol) bị oxi hóa thành andehit axetic:CH₃CH₂OH ⟶ CH₃CHO + H₂.
Ứng Dụng Thực Tiễn Quan Trọng Của Oxi Hóa
Quá trình oxi hóa có mặt ở khắp mọi nơi và đóng vai trò sống còn trong cả công nghiệp và đời sống.
Trong Công Nghiệp:
- Sản xuất hóa chất: Điều chế axit sunfuric (H₂SO₄) từ lưu huỳnh, sản xuất axit nitric (HNO₃) từ amoniac (NH₃).
- Luyện kim: Oxi hóa các tạp chất trong quặng để thu được kim loại tinh khiết.
- Xử lý nước: Sử dụng các chất oxi hóa mạnh như Chloramin B hoặc ozon để khử trùng và loại bỏ các chất ô nhiễm.
Trong Đời Sống:
- Hô hấp tế bào: Đây là quá trình oxi hóa glucose trong cơ thể để tạo ra năng lượng ATP, duy trì sự sống.
- Đốt cháy nhiên liệu: Cung cấp năng lượng cho xe cộ, nhà máy và đun nấu.
- Tác động tiêu cực: Sự rỉ sét làm hư hỏng các công trình kim loại, ôi thiu thực phẩm do chất béo bị oxi hóa.
Phòng Tránh Các Tác Động Tiêu Cực Của Oxi Hóa
Mặc dù hữu ích, nhưng các quá trình oxi hóa không mong muốn có thể gây ra nhiều thiệt hại. Dưới đây là các biện pháp phòng tránh hiệu quả:
- Chống ăn mòn kim loại: Sử dụng sơn chống rỉ, mạ kẽm (tạo lớp bảo vệ), hoặc sử dụng các hợp kim không gỉ.
- Bảo quản thực phẩm: Đóng gói hút chân không, sử dụng phụ gia thực phẩm chống oxi hóa (như vitamin C), hoặc bảo quản ở nhiệt độ thấp.
- An toàn hóa chất: Cần bảo quản hóa chất có tính oxi hóa mạnh một cách cẩn thận để tránh nguy cơ cháy nổ.
Câu Hỏi Thường Gặp (FAQs)
1. Oxi hóa và khử khác nhau như thế nào?
Oxi hóa là mất electron, làm tăng số oxi hóa. Khử là nhận electron, làm giảm số oxi hóa. Chúng là hai mặt của cùng một quá trình và luôn xảy ra đồng thời.
2. Làm thế nào để ngăn chặn rỉ sét một cách hiệu quả?
Các phương pháp phổ biến bao gồm sơn phủ bề mặt, mạ bảo vệ (mạ kẽm, mạ crom), sử dụng chất ức chế ăn mòn, và phương pháp bảo vệ catot.
3. Quá trình oxi hóa có luôn cần oxy không?
Không. Rất nhiều phản ứng oxi hóa không có sự tham gia của oxy, ví dụ như phản ứng giữa Natri và Clo tạo thành NaCl. Điểm cốt lõi của oxi hóa là sự mất electron.
Hy vọng bài viết này đã giúp bạn có cái nhìn chi tiết và hệ thống về quá trình oxi hóa. Nếu bạn có nhu cầu tìm hiểu thêm hoặc cần tư vấn về các loại hóa chất công nghiệp liên quan, hãy liên hệ với chúng tôi để được hỗ trợ.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










