Kiến thức chuyên môn
Chất Điện Li Là Gì? Phân Loại & Ứng Dụng Trong Công Nghiệp
CHẤT ĐIỆN LI LÀ GÌ? CẨM NANG TOÀN DIỆN VỀ LÝ THUYẾT, PHÂN LOẠI & ỨNG DỤNG CÔNG NGHIỆP (2026)
Tác giả: PGS. TS Đặng Hoàng Phú | Cố vấn chuyên môn: Công Ty Cổ Phần Hoá Chất Doanh Tín
Tóm tắt nhanh cho Nhà quản lý & Kỹ sư:
Chất điện li là nền tảng vận hành của các quy trình công nghiệp cốt lõi như mạ điện, xử lý nước thải và sản xuất pin ắc quy. Hiểu rõ về cơ chế phân li, hằng số điện li và quy tắc an toàn hóa chất không chỉ giúp tối ưu hóa hiệu suất sản xuất mà còn đảm bảo tuân thủ các quy định pháp luật (GHS, Luật Hóa chất).
Từ “Ngọn Đèn Bật Sáng” đến Cỗ Máy Công Nghiệp Tỷ Đô
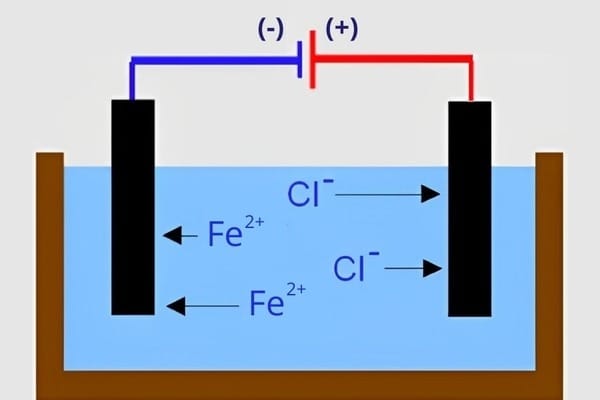
Hãy bắt đầu bằng một hình ảnh kinh điển trong phòng thí nghiệm: Bạn có hai cốc nước trong suốt giống hệt nhau. Một cốc chứa nước pha đường, cốc kia chứa nước pha muối ăn (NaCl). Khi cắm điện cực vào, chỉ có cốc nước muối làm bóng đèn vụt sáng.
Tại sao? Bí mật nằm ở Ion. Trong khi đường chỉ hòa tan, muối ăn lại thực hiện một “cuộc cách mạng” cấp phân tử: chúng phân li thành các hạt mang điện tích tự do. Những chất có khả năng này gọi là Chất điện li.
Nhưng câu chuyện không dừng lại ở bóng đèn nhỏ bé đó. Từ nguyên lý đơn giản này, nhân rộng ra quy mô công nghiệp, chúng ta có:
- Những bể xi mạ khổng lồ tạo nên vẻ sáng bóng cho linh kiện ô tô.
- Hàng tỷ viên Pin Lithium-ion đang vận hành thế giới công nghệ.
- Hệ thống xử lý nước thải bảo vệ môi trường tại các khu công nghiệp.
Tại Hóa Chất Doanh Tín, với hơn 20 năm kinh nghiệm cung ứng hóa chất, chúng tôi hiểu rằng việc nắm vững kiến thức về chất điện li là bước đầu tiên để doanh nghiệp lựa chọn đúng nguyên liệu và tối ưu chi phí.
Sự Điện Li Là Gì? Bản Chất & Cơ Chế Hoạt Động
Định nghĩa chuẩn xác (Theo Thuyết Arrhenius)
Sự điện li là quá trình phân li các chất trong nước (hoặc khi nóng chảy) tạo thành các Ion (Cation dương và Anion âm).
- Chất điện li: Là những chất khi tan trong nước phân li ra ion.
- Thành phần chính: Axit, Bazơ và Muối.
Tại sao Nước lại “Xé” được phân tử Muối?
Đây là kiến thức chuyên sâu giúp bạn hiểu bản chất vấn đề. Nước (H₂O) là một dung môi phân cực (Polar solvent) mạnh.
- Nguyên tử Oxi (O) mang điện âm hút Cation kim loại (Na⁺).
- Nguyên tử Hiđro (H) mang điện dương hút Anion gốc axit (Cl⁻).
- Lực hút này cộng với dao động nhiệt sẽ “xé” các ion ra khỏi mạng lưới tinh thể, tạo thành dung dịch dẫn điện.
💡 Góc nhìn chuyên gia: Trong công nghiệp, việc lựa chọn đúng dung môi là sống còn. Nếu bạn dùng dung môi không phân cực (như Benzen, Xăng), sự điện li sẽ không xảy ra, và quá trình mạ điện hay phản ứng hóa học sẽ thất bại.
Phân Loại Chất Điện Li & Lựa Chọn Hóa Chất Công Nghiệp
Việc phân loại đúng giúp doanh nghiệp chọn đúng loại hóa chất cho mục đích sử dụng (tẩy rửa mạnh cần axit mạnh, điều chỉnh pH tinh vi cần axit yếu).
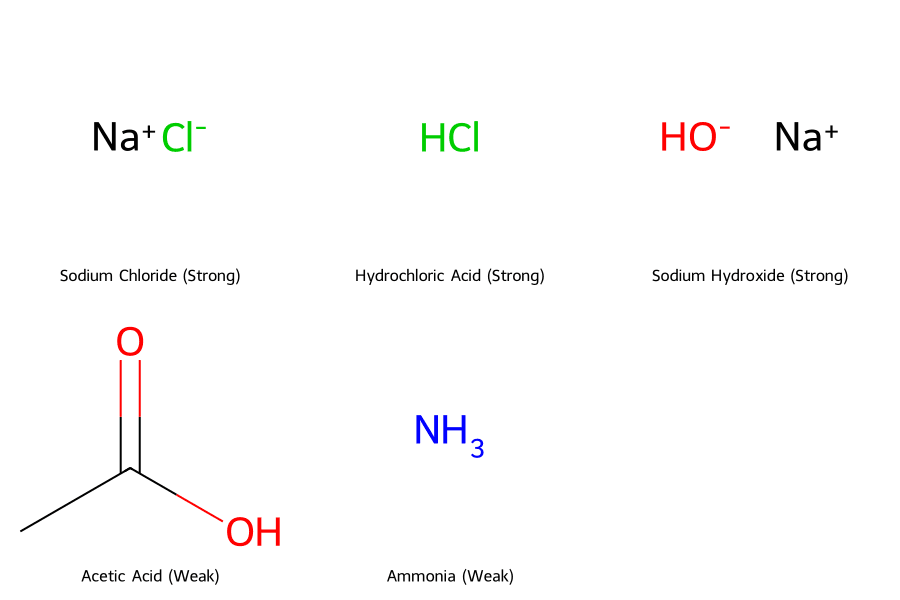
3.1. Chất điện li mạnh (Strong Electrolytes)
Là nhóm “quyền lực” nhất, phân li hoàn toàn 100% ra ion. Đây thường là các hóa chất công nghiệp chủ lực.
- Axit mạnh:
- Axit Sunfuric (H₂SO₄): “Máu” của nền công nghiệp, dùng trong ắc quy và xử lý nước.
- Axit Clohydric (HCl): Tẩy gỉ thép, điều chỉnh pH.
- Axit Nitric (HNO₃): Sản xuất phân bón, thuốc nổ.
- Bazơ mạnh:
- Xút ăn da (NaOH): Hóa chất cơ bản cho ngành giấy, xà phòng, dệt nhuộm.
- Kali Hydroxit (KOH).
- Hầu hết các muối: NaCl, CuSO₄ (Đồng Sunfat dùng trong mạ đồng), Al₂(SO₄)₃ (Phèn nhôm).
Phương trình minh họa: Dùng mũi tên một chiều (→)
Na₂SO₄ → 2Na⁺ + SO₄²⁻
Chất điện li yếu (Weak Electrolytes)
Chỉ phân li một phần, tồn tại cân bằng động. Thường dùng trong các ứng dụng cần sự “nhẹ nhàng” hoặc hệ đệm.
- Đại diện:
- Axit Acetic (CH₃COOH): Dùng trong thực phẩm, dệt nhuộm.
- Amoniac (NH₃).
- Axit Photphoric (H₃PO₄) (Trung bình/Yếu).
Phương trình minh họa: Dùng mũi tên hai chiều (⇌)
CH₃COOH ⇌ CH₃COO⁻ + H⁺
Bảng so sánh nhanh (Dành cho Kỹ sư vận hành)
| Tiêu chí | Chất điện li MẠNH | Chất điện li YẾU | Chất KHÔNG điện li |
|---|---|---|---|
| Độ điện li (α) | ≈ 1 (100%) | 0 < α < 1 | 0 |
| Dẫn điện | Tốt | Kém | Không dẫn |
| Ứng dụng chính | Xi mạ, Pin, Tẩy rửa CN | Thực phẩm, Dược, Hệ đệm | Dung môi, Chất tải lạnh |
| Ví dụ | H₂SO₄, NaOH | CH₃COOH | Ethanol, Glycerin |
Độ Điện Li Alpha (α) & Bài Toán Tối Ưu Chi Phí
Tại sao trong xử lý nước, đôi khi pha loãng hóa chất lại hiệu quả hơn dùng đậm đặc? Điều này liên quan đến Độ điện li α.
- Công thức: α = n/n₀ (Tỷ lệ phân tử phân li / Tổng phân tử).
- Quy tắc pha loãng Ostwald: Với chất điện li yếu, khi pha loãng dung dịch, độ điện li α sẽ TĂNG LÊN.
Ứng dụng thực tiễn: Khi sử dụng các hóa chất điện li yếu (như Axit Acetic trong dệt nhuộm), việc kiểm soát nồng độ và nhiệt độ là chìa khóa để đạt hiệu quả tối đa mà không lãng phí nguyên liệu.
Ứng Dụng Chiến Lược Trong Công Nghiệp (Cập nhật 2026)
Đây là nơi kiến thức hóa học chuyển hóa thành giá trị kinh tế.
Ngành Mạ điện & Xử lý bề mặt
Dung dịch mạ chính là môi trường chất điện li.
- Ví dụ: Dung dịch mạ đồng sử dụng Đồng Sunfat (CuSO₄).
- Ion Cu²⁺ di chuyển trong dung dịch điện li và bám vào bề mặt kim loại tại cực âm, tạo lớp mạ sáng bóng bảo vệ sản phẩm.
Công nghệ Pin & Ắc quy (Energy Storage)

Thị trường pin toàn cầu dự kiến đạt 273 tỷ USD vào năm 2027.
- Ắc quy chì-axit: Sử dụng dung dịch điện li là H₂SO₄.
- Pin Lithium-ion: Sử dụng chất điện li là muối Lithium (LiPF₆) trong dung môi hữu cơ, cho phép ion Li⁺ di chuyển giữa hai cực để nạp/xả điện.
Xử lý nước thải & Môi trường
Các chất keo tụ tạo bông như PAC (Poly Aluminium Chloride) hay Phèn nhôm bản chất là các chất điện li, khi tan vào nước sẽ tạo ra các ion kim loại đa hóa trị giúp kết dính các hạt bụi bẩn lơ lửng.
An Toàn Hóa Chất & Tuân Thủ Pháp Luật
Làm việc với chất điện li (đặc biệt là axit/bazơ mạnh) đòi hỏi sự tuân thủ nghiêm ngặt. Tại Hóa Chất Doanh Tín, mọi sản phẩm chúng tôi cung cấp đều đi kèm bộ hồ sơ pháp lý đầy đủ:
- Phiếu An toàn Hóa chất (MSDS/SDS): Cung cấp thông tin về độc tính, sơ cứu.
- Nhãn GHS: Cảnh báo nguy hiểm theo tiêu chuẩn toàn cầu.
- Tuân thủ Luật Hóa chất 2026: Đảm bảo nguồn gốc xuất xứ và quy định khai báo.
Câu Hỏi Thường Gặp (FAQ)
1. Tại sao cơ thể người cũng cần chất điện li?
Cơ thể người sử dụng các ion (Na⁺, K⁺, Ca²⁺) để dẫn truyền xung thần kinh và co cơ. Mất cân bằng điện giải (do sốt, tiêu chảy) có thể gây nguy hiểm. Đó là lý do ta cần uống Oresol.
2. Làm sao để biết một chất là điện li mạnh hay yếu?
Hãy nhớ quy tắc loại trừ: Axit mạnh (HCl, H₂SO₄, HNO₃…), Bazơ kiềm (NaOH, KOH…) và hầu hết Muối là MẠNH. Còn lại đa số là YẾU.
3. Hóa Chất Doanh Tín có cung cấp dung dịch điện li pha sẵn không?
Có. Chúng tôi cung cấp các dung dịch axit/bazơ được pha chế theo nồng độ yêu cầu của khách hàng, đảm bảo độ chính xác cao cho quy trình sản xuất.
Kết luận & Liên hệ
Từ ngọn đèn trong phòng thí nghiệm đến dây chuyền sản xuất hiện đại, Chất điện li là mắt xích không thể thiếu. Việc hiểu sâu sắc về bản chất hóa học giúp doanh nghiệp không chỉ vận hành hiệu quả mà còn đảm bảo an toàn tuyệt đối.
Nếu bạn đang tìm kiếm nguồn cung cấp các loại hóa chất điện li chất lượng cao (Axit, Bazơ, Muối công nghiệp) với đầy đủ giấy tờ pháp lý, hãy liên hệ ngay với chúng tôi.
CÔNG TY CỔ PHẨN HOÁ CHẤT DOANH TÍN
- 📍 Địa chỉ: 16 Đ.Số 7, KDC Cityland, P.7, Q.Gò Vấp, TPHCM
- 📞 Hotline tư vấn kỹ thuật (24/7): 0965 200 571
- 📧 Email: info@hoachatdoanhtin.com
- 🌐 Website: hoachatdoanhtin.com
Bài viết này thuộc bản quyền của Hóa Chất Doanh Tín. Mọi sự sao chép cần ghi rõ nguồn.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









