Kiến thức chuyên môn
3 Cách Cân Bằng Phương Trình NaCl + H₂O (Điện Phân) Chi Tiết A-Z
3 Cách Cân Bằng Phương Trình NaCl + H₂O → NaOH + Cl₂ + H₂ (Điện Phân)
Trong hóa học công nghiệp và học thuật, phản ứng điện phân dung dịch Natri Clorua (NaCl) là một trong những quá trình nền tảng. Việc cân bằng phương trình NaCl + H₂O không chỉ là một bài tập cơ bản mà còn là chìa khóa để hiểu rõ bản chất của phản ứng, tỷ lệ các chất tham gia và sản phẩm tạo thành.
Bài viết này, được biên soạn bởi các chuyên gia tại Hóa Chất Đoàn Tin, sẽ hướng dẫn bạn chi tiết 3 phương pháp cân bằng phương trình này, từ đơn giản đến nâng cao, đảm bảo ai cũng có thể thực hiện thành công.
2NaCl + 2H₂O ⟶ 2NaOH + Cl₂ + H₂
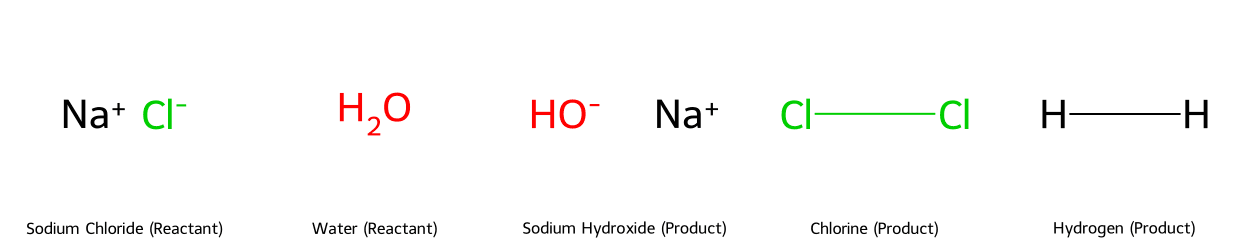
Cấu trúc các phân tử trong phản ứng
Phản ứng gồm các chất vô cơ đơn giản: Natri Clorua (NaCl) và Nước (H₂O) là chất phản ứng; tạo ra sản phẩm là Natri Hydroxit (NaOH), khí Clo (Cl₂) và khí Hydro (H₂).
Trước khi đi vào chi tiết các phương pháp cân bằng, hãy cùng xem xét cấu trúc của các phân tử tham gia phản ứng để có cái nhìn trực quan hơn.
Phương Pháp 1: Cân Bằng “Thử và Sai” (Dành cho người mới bắt đầu)
Đây là phương pháp cân bằng phương trình bằng cách điều chỉnh hệ số của các chất cho đến khi số lượng nguyên tử của mỗi nguyên tố ở hai vế phương trình bằng nhau.
Đây là phương pháp trực quan và dễ tiếp cận nhất, không đòi hỏi kiến thức sâu về phản ứng oxi hóa-khử.
- Bước 1: Viết phương trình chưa cân bằng
NaCl + H₂O → NaOH + Cl₂ + H₂ - Bước 2: Đếm số lượng nguyên tử mỗi nguyên tố ở hai vế
- Vế Trái: Na: 1, Cl: 1, H: 2, O: 1
- Vế Phải: Na: 1, O: 1, H: 3 (2 trong H₂ và 1 trong NaOH), Cl: 2
- Nhận xét: Số lượng nguyên tử Cl và H chưa bằng nhau.
- Bước 3: Bắt đầu cân bằng
Thấy vế phải có 2 Cl, ta đặt hệ số 2 trước NaCl ở vế trái:
2NaCl + H₂O → NaOH + Cl₂ + H₂
Kiểm tra lại, vế trái có 2 Na, ta đặt hệ số 2 trước NaOH (Xút):
2NaCl + H₂O → 2NaOH + Cl₂ + H₂
- Bước 4: Hoàn thành cân bằng
Lúc này, Na và Cl đã bằng nhau. Ta thấy vế phải có 4H và 2O, vế trái có 2H và 1O. Do đó, ta đặt hệ số 2 trước H₂O:
2NaCl + 2H₂O → 2NaOH + Cl₂ + H₂
Kiểm tra cuối cùng: Na (2=2), Cl (2=2), H (4=4), O (2=2). Phương trình đã được cân bằng hoàn toàn.
Phương Pháp 2: Cân Bằng Thăng Bằng Electron (Oxi Hóa – Khử)
Phương pháp này dựa trên nguyên tắc bảo toàn electron: tổng số electron mà chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
Phương pháp này chính xác và hiệu quả cho các phản ứng phức tạp, dựa trên sự thay đổi số oxi hóa của các nguyên tố.
- Bước 1: Xác định sự thay đổi số oxi hóa
- 2Cl⁻¹ → Cl₂⁰ + 2e⁻ (Quá trình oxi hóa)
- 2H₂⁺¹O + 2e⁻ → H₂⁰ + 2OH⁻ (Quá trình khử)
- Bước 2: Viết các bán phản ứng tại điện cực
- Tại Anot (+): Xảy ra sự oxi hóa ion Cl⁻ tạo thành khí Clo (Cl₂).
2Cl⁻ → Cl₂ + 2e⁻
- Tại Catot (-): Xảy ra sự khử phân tử H₂O tạo thành khí Hydro (H₂) và ion OH⁻.
2H₂O + 2e⁻ → H₂ + 2OH⁻
- Tại Anot (+): Xảy ra sự oxi hóa ion Cl⁻ tạo thành khí Clo (Cl₂).
- Bước 3: Cân bằng electron và tổ hợp phương trình
Số electron nhường (2e⁻) bằng số electron nhận (2e⁻) nên ta tổ hợp hai bán phản ứng, thêm các ion Na⁺ vào để tạo thành phương trình phân tử hoàn chỉnh:
2NaCl + 2H₂O → 2NaOH + Cl₂ + H₂
Phương Pháp 3: Khi Chỉ Hòa Tan (Không Phải Phản Ứng)
Khi hòa tan muối ăn (NaCl) vào nước mà không có dòng điện, đây là một quá trình vật lý, không phải phản ứng hóa học, do đó không cần cân bằng.
Cần phân biệt rõ giữa việc hòa tan và phản ứng điện phân. Nếu bạn chỉ cho muối ăn (NaCl) vào nước mà không có tác động của dòng điện, sẽ chỉ xảy ra hiện tượng hòa tan vật lý. Phương trình biểu diễn là:
NaCl(rắn) + H₂O(lỏng) → NaCl(dung dịch)
So Sánh Các Phương Pháp
| Phương Pháp | Ưu Điểm | Nhược Điểm |
|---|---|---|
| Thử và Sai | Đơn giản, trực quan, không cần kiến thức chuyên sâu. | Có thể mất thời gian và dễ nhầm lẫn với phương trình phức tạp. |
| Thăng Bằng Electron | Chính xác tuyệt đối, hiệu quả cho mọi phản ứng oxi hóa-khử. | Đòi hỏi kiến thức về xác định số oxi hóa và viết bán phản ứng. |
| Hòa Tan | Nhanh chóng, áp dụng khi không có phản ứng hóa học. | Không thể dùng cho phản ứng điện phân. |
Lưu Ý Quan Trọng Về Phản Ứng và An Toàn
Trả lời ngắn: Phản ứng này yêu cầu có dòng điện một chiều và màng ngăn giữa hai điện cực. Cần tuân thủ nghiêm ngặt quy định an toàn vì sản phẩm khí Clo (Cl₂) là chất độc.
- Điều Kiện Phản Ứng: Phản ứng này chỉ xảy ra khi có dòng điện một chiều chạy qua dung dịch, gọi là quá trình điện phân dung dịch. Cần phải có màng ngăn giữa hai điện cực để ngăn sản phẩm NaOH và Cl₂ tác dụng với nhau.
- An Toàn Hóa Chất: Khí Clo (Cl₂) là một chất khí độc. Quá trình điện phân phải được thực hiện trong môi trường thông thoáng hoặc hệ thống kín, tuân thủ nghiêm ngặt các quy định về an toàn hóa chất.
- Sản Phẩm: Sản phẩm chính của quá trình này là Xút (NaOH), một trong những hóa chất công nghiệp quan trọng nhất. Hóa Chất Đoàn Tin là nhà cung cấp uy tín các sản phẩm xút chất lượng cao như Xút vảy Đài Loan 98% và Xút lỏng 32-50%.
Câu Hỏi Thường Gặp (FAQs)
Tại sao phải dùng “điện phân dung dịch có màng ngăn”?
Để ngăn khí Cl₂ và dung dịch NaOH vừa tạo thành phản ứng với nhau, gây thất thoát sản phẩm chính và tạo ra sản phẩm phụ không mong muốn (nước Javen).
Màng ngăn có tác dụng cho các ion di chuyển qua nhưng ngăn cách các sản phẩm khí Cl₂ (sinh ra ở anot) và dung dịch NaOH (sinh ra ở catot). Nếu không có màng ngăn, chúng sẽ phản ứng với nhau tạo thành nước Javen (hỗn hợp NaCl và NaClO), làm giảm hiệu suất thu NaOH tinh khiết.
Sai lầm phổ biến nhất khi cân bằng phương trình này là gì?
Sai lầm phổ biến nhất là quên đặt hệ số 2 cho H₂O sau khi đã cân bằng Na và Cl, dẫn đến số nguyên tử H và O không bằng nhau ở hai vế.
Nhiều người thường dừng lại sau khi cân bằng NaCl và NaOH, dẫn đến phương trình sai: 2NaCl + H₂O → 2NaOH + Cl₂ + H₂. Cách tốt nhất để tránh sai sót là luôn thực hiện bước kiểm tra cuối cùng, đếm lại số lượng nguyên tử của tất cả các nguyên tố sau khi đã đặt hệ số.
Ứng dụng thực tế của phản ứng điện phân NaCl là gì?
Đây là quy trình công nghiệp quan trọng để sản xuất đồng thời hai hóa chất nền tảng là Xút (NaOH) và khí Clo (Cl₂), phục vụ cho nhiều ngành công nghiệp khác nhau.
Đây là phương pháp chính trong công nghiệp (quy trình Clo-Kiềm) để sản xuất đồng thời Xút và Clo. Xút được dùng trong sản xuất giấy, dệt nhuộm, xà phòng, xử lý nước… trong khi Clo được dùng để khử trùng nước, sản xuất nhựa PVC và nhiều loại hóa chất khác.
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn toàn diện và dễ hiểu về cách cân bằng phương trình điện phân dung dịch NaCl. Nếu bạn có nhu cầu về các loại hóa chất công nghiệp, đặc biệt là các sản phẩm Xút, hãy liên hệ với Hóa Chất Đoàn Tin để được tư vấn và nhận báo giá tốt nhất.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









