Kiến thức chuyên môn
Axit Sunfuric là gì? Tính Chất, Ứng Dụng H2SO4
Axit Sunfuric, với công thức hóa học là H₂SO₄, là một trong những hóa chất công nghiệp quan trọng và được sản xuất nhiều nhất trên thế giới, mệnh danh là “vua của các loại hóa chất”. Đây là một axit vô cơ mạnh, tồn tại ở dạng chất lỏng sánh như dầu, không màu, không mùi và tan vô hạn trong nước.
Bài viết này sẽ cung cấp một cái nhìn tổng quan chi tiết, cập nhật đến năm 2025, về định nghĩa, 5 tính chất hóa học đặc trưng, quy trình sản xuất, các ứng dụng then chốt và những lưu ý an toàn tuyệt đối khi sử dụng H₂SO₄.

Axit Sunfuric là gì?
Axit Sunfuric (Sulfuric Acid) là một axit vô cơ mạnh có công thức hóa học H₂SO₄. Đây là một chất lỏng sánh, không màu, không mùi, tan hoàn toàn trong nước và là một trong những hóa chất công nghiệp được sản xuất và sử dụng nhiều nhất trên thế giới.
Axit Sunfuric (tên tiếng Anh: Sulfuric Acid) là một hợp chất vô cơ có công thức phân tử H₂SO₄. Hợp chất này bao gồm các nguyên tố hydro, lưu huỳnh và oxy. Ở dạng tinh khiết 98%, nó là một chất lỏng sánh, không màu, không bay hơi, có khả năng hòa tan trong nước theo bất kỳ tỷ lệ nào và tỏa ra một lượng nhiệt lớn.
Do vai trò nền tảng trong vô số quy trình công nghiệp, từ sản xuất phân bón đến luyện kim, H₂SO₄ được xem là một chỉ số quan trọng để đánh giá năng lực công nghiệp của một quốc gia.
Cấu trúc phân tử của Axit Sunfuric (H₂SO₄)
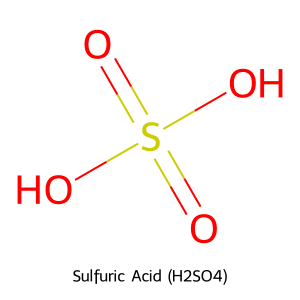
Phân tử Axit Sunfuric (H₂SO₄) có cấu trúc tứ diện, với một nguyên tử Lưu huỳnh (S) ở trung tâm. Nguyên tử này liên kết với hai nguyên tử Oxy (O) bằng liên kết đôi và liên kết với hai nhóm Hydroxyl (-OH) bằng liên kết đơn.
Để hiểu rõ các tính chất của H₂SO₄, việc xem xét cấu trúc phân tử của nó là rất quan trọng. Phân tử H₂SO₄ có nguyên tử lưu huỳnh (S) ở trung tâm, liên kết với hai nguyên tử oxy (O) bằng liên kết đôi và liên kết với hai nhóm hydroxyl (-OH) bằng liên kết đơn.
5 Tính chất vật lý và hóa học chính
5 tính chất chính của Axit Sunfuric bao gồm: (1) Tính axit cực mạnh, (2) Tính háo nước và hút ẩm mãnh liệt, (3) Tính oxy hóa mạnh (đặc biệt khi đặc, nóng), (4) Khả năng gây ăn mòn cao, và (5) Tỏa nhiệt lớn khi pha loãng với nước.
Axit sunfuric đặc trưng bởi 5 tính chất nổi bật sau:
Tính axit cực mạnh
H₂SO₄ là một axit mạnh, phân ly hoàn toàn trong nước ở nấc đầu tiên, làm quỳ tím hóa đỏ và phản ứng mãnh liệt với bazơ, oxit kim loại và nhiều loại muối để tạo thành muối sunfat.
H₂SO₄ là một diprotic acid (axit hai nấc) và là một trong những axit mạnh nhất. Khi hòa tan trong nước, nó phân ly hoàn toàn ở nấc đầu tiên để tạo thành ion hydronium (H₃O⁺) và hydrogensulfate (HSO₄⁻).
Phản ứng: H₂SO₄ + H₂O ⟶ H₃O⁺ + HSO₄⁻
Do tính axit mạnh, nó làm đổi màu giấy quỳ tím thành màu đỏ và phản ứng mạnh với bazơ, oxit bazơ và nhiều muối.
Tính háo nước và hút ẩm mãnh liệt
Axit sunfuric đặc có ái lực cực lớn với nước, hoạt động như một chất hút ẩm và khử nước mạnh. Nó có thể lấy nước từ các hợp chất hữu cơ, ví dụ như hóa than đường saccarozơ.
Axit sunfuric đặc có ái lực rất lớn với nước. Nó không chỉ hút ẩm mạnh trong không khí mà còn có khả năng “lấy” nước từ các hợp chất hữu cơ khác.
Ví dụ điển hình là khi cho H₂SO₄ đặc vào đường saccarozơ (C₁₂H₂₂O₁₁), nó sẽ lấy đi các phân tử nước, chỉ để lại carbon màu đen và tỏa nhiều nhiệt.
Phản ứng: C₁₂H₂₂O₁₁ (rắn) –(H₂SO₄ đặc)--> 12C (rắn) + 11H₂O (hơi)
Cảnh báo: Phản ứng hòa tan H₂SO₄ vào nước tỏa ra một lượng nhiệt cực lớn. Luôn luôn đổ từ từ axit vào nước và không bao giờ làm ngược lại để tránh nước sôi đột ngột và bắn axit ra ngoài gây nguy hiểm.
Tính oxy hóa mạnh
Axit sunfuric đặc, nóng là một chất oxy hóa rất mạnh, có khả năng oxy hóa hầu hết kim loại (trừ vàng, bạch kim) và nhiều phi kim, thường giải phóng khí SO₂ thay vì H₂.
Axit sunfuric đặc, nóng là một chất oxy hóa rất mạnh. Nó có thể oxy hóa hầu hết các kim loại (trừ Au, Pt) và nhiều phi kim.
- Với kim loại: Khi phản ứng với các kim loại như đồng (Cu) hoặc sắt (Fe), H₂SO₄ đặc không giải phóng khí H₂ như các axit loãng mà tạo ra khí Lưu huỳnh đioxit (SO₂), nước và muối sunfat.
Phản ứng: Cu + 2H₂SO₄ (đặc) ⟶ CuSO₄ + SO₂ + 2H₂O - Với phi kim: Nó có thể oxy hóa phi kim như carbon (C) và lưu huỳnh (S).
Phản ứng: C + 2H₂SO₄ (đặc) ⟶ CO₂ + 2SO₂ + 2H₂O - Một phản ứng đặc trưng thể hiện tính oxy hóa mạnh là tương tác với FeSO₄ và KMnO₄, một chủ đề quan trọng trong hóa học phân tích. Bạn có thể tìm hiểu sâu hơn về phản ứng FeSO₄ + KMnO₄ + H₂SO₄.
Cách sản xuất Axit Sunfuric trong công nghiệp
Axit sunfuric công nghiệp được sản xuất chủ yếu bằng phương pháp tiếp xúc (Contact Process), bao gồm 4 giai đoạn: (1) Tạo khí SO₂, (2) Oxy hóa SO₂ thành SO₃, (3) Hấp thụ SO₃ bằng H₂SO₄ đặc để tạo Oleum, (4) Pha loãng Oleum thành H₂SO₄.
Hiện nay, hơn 90% lượng Axit Sunfuric trên thế giới được sản xuất bằng phương pháp tiếp xúc (Contact Process), bao gồm 4 giai đoạn chính:
- Đốt cháy Lưu huỳnh (S) hoặc quặng pirit (FeS₂): Mục đích là tạo ra khí lưu huỳnh đioxit (SO₂).
S + O₂ ⟶ SO₂ - Oxy hóa SO₂ thành SO₃: SO₂ được oxy hóa bởi oxy không khí ở nhiệt độ cao (450°C) và có chất xúc tác là V₂O₅ để tạo ra lưu huỳnh trioxit (SO₃).
2SO₂ + O₂ ⇌ 2SO₃ - Hấp thụ SO₃: SO₃ được hấp thụ bằng H₂SO₄ 98% để tạo ra một hợp chất gọi là Oleum (H₂SO₄.nSO₃). Không dùng nước để hấp thụ trực tiếp vì sẽ tạo ra sương mù axit khó ngưng tụ.
H₂SO₄ + nSO₃ ⟶ H₂SO₄.nSO₃ - Pha loãng Oleum: Dùng nước để pha loãng Oleum thành Axit Sunfuric đậm đặc với nồng độ mong muốn.
H₂SO₄.nSO₃ + nH₂O ⟶ (n+1)H₂SO₄
Các ứng dụng quan trọng của Axit Sunfuric
Ứng dụng lớn nhất của Axit Sunfuric (chiếm ~60%) là trong sản xuất phân bón, đặc biệt là axit photphoric để làm phân lân. Các ứng dụng quan trọng khác bao gồm luyện kim, sản xuất hóa chất, xử lý nước thải, lọc dầu và làm chất điện li trong ắc quy.
H₂SO₄ có mặt trong hầu hết các ngành công nghiệp:
- Sản xuất phân bón (chiếm 60%): Là ứng dụng lớn nhất, chủ yếu để sản xuất axit photphoric (H₃PO₄), thành phần chính của các loại phân lân và supephotphat.
- Luyện kim: Dùng để tẩy gỉ bề mặt kim loại (sắt, thép) trước khi mạ hoặc sơn.
- Sản xuất hóa chất: Dùng để sản xuất các axit khác (như HCl, HNO₃), thuốc nổ, thuốc nhuộm, sợi tổng hợp và chất tẩy rửa.
- Xử lý nước thải: Giúp điều chỉnh độ pH và loại bỏ các tạp chất.
- Lọc dầu: Loại bỏ các hợp chất không mong muốn khỏi xăng và dầu hỏa.
- Sản xuất ắc quy: Axit Sunfuric loãng được dùng làm chất điện li trong ắc quy axit-chì.
Hướng dẫn an toàn khi sử dụng Axit Sunfuric
An toàn khi dùng H₂SO₄ đòi hỏi phải trang bị đầy đủ đồ bảo hộ (PPE), làm việc nơi thông thoáng, và quan trọng nhất là: LUÔN LUÔN đổ từ từ axit vào nước khi pha loãng, không bao giờ làm ngược lại.
Axit Sunfuric là hóa chất cực kỳ nguy hiểm, có tính ăn mòn cao. Việc tuân thủ các quy tắc an toàn là bắt buộc:

- Trang bị bảo hộ cá nhân (PPE): Luôn đeo kính bảo hộ, găng tay chống axit, quần áo bảo hộ và mặt nạ phòng độc khi làm việc.
- Pha loãng đúng cách: LUÔN LUÔN đổ từ từ axit vào nước, khuấy đều. TUYỆT ĐỐI KHÔNG làm ngược lại.
- Thông gió: Làm việc ở khu vực thông thoáng để tránh hít phải hơi axit.
- Lưu trữ: Bảo quản trong các bồn chứa chuyên dụng, đặt xa các chất bazơ, chất hữu cơ và kim loại.
- Sơ cứu: Nếu bị dính axit vào da, ngay lập tức rửa dưới vòi nước chảy liên tục trong ít nhất 15-20 phút và tìm đến cơ sở y tế gần nhất.
So sánh Axit Sunfuric với các axit thông dụng khác
So với các axit mạnh khác như Axit Nitric (HNO₃) và Axit Hydrochloric (HCl), Axit Sunfuric (H₂SO₄) nổi bật với tính háo nước, không bay hơi và vai trò không thể thay thế trong ngành sản xuất phân bón.
| Axit | Công thức | Tính axit | Ứng dụng chính | Mức độ an toàn |
|---|---|---|---|---|
| Sunfuric | H₂SO₄ | Rất mạnh, diprotic | Phân bón, luyện kim | Ăn mòn cao, hút nước mạnh |
| Nitric | HNO₃ | Mạnh | Thuốc nổ, phân đạm | Oxy hóa rất mạnh |
| Hydrochloric | HCl | Mạnh | Tẩy rửa kim loại, xử lý da | Gây bỏng, khí độc |
| Acetic | CH₃COOH | Yếu | Thực phẩm (giấm ăn) | Tương đối an toàn |
| Phosphoric | H₃PO₄ | Trung bình | Phân bón, thực phẩm | Ít ăn mòn hơn |
Mua Axit Sunfuric (H₂SO₄) ở đâu uy tín?
Để mua Axit Sunfuric uy tín, cần tìm đến các nhà cung cấp chuyên nghiệp có thể cung cấp đầy đủ chứng từ chất lượng như COA (Certificate of Analysis). Đoàn Tín Chem là một lựa chọn đáng tin cậy, chuyên cung cấp H₂SO₄ với chất lượng đảm bảo và giá cả cạnh tranh.
Để đảm bảo chất lượng và an toàn, việc lựa chọn nhà cung cấp uy tín là vô cùng quan trọng. Một nhà cung cấp chuyên nghiệp phải cung cấp đầy đủ giấy tờ như COA (Certificate of Analysis) để chứng minh nguồn gốc và chất lượng sản phẩm.
Tại Hóa Chất Doanh Tín, chúng tôi tự hào là đơn vị chuyên cung cấp các loại hóa chất công nghiệp, bao gồm Axit Sunfuric (H₂SO₄) 10-98% với chất lượng được kiểm định nghiêm ngặt và giá cả cạnh tranh. Nếu bạn đang tìm kiếm một cửa hàng hóa chất gần đây, hãy liên hệ với chúng tôi để được tư vấn và nhận báo giá tốt nhất.
Câu hỏi thường gặp (FAQs)
Axit sunfuric có độc không?
Có, H₂SO₄ cực kỳ độc và nguy hiểm. Nó gây bỏng nặng khi tiếp xúc với da, phá hủy đường hô hấp nếu hít phải và có thể gây tử vong nếu nuốt phải.
Làm thế nào để pha loãng axit sunfuric an toàn?
Cách duy nhất là rót từ từ axit vào nước và khuấy nhẹ. Không bao giờ đổ nước vào axit.
Ứng dụng chính của H₂SO₄ là gì?
Khoảng 60% sản lượng H₂SO₄ toàn cầu được dùng để sản xuất phân bón, đặc biệt là phân lân.
Giá Axit Sunfuric 2025 dự báo thế nào?
Thị trường hóa chất dự báo giá Axit Sunfuric sẽ duy trì ổn định, có thể tăng nhẹ khoảng 3-5% trong năm 2025 do nhu cầu từ các ngành nông nghiệp và công nghiệp.
Tính chất vật lý đặc trưng của H₂SO₄ là gì?
Là chất lỏng sánh như dầu, không màu, không mùi, nặng hơn nước (khối lượng riêng khoảng 1.84 g/cm³), và tan vô hạn trong nước.
Bài viết được tổng hợp và tham khảo từ các nguồn uy tín như PubChem, Wikipedia và được rà soát bởi các chuyên gia hóa học. Thông tin chỉ mang tính chất tham khảo, vui lòng tuân thủ nghiêm ngặt các hướng dẫn an toàn hóa chất khi sử dụng.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →











