Kiến thức chuyên môn
Axit Pecloric (HClO₄) là gì? Chuyên Gia Doanh Tín Giải Đáp
Bạn đang tìm kiếm thông tin kỹ thuật chính xác về Axit Pecloric (HClO₄)? Trong ngành hóa chất công nghiệp, việc hiểu rõ bản chất, ứng dụng và đặc biệt là các rủi ro tiềm ẩn của một “siêu axit” như HClO₄ là yếu tố sống còn, quyết định đến hiệu quả sản xuất và an toàn lao động. Với kinh nghiệm chuyên sâu trong ngành, Hóa Chất Doanh Tín sẽ cung cấp một góc nhìn toàn diện, vượt xa những định nghĩa thông thường.
Bài viết này sẽ đi sâu vào các khía cạnh kỹ thuật, so sánh trực quan và cung cấp những khuyến nghị an toàn theo tiêu chuẩn Việt Nam, giúp bạn tự tin ứng dụng và quản lý hóa chất này một cách hiệu quả nhất.

1. Axit Pecloric (HClO₄) là gì và định nghĩa chuyên môn của nó ra sao?
Axit Pecloric (HClO₄) là một siêu axit khoáng, một trong những loại mạnh nhất được biết đến. Nó thường được sử dụng ở dạng dung dịch nước 70-72% để đảm bảo tính ổn định, vì dạng khan nguyên chất của nó cực kỳ không ổn định và có nguy cơ gây nổ cao.
Axit Pecloric, với công thức hóa học là HClO₄, là một oxoaxit của clo. Ở dạng tinh khiết (khan), nó là một chất lỏng không màu, linh động. Vì lý do an toàn, trong thực tế thương mại và phòng thí nghiệm, Axit Pecloric thường được cung cấp và sử dụng dưới dạng dung dịch nước, phổ biến nhất là hỗn hợp đẳng phí chứa khoảng 70-72% HClO₄. Ở nồng độ này, nó ổn định hơn nhiều và không có nguy cơ tự nổ ở nhiệt độ phòng.
Công thức cấu tạo và Anion Peclorat (ClO₄⁻) có gì đặc biệt?
Sức mạnh vượt trội của HClO₄ đến từ cấu trúc tứ diện hoàn hảo của anion peclorat (ClO₄⁻), cho phép điện tích âm được giải tỏa đều, làm cho anion này rất bền vững và khó nhận lại proton (H⁺), từ đó định nghĩa nên một axit cực mạnh.
Đây chính là chìa khóa làm nên tính siêu axit của hợp chất này. Nguyên tử Clo nằm ở trung tâm và được bao quanh bởi bốn nguyên tử Oxy. Cấu trúc đối xứng này giúp phân tán đều điện tích âm, tạo ra một anion có độ bền cao và ái lực thấp với proton.
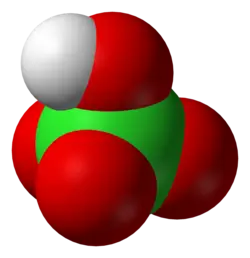 Sơ đồ cấu trúc 3D của anion Peclorat ClO4-.
Sơ đồ cấu trúc 3D của anion Peclorat ClO4-.
2. Các tính chất lý hóa nổi bật của Axit Pecloric là gì?
Axit Pecloric nổi bật với hai đặc tính chính: là một siêu axit có độ phân ly gần như hoàn toàn trong nước, và là một chất oxy hóa cực mạnh, đặc biệt khi ở nồng độ cao và được đun nóng.
Hiểu rõ các thông số kỹ thuật là bước đầu tiên để làm chủ hóa chất này trong ứng dụng thực tế. Dưới đây là các tính chất quan trọng nhất.
Những tính chất vật lý quan trọng của Axit Pecloric là gì?
| Thuộc tính | Giá trị (cho dung dịch 70%) | Lưu ý Kỹ thuật |
|---|---|---|
| Khối lượng mol | 100.46 g/mol | Áp dụng cho phân tử HClO₄ |
| Ngoại quan | Chất lỏng không màu, không mùi | Có thể hơi nhớt hơn nước |
| Khối lượng riêng | ≈ 1.67 g/cm³ | Nặng hơn nước đáng kể |
| Điểm sôi | ≈ 203 °C | Là điểm sôi của hỗn hợp đẳng phí |
| Độ hòa tan | Tan hoàn toàn trong nước | Quá trình hòa tan tỏa nhiều nhiệt |
Các tính chất hóa học đặc trưng của Axit Pecloric là gì?
Tính Siêu Axit: HClO₄ phân ly gần như hoàn toàn trong nước. So với các axit mạnh thông thường, nó có chỉ số pKa cực thấp (ước tính từ -8 đến -10), khẳng định vị thế là một trong những axit mạnh nhất. Phương trình phân ly: HClO₄ + H₂O → H₃O⁺ + ClO₄⁻
Tính Oxy Hóa Mạnh: Đây là đặc tính quan trọng thứ hai. Mặc dù ở nhiệt độ phòng và nồng độ loãng, tính oxy hóa của nó khá yếu, nhưng khi đun nóng và ở nồng độ đặc (>70%), HClO₄ trở thành một chất oxy hóa cực kỳ mạnh. Nó có thể oxy hóa hầu hết các kim loại và phá hủy các hợp chất hữu cơ một cách dữ dội. Ví dụ: 8Fe + 18HClO₄ (đặc, nóng) → 8Fe(ClO₄)₂ + 3Cl₂ + 9H₂O
Phản ứng với Bazơ và Oxit Bazơ: Đây là phản ứng trung hòa điển hình, tạo ra muối peclorat và nước. Đây là phương pháp chính để sản xuất các muối peclorat. Ví dụ: NaOH + HClO₄ → NaClO₄ + H₂O hoặc MgO + 2HClO₄ → Mg(ClO₄)₂ + H₂O
Góc Nhìn Chuyên Gia: Nguyễn Thị Mỹ Linh (Trưởng phòng Kỹ thuật, Hóa Chất Doanh Tín)
“Nhiều khách hàng chỉ tập trung vào tính axit của HClO₄ mà bỏ qua một đặc tính quan trọng: khả năng oxy hóa của nó phụ thuộc rất nhiều vào nhiệt độ. Ở nhiệt độ phòng, nó hoạt động như một axit mạnh thuần túy. Nhưng chỉ cần gia nhiệt, nó sẽ biến thành một ‘cỗ máy’ oxy hóa. Đây là một ‘con dao hai lưỡi’ mà người sử dụng phải tuyệt đối nắm vững để vừa khai thác hiệu quả, vừa đảm bảo an toàn.”
3. So sánh Axit Pecloric (HClO₄) với các axit mạnh khác như thế nào?
So với Axit Sulfuric (H₂SO₄) và Axit Nitric (HNO₃), Axit Pecloric (HClO₄) có độ mạnh axit vượt trội nhất. Về tính oxy hóa, nó yếu hơn HNO₃ khi nguội nhưng lại trở nên cực kỳ mạnh khi được đun nóng, và anion ClO₄⁻ của nó ít có khả năng tạo phức nhất.
Để thấy rõ vị thế của HClO₄, việc đặt nó lên bàn cân với H₂SO₄ và HNO₃ là cần thiết. Dưới đây là bảng so sánh chi tiết, được cập nhật với các quan sát thực tiễn trong ngành tính đến năm 2025.
| Tiêu chí | Axit Pecloric (HClO₄) | Axit Sulfuric (H₂SO₄) | Axit Nitric (HNO₃) |
|---|---|---|---|
| Độ mạnh axit | Rất cao (pKa ≈ -10) | Cao (pKa₁ ≈ -3) | Cao (pKa ≈ -1.4) |
| Tính oxy hóa | Yếu khi lạnh, rất mạnh khi nóng, đặc | Mạnh, đặc biệt khi nóng | Rất mạnh ngay cả khi nguội |
| Anion tạo thành | ClO₄⁻ (ít tạo phức) | SO₄²⁻ (có thể tạo phức) | NO₃⁻ (có thể tạo phức) |
| Ứng dụng chính | Nhiên liệu tên lửa, xúc tác, phân tích | Sản xuất phân bón, hóa dầu | Sản xuất phân bón, thuốc nổ |
4. Quy trình điều chế Axit Pecloric trong công nghiệp diễn ra như thế nào?
Phương pháp sản xuất Axit Pecloric công nghiệp phổ biến nhất hiện nay dựa trên quá trình điện phân, bắt đầu từ việc oxy hóa anode dung dịch Natri Clorua để tạo ra Natri Peclorat, sau đó chuyển đổi thành axit và cuối cùng là tinh chế bằng phương pháp chưng cất.
Việc sản xuất HClO₄ ở quy mô lớn đòi hỏi công nghệ tiên tiến và tuân thủ nghiêm ngặt các quy trình an toàn. Quá trình này gồm 3 bước chính:
- Oxy hóa Anode: Dung dịch Natri Clorua (NaCl) được điện phân để tạo ra Natri Peclorat (NaClO₄). Đây là một quá trình phức tạp, đòi hỏi điện cực đặc biệt (thường là bạch kim hoặc chì dioxide) để đạt hiệu suất cao.
- Chuyển đổi thành Axit: Dung dịch Natri Peclorat sau đó được axit hóa bằng Axit Clohydric (HCl). Phản ứng:
NaClO₄ + HCl → HClO₄ + NaCl (rắn) - Tinh Chế: Muối Natri Clorua (NaCl) ít tan trong hỗn hợp sẽ kết tủa và được lọc bỏ. Dung dịch Axit Pecloric thô sau đó được chưng cất để thu được dung dịch đẳng phí 70-72%.
5. Các ứng dụng thực tiễn của Axit Pecloric trong công nghiệp là gì?
Axit Pecloric có nhiều ứng dụng quan trọng, bao gồm: làm tiền chất sản xuất nhiên liệu tên lửa (Amoni Peclorat), tác nhân phá mẫu trong hóa phân tích, chất điện ly trong ngành mạ điện và làm chất xúc tác mạnh cho các phản ứng hóa hữu cơ.
Mặc dù có những rủi ro nhất định, các đặc tính độc đáo của HClO₄ làm cho nó không thể thiếu trong nhiều lĩnh vực công nghệ cao.
- Ngành Hàng không & Quốc phòng: Đây là ứng dụng quy mô lớn nhất. HClO₄ là tiền chất chính để sản xuất Amoni Peclorat (NH₄ClO₄), chất oxy hóa rắn cốt lõi trong nhiên liệu cho tên lửa đẩy, tên lửa quân sự và pháo hoa.
- Ngành Hóa Phân Tích: Trong phân tích kim loại bằng quang phổ hấp thụ nguyên tử (AAS) hoặc ICP-MS, HClO₄ được dùng để phá mẫu khoáng sản, hợp kim phức tạp. Do anion ClO₄⁻ không tạo phức, nó đảm bảo các ion kim loại tồn tại ở dạng tự do trong dung dịch, cho kết quả phân tích chính xác.
- Ngành Điện tử và Mạ điện: HClO₄ được sử dụng làm chất điện ly trong một số quy trình mạ crôm và đánh bóng điện hóa bề mặt kim loại để tạo độ bóng và sạch cao.
- Xúc Tác Trong Hóa Hữu Cơ: Với tính axit cực mạnh, nó được dùng làm chất xúc tác cho nhiều phản ứng hóa học, đặc biệt là các phản ứng ester hóa và alkyl hóa.
Case Study: Ứng Dụng HClO₄ Trong Xử Lý Bề Mặt Kim Loại Tại Việt Nam
Thách thức: Một doanh nghiệp trong khu công nghiệp tại Bình Dương cần một giải pháp đánh bóng điện hóa cho các chi tiết thép không gỉ phức tạp, yêu cầu bề mặt siêu sạch và bóng loáng để xuất khẩu sang thị trường Nhật Bản. Các dung dịch axit thông thường không đạt yêu cầu.
Giải pháp của Doanh Tín: Chúng tôi đã tư vấn và cung cấp Axit Pecloric 70% cấp độ tinh khiết cao (analytical grade), đồng thời phối hợp xây dựng một quy trình an toàn chi tiết. Dung dịch điện ly dựa trên HClO₄ đã giúp loại bỏ các lớp oxit bề mặt một cách hiệu quả mà không gây ăn mòn cục bộ.
Kết quả: Chất lượng bề mặt sản phẩm tăng 30%, tỷ lệ hàng lỗi giảm từ 5% xuống dưới 1%. Khách hàng đã ký hợp đồng cung ứng dài hạn.
6. Cần tuân thủ những hướng dẫn an toàn và quy định nào tại Việt Nam khi sử dụng Axit Pecloric?
Khi sử dụng Axit Pecloric tại Việt Nam, bắt buộc phải tuân thủ nghiêm ngặt Nghị định 113/2017/NĐ-CP, sử dụng đầy đủ đồ bảo hộ cá nhân (BHLĐ), lưu trữ riêng biệt tránh xa chất hữu cơ và nguồn nhiệt, và luôn tuân thủ quy tắc “châm từ từ axit vào nước”.
Đây là phần quan trọng nhất. Tại Hóa Chất Doanh Tín, chúng tôi nhấn mạnh rằng an toàn phải được đặt lên hàng đầu.
Các cảnh báo nguy hiểm theo hệ thống GHS là gì?
Theo hệ thống GHS (Hệ thống hài hòa toàn cầu về phân loại và ghi nhãn hóa chất), Axit Pecloric có các cảnh báo nguy hiểm chính sau:
- H271: Có thể gây cháy hoặc nổ; chất oxy hóa mạnh.
- H314: Gây bỏng da nặng và tổn thương mắt.
- H290: Có thể ăn mòn kim loại.
- H373: Gây tổn thương các cơ quan (tuyến giáp) qua phơi nhiễm kéo dài hoặc lặp lại.
Những quy tắc vàng khi sử dụng và lưu trữ Axit Pecloric là gì?
- Luôn trang bị BHLĐ đầy đủ: Kính bảo hộ hóa học, găng tay chống axit (butyl rubber), tạp dề và ủng bảo hộ. Làm việc trong tủ hút có thông gió tốt.
- Lưu trữ riêng biệt: Tuyệt đối không lưu trữ Axit Pecloric gần các chất hữu cơ (giấy, gỗ, vải), các chất dễ cháy, bột kim loại, hoặc các axit mạnh khác như Axit Sulfuric.
- Tránh xa nguồn nhiệt: Kho chứa phải khô ráo, thoáng mát, tránh ánh nắng trực tiếp và các nguồn gây cháy.
- Thao tác pha loãng: Luôn luôn châm từ từ axit vào nước, không bao giờ làm ngược lại, và thực hiện trong bể làm mát để kiểm soát phản ứng tỏa nhiệt.
- Tuân thủ quy định Việt Nam: Việc lưu trữ, vận chuyển và sử dụng HClO₄ phải tuân thủ Luật Hóa chất và các quy chuẩn kỹ thuật quốc gia (TCVN) về an toàn hóa chất.
Những vật liệu nào tương thích và không tương thích với Axit Pecloric?
| Vật liệu | Tương thích với HClO₄ 70%? | Ghi chú |
|---|---|---|
| Thép không gỉ 316L | Có (ở nhiệt độ phòng) | Có thể bị ăn mòn khi nóng |
| Thủy tinh Borosilicate | Rất tốt | Vật liệu phổ biến cho dụng cụ PTN |
| PVC, PP | Kém | Bị oxy hóa và phá hủy nhanh chóng |
| PTFE (Teflon) | Rất tốt | Lựa chọn tốt nhất cho gioăng, ống |
| Gỗ, Giấy, Vải | Cực kỳ nguy hiểm | Gây cháy khi tiếp xúc |
Tải Về Ngay: Sổ Tay An Toàn Khi Sử Dụng Axit Pecloric (PDF)
Để hỗ trợ khách hàng tốt nhất, Doanh Tín đã biên soạn một tài liệu PDF chi tiết về các quy trình thao tác, xử lý sự cố và sơ cứu khẩn cấp khi làm việc với HClO₄.
7. Các câu hỏi thường gặp (FAQ) về Axit Pecloric là gì?
1. Tại sao không nên sử dụng Axit Pecloric dạng khan?
Không nên sử dụng Axit Pecloric dạng khan (100%) vì nó cực kỳ không ổn định, nhạy cảm với va đập và nhiệt độ, có thể tự phân hủy và gây nổ dữ dội. Dung dịch 70-72% là dạng ổn định và an toàn hơn nhiều cho các ứng dụng thực tế.
2. Làm thế nào để xử lý khi bị Axit Pecloric đổ ra ngoài?
Khi Axit Pecloric bị đổ, cần ngay lập tức cô lập khu vực, dùng vật liệu trơ (cát, đất) để thấm hút, tuyệt đối không dùng vật liệu hữu cơ (mùn cưa, vải). Sau đó, trung hòa từ từ bằng dung dịch natri bicarbonate (NaHCO₃) loãng và rửa sạch với nhiều nước.
3. Axit Pecloric có phải là hóa chất bị cấm ở Việt Nam không?
Không. Axit Pecloric không bị cấm nhưng được xếp vào danh mục hóa chất sản xuất, kinh doanh có điều kiện và hóa chất nguy hiểm cần khai báo theo Nghị định 113/2017/NĐ-CP, đòi hỏi phải tuân thủ nghiêm ngặt các quy định về an toàn.
Kết Luận: Tại sao việc lựa chọn đối tác cung cấp Axit Pecloric uy tín lại quan trọng?
Axit Pecloric (HClO₄) là một công cụ hóa học mạnh mẽ nhưng cũng tiềm ẩn nhiều rủi ro. Việc hiểu sâu sắc về bản chất của nó, từ cấu trúc phân tử đến các ứng dụng công nghiệp và quy trình an toàn, là chìa khóa để khai thác tối đa tiềm năng và giảm thiểu nguy hiểm.
Tại Hóa Chất Doanh Tín, chúng tôi không chỉ cung cấp sản phẩm đạt chuẩn chất lượng từ các nhà sản xuất hàng đầu như Sigma-Aldrich, mà còn mang đến sự an tâm thông qua dịch vụ tư vấn kỹ thuật chuyên sâu và cam kết tuân thủ các tiêu chuẩn an toàn cao nhất.
“Hóa Chất Doanh Tín không chỉ cung cấp sản phẩm đúng hẹn mà còn tư vấn rất kỹ về mặt kỹ thuật và an toàn, giúp đội ngũ của chúng tôi vận hành hiệu quả hơn.”
– Ông Trần Văn Nam, Trưởng phòng Sản xuất, Công ty CP Cơ khí Chính xác Việt Hưng.
Nếu bạn có nhu cầu về Axit Pecloric hoặc cần tư vấn kỹ thuật chi tiết hơn, hãy liên hệ ngay với đội ngũ chuyên gia của chúng tôi thông qua trang cửa hàng hóa chất đa dạng của chúng tôi tại đây.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










