Kiến thức chuyên môn
Axit Nitric (HNO3): Tính chất, điều chế và ứng dụng chi tiết
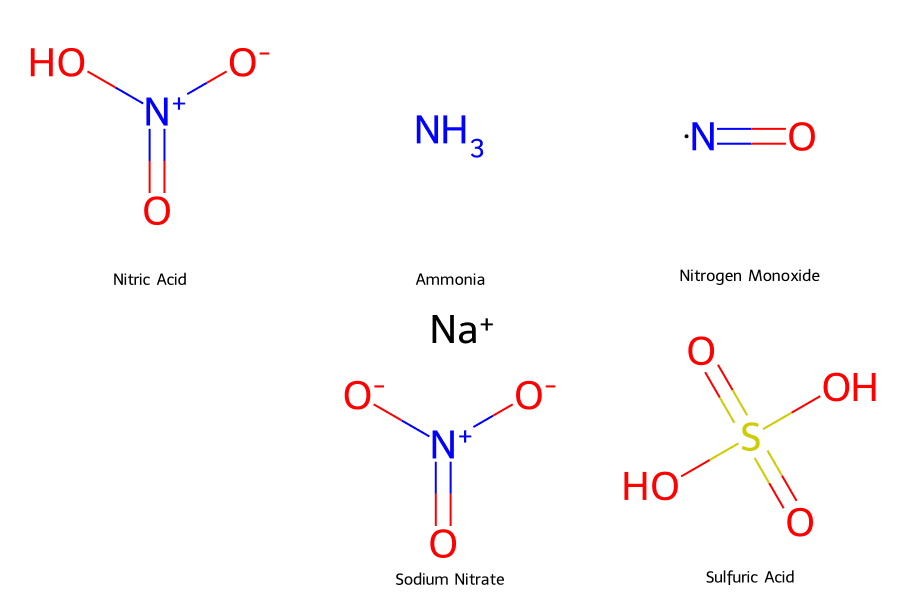
Axit Nitric (Công thức hóa học: HNO₃) không chỉ là một hóa chất thông thường; nó là “xương sống” của ngành công nghiệp hóa chất hiện đại. Ở dạng tinh khiết, nó là một chất lỏng không màu, bốc khói mạnh trong không khí ẩm và sở hữu các đặc tính oxy hóa cực mạnh.
Với vai trò không thể thiếu trong sản xuất phân bón hóa học, thuốc nổ, và tinh chế kim loại, việc hiểu rõ về HNO₃ là cực kỳ cần thiết. Bài viết này cung cấp cái nhìn toàn diện về Axit Nitric: từ tính chất lý hóa, quy trình sản xuất Ostwald, ứng dụng thực tiễn cho đến hướng dẫn an toàn chuẩn HSE năm 2025.
Mục Lục Bài Viết:
1. Tính Chất Vật Lý Và Hóa Học Của Axit Nitric
💡 Tóm tắt chuyên gia: HNO₃ là axit vô cơ mạnh, dễ tan trong nước, dễ bay hơi và có khả năng ăn mòn hầu hết các kim loại. Về mặt vật lý, nó là chất lỏng không màu, nặng hơn nước và sôi ở 83°C.
1.1. Tính Chất Vật Lý (Chi Tiết)
Dưới đây là bảng thông số kỹ thuật chuẩn của Axit Nitric để bạn dễ dàng tra cứu:
| Đặc tính | Mô tả kỹ thuật |
|---|---|
| Trạng thái & Màu sắc | Chất lỏng không màu (tinh khiết). Hóa vàng nhạt khi để lâu do phân hủy thành khí Nitrogen Dioxide (NO₂). |
| Khối lượng riêng | ~1.51 g/cm³ (đậm đặc). Nặng hơn nước. |
| Nhiệt độ sôi | 83°C (tinh khiết). Hỗn hợp đẳng phí (Azeotrope) 68% sôi ở 120.5°C. |
| Độ tan | Tan vô hạn trong nước, tỏa nhiệt mạnh. Là chất điện li mạnh. |
| Đặc tính khác | Hút ẩm mạnh, bốc khói trắng trong không khí ẩm. |
1.2. Tính Chất Hóa Học
- 🧪 Tính Axit Mạnh: Là một monoaxit (pKa ≈ -1.3), phân ly hoàn toàn trong nước tạo thành ion H⁺ và ion nitrat (NO₃⁻). Làm quỳ tím hóa đỏ.
- 🔥 Tính Oxy Hóa Cực Mạnh (Quan trọng nhất):
HNO₃ phản ứng mãnh liệt với hầu hết kim loại (trừ Vàng Au và Bạch kim Pt), không sinh ra khí Hidro mà sinh ra các sản phẩm khử của Nitơ.
Ví dụ phản ứng với Đồng (Cu):
Cu + 4HNO₃ (đặc) ⟶ Cu(NO₃)₂ (xanh) + 2NO₂ (nâu đỏ) ↑ + 2H₂O - ⚠️ Phản ứng với Phi kim: Khi đun nóng, HNO₃ đặc oxy hóa mạnh Lưu huỳnh (S), Photpho (P), Cacbon (C).
- 👑 Nước Cường Toan (Aqua Regia): Khi trộn HNO₃ với Axit Clohidric (HCl) đặc theo tỷ lệ 1:3, tạo ra dung dịch hòa tan được cả Vàng.
2. Các Phương Pháp Sản Xuất Axit Nitric
Tùy thuộc vào quy mô (công nghiệp hay thí nghiệm), chúng ta có các quy trình điều chế khác nhau.
2.1. Phương Pháp Ostwald (Sản Xuất Công Nghiệp)
Đây là công nghệ cốt lõi tạo ra hàng triệu tấn HNO₃ mỗi năm với hiệu suất 95-98%. Quá trình này chuyển hóa Amoniac (NH₃) thành Axit Nitric qua 3 giai đoạn:
 Sơ đồ quy trình Ostwald: Buồng Oxi hóa ⟶ Tháp làm lạnh ⟶ Tháp hấp thụ
Sơ đồ quy trình Ostwald: Buồng Oxi hóa ⟶ Tháp làm lạnh ⟶ Tháp hấp thụGiai đoạn 1: Oxy hóa Amoniac (850 – 900°C)
Sử dụng xúc tác lưới Platin/Rhodium:
4NH₃ + 5O₂ ⟶ 4NO + 6H₂O
Giai đoạn 2: Oxy hóa Nitric Oxide
Khí NO nguội đi và phản ứng với Oxi:
2NO + O₂ ⟶ 2NO₂ (Khí màu nâu đỏ)
Giai đoạn 3: Hấp thụ (Absorption)
NO₂ phản ứng với nước trong tháp hấp thụ:
3NO₂ + H₂O ⟶ 2HNO₃ + NO (Khí NO được tái tuần hoàn)
2.2. Phương Pháp Phòng Thí Nghiệm
Trong quy mô nhỏ, Axit Nitric được điều chế bằng phản ứng trao đổi:
NaNO₃ (tinh thể) + H₂SO₄ (đặc) ⟶ NaHSO₄ + HNO₃
Lưu ý: Phải dùng phương pháp chưng cất để thu được HNO₃ bốc hơi, vì H₂SO₄ là axit khó bay hơi.
3. Ứng Dụng Đa Dạng Trong Công Nghiệp
🌱 Sản Xuất Phân Bón (80%)
Ứng dụng lớn nhất. Dùng sản xuất Ammonium Nitrate (NH₄NO₃) – loại phân đạm quan trọng giúp cây trồng phát triển.
🧨 Thuốc Nổ & Quân Sự
Nitrat hóa các hợp chất hữu cơ để tạo ra thuốc nổ TNT (Trinitrotoluene), Nitroglycerin và thuốc súng không khói.
⚙️ Luyện Kim & Xi Mạ
Dùng để tẩy gỉ (pickling) thép không gỉ, làm sạch bề mặt trước khi mạ và tinh chế, tách vàng/bạc khỏi tạp chất.
🧪 Tổng Hợp Hữu Cơ
Tiền chất sản xuất Nitrobenzene, thuốc nhuộm vải sợi và sợi nhân tạo (Nylon, Polyurethane).
4. Lưu Ý An Toàn Tuyệt Đối & Lưu Trữ
Axit Nitric là hóa chất nguy hiểm (Dangerous Goods). Việc tuân thủ quy tắc an toàn không chỉ là quy định mà là sự sống còn.
 Bộ đồ bảo hộ PPE chuẩn khi tiếp xúc axit: Kính, Găng tay, Mặt nạ
Bộ đồ bảo hộ PPE chuẩn khi tiếp xúc axit: Kính, Găng tay, Mặt nạ4.1. Trang Bị Bảo Hộ (PPE)
- Mắt: Kính bảo hộ chống hóa chất (Goggles) + Tấm che mặt (Face Shield).
- Hô hấp: Làm việc trong tủ hút. Đeo mặt nạ phòng độc lọc khí axit (Cartridge E hoặc B) nếu nồng độ hơi cao.
- Tay: Găng tay Nitrile, Neoprene hoặc Butyl (Cao su tự nhiên bị ăn mòn nhanh).
4.2. Xử Lý Sự Cố (Emergency)
🆘 Tiếp xúc da/mắt: Rửa liên tục dưới vòi nước chảy ít nhất 15 phút. Đến ngay cơ sở y tế.
🆘 Tràn đổ:
- Cô lập khu vực.
- Trung hòa bằng Natri Bicarbonate (NaHCO₃) hoặc vôi bột.
- LƯU Ý QUAN TRỌNG: Phản ứng trung hòa với NaHCO₃ sinh khí CO₂ sủi bọt rất mạnh. Phải đổ từ từ để tránh axit bắn ngược lại người xử lý.
4.3. Lưu Trữ Đúng Cách
- Bình chứa: Thủy tinh tối màu, Nhựa HDPE, Inox 304L (cho nồng độ loãng).
- Tương thích: Tách biệt hoàn toàn với: Chất hữu cơ, Bazơ mạnh, Bột kim loại, Chất khử.
- Điều kiện: Thoáng mát, tránh ánh nắng trực tiếp (ánh nắng làm phân hủy axit sinh khí NO₂ gây nổ bình).
5. Câu Hỏi Thường Gặp (FAQ)
1. Axit Nitric có nguy hiểm không?
CÓ, rất nguy hiểm. Nó gây bỏng da tức thì, mù mắt vĩnh viễn và hơi của nó có thể gây phù phổi.
2. Mua Axit Nitric ở đâu uy tín?
Bạn nên tìm đến các đơn vị có giấy phép như Hóa Chất Doanh Tín. Chúng tôi cung cấp Axit Nitric 68% nhập khẩu chính hãng với đầy đủ MSDS.
3. Giá Axit Nitric năm 2025 là bao nhiêu?
Giá cả biến động tùy theo giá khí đốt và vận chuyển. Vui lòng liên hệ hotline để nhận báo giá xe bồn/can lẻ cập nhật mới nhất.
Cần Nguồn Hàng HNO3 Ổn Định & Giá Tốt?
Hóa Chất Doanh Tín cam kết: Hàng chuẩn nồng độ – Đủ giấy phép – Giao hàng xe bồn/can tận nơi.
📞 NHẬN BÁO GIÁ NGAY: 0965.200.571
Hỗ trợ kỹ thuật 24/7
Disclaimer: Bài viết tổng hợp kiến thức chuyên môn nhằm mục đích tham khảo. Người sử dụng bắt buộc phải tuân thủ Phiếu an toàn hóa chất (MSDS) đi kèm sản phẩm.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









