Kiến thức chuyên môn
Axit Lưỡng Tính Là Gì? Tính Chất, Các Chất Thường Gặp & Bài Tập
Trong thế giới hóa học đa dạng, Axit Lưỡng Tính là một khái niệm nền tảng nhưng vô cùng quan trọng. Chúng là những chất hóa học “hai mặt”, vừa có thể đóng vai trò là một axit, vừa có thể là một bazơ. Hiểu rõ về chúng không chỉ giúp giải quyết các bài toán hóa học phức tạp mà còn mở ra nhiều ứng dụng thực tiễn trong đời sống và sản xuất.
Bài viết này sẽ cung cấp một hướng dẫn chi tiết, toàn diện nhất năm 2025 về axit lưỡng tính, từ định nghĩa, cách nhận biết, các ví dụ phổ biến cho đến ứng dụng quan trọng của chúng.
Axit Lưỡng Tính Là Gì?
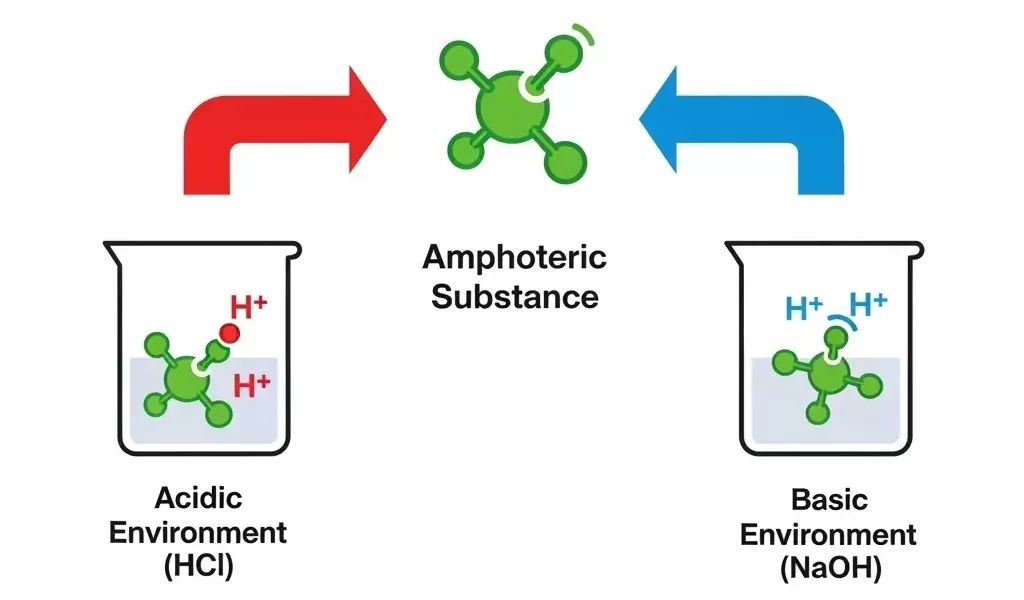
Axit lưỡng tính là chất vừa có thể phản ứng với axit (đóng vai trò bazơ), vừa có thể phản ứng với bazơ (đóng vai trò axit). Theo thuyết Bronsted-Lowry, chúng vừa có khả năng nhường, vừa có khả năng nhận proton H⁺.
Theo thuyết Bronsted-Lowry, Axit Lưỡng Tính là những chất vừa có khả năng nhường proton H⁺ (thể hiện tính axit) vừa có khả năng nhận proton H⁺ (thể hiện tính bazơ). Nói một cách đơn giản, chúng có thể phản ứng với cả axit và bazơ.
Một ví dụ điển hình là Nhôm hydroxit (Al(OH)₃):
- Khi phản ứng với axit mạnh như HCl, nó đóng vai trò là một bazơ: Al(OH)₃ + 3HCl ⟶ AlCl₃ + 3H₂O
- Khi phản ứng với bazơ mạnh như NaOH, nó lại đóng vai trò là một axit: Al(OH)₃ + NaOH ⟶ Na[Al(OH)₄]
Khả năng “thích ứng” linh hoạt này làm cho các hợp chất lưỡng tính trở nên đặc biệt trong hóa học.
Phương Pháp Nhận Biết Hợp Chất Lưỡng Tính
Để nhận biết một chất lưỡng tính, ta cho chất đó lần lượt phản ứng với dung dịch axit mạnh (như HCl) và dung dịch bazơ mạnh (như NaOH). Nếu chất đó tan hoặc phản ứng được trong cả hai dung dịch thì nó là chất lưỡng tính.
Để xác định một chất có phải là lưỡng tính hay không, phương pháp phổ biến và hiệu quả nhất là kiểm tra phản ứng của nó với cả dung dịch axit mạnh và dung dịch bazơ mạnh.
Các bước thực hiện trong phòng thí nghiệm:
- Chuẩn bị mẫu: Lấy một lượng nhỏ chất cần kiểm tra vào hai ống nghiệm riêng biệt.
- Thử với axit: Thêm vài ml dung dịch axit clohidric (HCl) vào ống nghiệm thứ nhất. Quan sát hiện tượng. Nếu chất rắn tan ra, tạo thành dung dịch trong suốt, chứng tỏ nó đã phản ứng với axit.
- Thử với bazơ: Thêm vài ml dung dịch Natri hydroxit (NaOH) vào ống nghiệm thứ hai. Nếu chất rắn cũng tan ra, chứng tỏ nó phản ứng được với bazơ.
- Kết luận: Nếu chất đó tan trong cả dung dịch axit mạnh và bazơ mạnh, ta có thể kết luận đó là một hợp chất lưỡng tính.
Trong quá trình này, việc sử dụng các chất chỉ thị như giấy quỳ tím cũng giúp xác định môi trường của dung dịch sau phản ứng để có kết luận chính xác hơn về sự thay đổi độ pH.
Các Loại Hợp Chất Lưỡng Tính Thường Gặp
Các hợp chất lưỡng tính thường gặp bao gồm các oxit và hidroxit của các kim loại như Al, Zn, Sn, Pb, Cr(III). Ví dụ điển hình là Al(OH)₃, Al₂O₃, ZnO, Zn(OH)₂, PbO, Sn(OH)₂.
Các hợp chất lưỡng tính không chỉ giới hạn ở axit mà còn bao gồm các oxit lưỡng tính và hidroxit lưỡng tính. Dưới đây là những ví dụ tiêu biểu nhất.
| Tên Hợp Chất | Công Thức Hóa Học | Phản ứng với Axit (ví dụ HCl) | Phản ứng với Bazơ (ví dụ NaOH) | Ứng Dụng Nổi Bật |
|---|---|---|---|---|
| Nhôm hydroxit | Al(OH)₃ | Al(OH)₃ + 3HCl ⟶ AlCl₃ + 3H₂O | Al(OH)₃ + NaOH ⟶ Na[Al(OH)₄] | Thuốc kháng axit dạ dày, chất keo tụ trong xử lý nước. |
| Kẽm oxit | ZnO | ZnO + 2HCl ⟶ ZnCl₂ + H₂O | ZnO + 2NaOH + H₂O ⟶ Na₂[Zn(OH)₄] | Kem chống nắng, sản xuất cao su, gốm sứ. |
| Thiếc(II) hydroxit | Sn(OH)₂ | Sn(OH)₂ + 2HCl ⟶ SnCl₂ + 2H₂O | Sn(OH)₂ + 2NaOH ⟶ Na₂[Sn(OH)₄] | Chất ổn định cho nhựa PVC, mạ điện. |
| Chì(II) oxit | PbO | PbO + 2HCl ⟶ PbCl₂ + H₂O | PbO + 2NaOH + H₂O ⟶ Na₂[Pb(OH)₄] | Sản xuất pin chì-axit, thủy tinh, gốm men. |
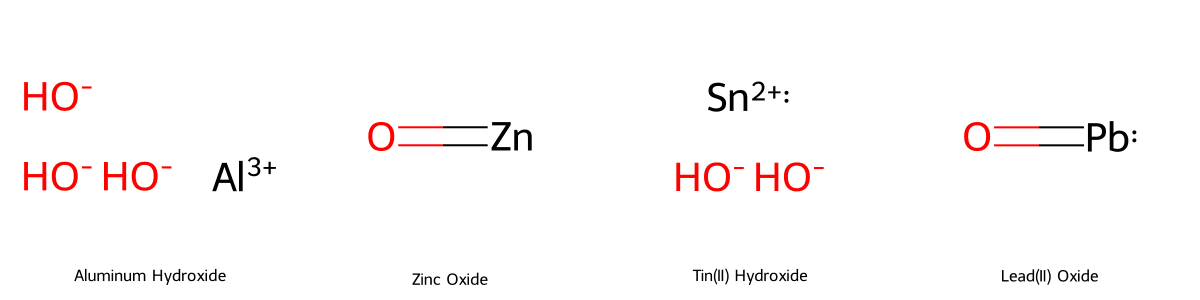
Các Vấn Đề Cần Lưu Ý Khi Làm Việc Với Axit Lưỡng Tính
Luôn phải tuân thủ các quy tắc an toàn hóa chất. Cần trang bị đầy đủ đồ bảo hộ cá nhân (kính, găng tay), làm việc ở nơi thông thoáng, và biết cách xử lý, bảo quản hóa chất ăn mòn như axit và bazơ mạnh một cách cẩn thận.
An toàn là yếu tố hàng đầu khi làm việc với hóa chất. Khi tiến hành các thí nghiệm nhận biết axit lưỡng tính, bạn cần:
- Trang bị bảo hộ: Luôn đeo kính mắt bảo hộ, găng tay và áo choàng phòng thí nghiệm.
- Môi trường làm việc: Thực hiện thí nghiệm ở nơi thông thoáng hoặc trong tủ hút khí độc để tránh hít phải hơi axit hoặc bazơ.
- Xử lý hóa chất: Các axit và bazơ mạnh như H₂SO₄ và Xút (NaOH) có tính ăn mòn cao. Cần cẩn thận khi pha loãng và sử dụng.
- Bảo quản: Cần bảo quản hóa chất lưỡng tính ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và các nguồn nhiệt để đảm bảo độ tinh khiết và ổn định.
Câu Hỏi Thường Gặp (FAQ)
1. Axit lưỡng tính và hidroxit lưỡng tính có giống nhau không?
Về cơ bản, chúng đều mô tả các hợp chất có khả năng phản ứng với cả axit và bazơ. “Hidroxit lưỡng tính” là một tập hợp con trong nhóm hợp chất lưỡng tính, dùng để chỉ cụ thể các bazơ chứa nhóm -OH có tính chất này (ví dụ Al(OH)₃, Zn(OH)₂).
2. Nước (H₂O) có phải là chất lưỡng tính không?
Có, nước là một ví dụ kinh điển về chất lưỡng tính. Nó có thể nhường proton (hoạt động như axit) để tạo thành ion OH⁻, hoặc nhận proton (hoạt động như bazơ) để tạo thành ion H₃O⁺. Tuy nhiên, nó là một chất điện li rất yếu.
3. Tại sao Al(OH)₃ được dùng trong thuốc trị đau dạ dày?
Do tính lưỡng tính, Al(OH)₃ có khả năng thực hiện phản ứng trung hòa với lượng axit HCl dư thừa trong dạ dày, giúp giảm các triệu chứng ợ nóng, khó tiêu mà không làm thay đổi drastical độ pH của môi trường.
4. Mua các hóa chất lưỡng tính ở đâu uy tín?
Để đảm bảo chất lượng và độ tinh khiết cho các ứng dụng sản xuất và thí nghiệm, bạn nên tìm đến các cửa hàng hóa chất gần đây có uy tín và kinh nghiệm lâu năm trong ngành.
Kết Luận
Axit lưỡng tính là một nhóm hợp chất quan trọng với nhiều tính chất hóa học đặc trưng và ứng dụng thực tiễn. Việc nắm vững kiến thức về chúng không chỉ giúp ích cho việc học tập mà còn là nền tảng để khám phá nhiều lĩnh vực khoa học và công nghệ khác.
Nếu bạn có nhu cầu tìm hiểu thêm hoặc cần cung cấp các loại hóa chất công nghiệp, hóa chất thí nghiệm, đừng ngần ngại liên hệ với Hóa Chất Doanh Tín để được tư vấn và hỗ trợ tốt nhất.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









