Kiến thức chuyên môn
Axit Bromhidric (HBr) là gì? Đặc điểm, điều chế và ứng dụng quan trọng
Trong thế giới hóa học phong phú, Axit Bromhidric (HBr) là một cái tên quen thuộc và giữ vai trò quan trọng trong nhiều lĩnh vực. Vậy HBr là gì? Nó có những tính chất đặc trưng nào và được ứng dụng ra sao trong công nghiệp và đời sống?
Hãy cùng Đoàn Anh đi sâu tìm hiểu về hợp chất hóa học này qua bài viết dưới đây.
Axit Bromhidric (HBr) là gì?
Axit Bromhidric (HBr) là một hợp chất vô cơ, tồn tại ở dạng khí không màu, mùi hắc. Khi hòa tan trong nước, nó tạo thành dung dịch axit bromhidric, một trong những axit vô cơ mạnh nhất, được ứng dụng rộng rãi trong tổng hợp hóa học.

Axit Bromhidric, có công thức hóa học là HBr, là một hợp chất vô cơ được tạo thành từ sự liên kết giữa nguyên tử hydro (H) và brom (Br). Ở điều kiện thường, HBr tồn tại ở dạng khí không màu, có mùi hắc rất đặc trưng.
Khi tan trong dung môi nước, HBr tạo thành dung dịch axit bromhidric, một trong những axit mạnh phổ biến nhất. Đây là một hóa chất không thể thiếu trong các phòng thí nghiệm và là nguyên liệu quan trọng cho nhiều quy trình sản xuất công nghiệp.
Những Tính Chất Vật Lý và Hóa Học Cần Biết Của HBr
Về vật lý, HBr là khí không màu, tan tốt trong nước. Về hóa học, đây là một axit rất mạnh, có tính khử (mạnh hơn HCl), có khả năng phản ứng với kim loại, bazơ, oxit bazơ và một số muối để tạo thành muối bromua.
Để hiểu rõ hơn về hợp chất này, chúng ta cần nắm vững các tính chất cơ bản của nó.
Tính chất vật lý:
- Trạng thái: Ở điều kiện thường, HBr là một chất khí không màu, có mùi hắc khó chịu.
- Nhiệt độ: Nhiệt độ sôi là -66,8°C (206.35 K) và nhiệt độ nóng chảy là -86,9°C (186.25 K).
- Độ tan: Tan rất tốt trong nước, tạo thành dung dịch axit mạnh có khả năng ăn mòn nhiều vật liệu.
- Tỷ trọng: Dạng khí có tỷ trọng khoảng 3,64 g/L.
Tính chất hóa học:
- Tính axit mạnh: HBr phân ly hoàn toàn trong nước, là một trong những axit mạnh điển hình.
HBr ⟶ H⁺ + Br⁻ - Phản ứng với bazơ: HBr dễ dàng tham gia phản ứng trung hòa khi tác dụng với bazơ, oxit bazơ, tạo thành muối và nước.Ví dụ: Phản ứng với Natri Hydroxit (NaOH):
HBr + NaOH ⟶ NaBr + H₂O - Tác dụng với kim loại: HBr phản ứng với các kim loại đứng trước Hydro trong dãy điện hóa, giải phóng khí H₂.Ví dụ:
2HBr + Zn ⟶ ZnBr₂ + H₂ - Tính khử: Do liên kết H-Br kém bền hơn H-Cl, HBr thể hiện tính khử mạnh hơn axit clohidric (HCl). Nó có thể bị oxi hóa bởi các chất oxi hóa mạnh như Axit Sunfuric (H₂SO₄) đặc.
- Phản ứng với muối: Tác dụng với muối của các axit yếu hơn để tạo ra muối mới và axit mới.Ví dụ:
2HBr + CaCO₃ ⟶ CaBr₂ + H₂O + CO₂
Các Phương Pháp Điều Chế Axit Bromhidric Phổ Biến
Trong phòng thí nghiệm, HBr được điều chế bằng cách cho NaBr tác dụng với H₃PO₄ đặc. Trong công nghiệp, phương pháp chính là tổng hợp trực tiếp từ khí hydro và brom lỏng ở nhiệt độ cao có xúc tác.
HBr có thể được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào quy mô và mục đích sử dụng.
Trong phòng thí nghiệm:
Người ta thường dùng Natri bromua (NaBr) hoặc Kali bromua (KBr) rắn tác dụng với axit mạnh nhưng không có tính oxi hóa, như Axit Photphoric (H₃PO₄).
NaBr (rắn) + H₃PO₄ (đặc) ⟶ NaH₂PO₄ + HBr (khí)
Lưu ý quan trọng: Không sử dụng H₂SO₄ đặc vì nó sẽ oxi hóa HBr thành Br₂.
Trong công nghiệp:
Phương pháp chính là tổng hợp trực tiếp từ hydro và brom ở nhiệt độ cao (200-400°C) với sự hiện diện của chất xúc tác (thường là platin hoặc amiăng).
H₂ + Br₂ ⟶ 2HBr
Ngoài ra, HBr cũng có thể được sản xuất như một sản phẩm phụ trong quá trình brom hóa các hợp chất hữu cơ.
Ứng Dụng Quan Trọng Của Axit Bromhidric (HBr)
HBr được ứng dụng chủ yếu trong việc sản xuất các muối bromua vô cơ (dùng trong dầu khí, dược phẩm), làm chất xúc tác và tác nhân cho các phản ứng tổng hợp hữu cơ.
Nhờ những tính chất hóa học đặc trưng, HBr và các muối bromua của nó có nhiều ứng dụng giá trị:
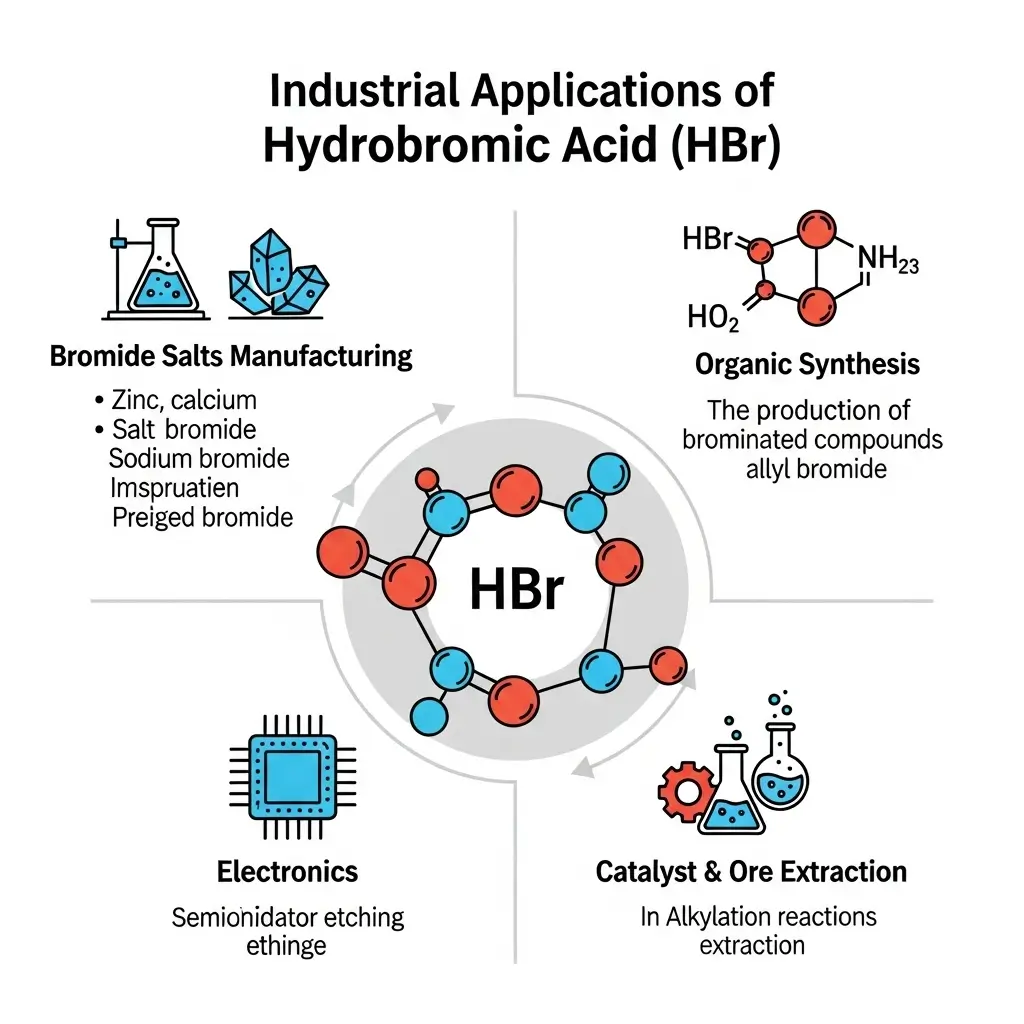
- Sản xuất hóa chất: Là tiền chất để sản xuất các muối bromua vô cơ như ZnBr₂, CaBr₂, NaBr, đặc biệt là trong ngành dầu khí.
- Tổng hợp hữu cơ: Được sử dụng làm chất xúc tác và tác nhân trong các phản ứng hữu cơ như ankyl hóa, sản xuất các hợp chất cơ-brom.
- Ngành dược phẩm: Các muối bromua như KBr, NaBr được dùng trong một số loại dược phẩm với tác dụng an thần.
- Các ứng dụng khác: HBr còn được dùng trong sản xuất thuốc nhuộm, hóa chất nhiếp ảnh và làm chất khắc trong luyện kim.
Lưu Ý Về An Toàn Khi Sử Dụng và Bảo Quản HBr
Phải trang bị đầy đủ đồ bảo hộ cá nhân vì HBr là chất ăn mòn mạnh. Cần thao tác trong tủ hút và bảo quản hóa chất trong bình chứa chuyên dụng, nơi khô ráo, thoáng mát, tránh xa các chất oxi hóa mạnh.
HBr là một hóa chất ăn mòn và nguy hiểm, do đó việc tuân thủ các quy tắc an toàn là vô cùng cần thiết.
An toàn lao động:
- HBr ở cả dạng khí và dung dịch đều có tính ăn mòn cao, gây bỏng nặng cho da, mắt và hệ hô hấp.
- Luôn trang bị đầy đủ đồ bảo hộ cá nhân (găng tay, kính mắt, áo choàng, mặt nạ phòng độc) khi làm việc.
- Thao tác trong tủ hút khí độc để tránh hít phải hơi axit.
Cách thức bảo quản hóa chất:
- Lưu trữ HBr trong các bình chứa làm bằng vật liệu kháng axit, đặt ở nơi khô ráo, thoáng mát.
- Tránh xa ánh nắng trực tiếp, nguồn nhiệt và các chất không tương thích như bazơ mạnh, chất oxi hóa mạnh.
Axit Bromhidric (HBr) là một axit vô cơ mạnh mẽ với nhiều tính chất và ứng dụng quan trọng. Việc hiểu rõ về nó không chỉ giúp chúng ta sử dụng hóa chất này một cách hiệu quả mà còn đảm bảo an toàn tuyệt đối.
Nếu bạn có nhu cầu tìm mua các loại hóa chất công nghiệp, hóa chất thí nghiệm chất lượng, hãy truy cập ngay cửa hàng hóa chất của chúng tôi hoặc liên hệ để được tư vấn và báo giá tốt nhất.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









