Kiến thức chuyên môn
Amoni NH₄⁺ Là Gì? Tính Chất & Ứng Dụng Chi Tiết (2025)
Amoni (NH₄⁺) là một trong những ion quan trọng và phổ biến nhất trong hóa học cũng như trong các ứng dụng đời sống. Từ nông nghiệp, xử lý nước đến các quy trình công nghiệp, hiểu rõ về NH₄⁺ là vô cùng cần thiết. Bài viết này sẽ cung cấp một cái nhìn chi tiết và toàn diện nhất về Amoni, được cập nhật với các tiêu chuẩn mới nhất cho năm 2025.
Amoni NH₄⁺ là gì?
Amoni (NH₄⁺) là một cation (ion đa nguyên tử) mang điện tích dương, được hình thành khi phân tử amoniac (NH₃) nhận một proton (H⁺). Nó có tính axit yếu và dễ dàng hòa tan trong nước.
Amoni, có công thức hóa học là NH₄⁺, là một cation (ion đa nguyên tử) mang điện tích dương. Ion này được hình thành khi phân tử amoniac (NH₃) nhận một proton (H⁺). Với trọng lượng phân tử là 18,04 g/mol, ion amoni dễ dàng hòa tan trong nước, tạo ra một cân bằng động với amoniac.
Trong dung dịch, NH₄⁺ thể hiện tính axit yếu thông qua phản ứng thủy phân:
NH₄⁺ + H₂O ⇌ NH₃ + H₃O⁺
Phản ứng này giải phóng ion hydroni (H₃O⁺), làm giảm độ pH của dung dịch.
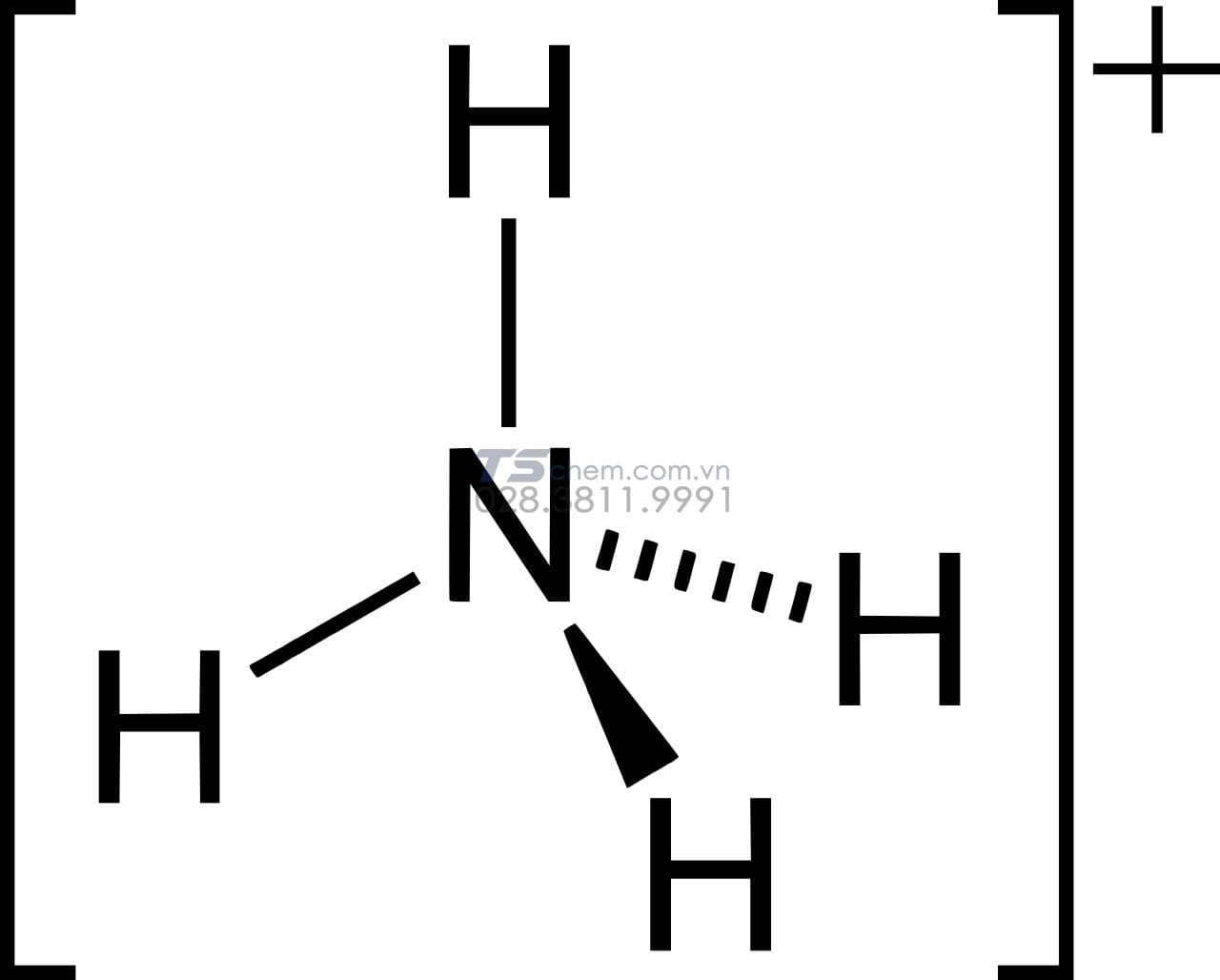
Cấu trúc phân tử của Ion Amoni NH₄⁺ như thế nào?
Ion Amoni (NH₄⁺) có cấu trúc hình tứ diện đều, với một nguyên tử Nitơ ở trung tâm liên kết cộng hóa trị với bốn nguyên tử Hydro, tạo thành một ion mang điện tích +1.
Ion Amoni (NH₄⁺) có cấu trúc hình tứ diện đều. Ở trung tâm là nguyên tử Nitơ (N), liên kết trực tiếp với bốn nguyên tử hydro (H) thông qua các liên kết cộng hóa trị bền vững. Toàn bộ ion mang điện tích +1 vì nguyên tử Nitơ đã cho đi một electron.
Kích thước của ion NH₄⁺ vào khoảng 143 picomet. Nó đặc biệt ổn định trong môi trường có độ pH thấp (dưới 9.3). Khi độ pH tăng lên, cân bằng hóa học sẽ dịch chuyển và NH₄⁺ sẽ chuyển hóa thành phân tử amoniac (NH₃).
Tính chất vật lý và hóa học của Amoni NH₄⁺ là gì?
Về mặt vật lý, ion amoni không màu, không mùi và tan tốt trong nước. Về mặt hóa học, nó là một axit yếu, có khả năng phản ứng với bazơ để giải phóng khí amoniac và bị phân hủy bởi nhiệt.
Các tính chất vật lý chính là gì?
- Trạng thái: Tồn tại ở dạng ion trong dung dịch hoặc dạng muối rắn (ví dụ: amoni clorua).
- Màu sắc: Không màu.
- Mùi: Bản thân ion NH₄⁺ không có mùi. Mùi khai đặc trưng thường liên quan đến sự hiện diện của khí NH₃.
- Độ tan: Các muối amoni tan rất tốt trong nước. Ví dụ, độ tan của NH₄Cl là 100g/100ml nước ở 20°C.
- Mật độ: Mật độ thay đổi tùy thuộc vào loại muối amoni, ví dụ muối NH₄Cl rắn có mật độ khoảng 1.527 g/cm³.
Các tính chất hóa học đặc trưng là gì?
- Tính axit: Như đã đề cập, NH₄⁺ là một axit yếu với pKa khoảng 9.25. Nó phản ứng với nước để tạo ra môi trường axit. Để xác định độ axit, người ta thường sử dụng các loại giấy quỳ tím hoặc máy đo pH chuyên dụng.
- Phản ứng với bazơ: Amoni phản ứng với các bazơ mạnh như NaOH để giải phóng khí amoniac có mùi khai.
NH₄⁺ + OH⁻ ⟶ NH₃ (k) + H₂O - Phản ứng nhiệt phân: Các muối amoni thường bị phân hủy ở nhiệt độ cao (trên 200°C), tạo thành amoniac và axit tương ứng.
NH₄Cl (r) ⟶ NH₃ (k) + HCl (k) - Độ ổn định: NH₄⁺ ổn định trong môi trường axit và trung tính nhưng không ổn định trong môi trường kiềm (dễ chuyển thành NH₃).
Làm thế nào để điều chế và sản xuất Amoni NH₄⁺?
Amoni (NH₄⁺) có thể được điều chế trong phòng thí nghiệm bằng cách cho amoniac phản ứng với axit, được tạo ra trong tự nhiên qua quá trình phân hủy sinh học, hoặc đơn giản nhất là hòa tan các muối amoni có sẵn vào nước.
Ion Amoni có thể được tạo ra bằng nhiều phương pháp khác nhau:
- Trong phòng thí nghiệm: Cách đơn giản nhất là cho dung dịch amoniac phản ứng với một axit. Ví dụ, sục khí NH₃ vào dung dịch axit clohidric (HCl) sẽ tạo ra muối amoni clorua.
NH₃ + HCl ⟶ NH₄Cl - Trong tự nhiên: Amoni được tạo ra từ quá trình phân hủy sinh học các hợp chất nitơ hữu cơ (protein, axit amin) bởi vi sinh vật. Quá trình này rất quan trọng trong chu trình nitơ của Trái Đất.
- Hòa tan muối: Trong thực tế, để có ion NH₄⁺ trong dung dịch, người ta thường hòa tan các loại muối amoni có sẵn như amoni sunfat ((NH₄)₂SO₄) hoặc amoni nitrat (NH₄NO₃) vào nước.
Amoni NH₄⁺ có những ứng dụng thực tế nào?
Các ứng dụng chính của amoni bao gồm làm thành phần cốt lõi trong phân bón nông nghiệp, xử lý nước thải, pha chế dung dịch đệm trong phòng thí nghiệm và làm tiền chất trong nhiều ngành công nghiệp khác.
Amoni là một hóa chất nền tảng với vô số ứng dụng trong nhiều ngành công nghiệp:
- Nông nghiệp: Đây là ứng dụng lớn nhất. Amoni là thành phần chính của các loại phân đạm như amoni nitrat (NH₄NO₃), supephotphat, urê. Nó cung cấp nguồn nitơ thiết yếu cho cây trồng, giúp tăng năng suất đáng kể. Việc kiểm tra độ pH đất là rất quan trọng để tối ưu hóa khả năng hấp thụ amoni của cây.
- Xử lý nước: Trong xử lý nước thải, vi sinh vật được sử dụng để chuyển hóa NH₄⁺ thành nitrat (NO₃⁻) trong điều kiện hiếu khí. Quá trình này giúp loại bỏ nitơ độc hại ra khỏi nguồn nước.
- Phòng thí nghiệm: Amoni được dùng để điều chế các dung dịch đệm (ví dụ, đệm NH₄Cl/NH₃) nhằm duy trì độ pH ổn định cho các phản ứng hóa học.
- Công nghiệp: Amoni là tiền chất để sản xuất nhiều loại muối và hợp chất khác, được sử dụng trong ngành dệt may, sản xuất thuốc nổ và chất tẩy rửa.
Sự khác biệt giữa Amoni (NH₄⁺) và Amoniac (NH₃) là gì?
Amoni (NH₄⁺) là một ion có điện tích, ít độc và ổn định trong môi trường axit, trong khi Amoniac (NH₃) là một phân tử khí trung hòa, có độc tính cao, mùi khai và tồn tại ở môi trường kiềm.
Nhiều người thường nhầm lẫn giữa Amoni và Amoniac. Dưới đây là bảng so sánh chi tiết để phân biệt rõ hai thực thể này:
| Đặc điểm | Amoni (NH₄⁺) | Amoniac (NH₃) |
|---|---|---|
| Công thức | NH₄⁺ (Ion) | NH₃ (Phân tử) |
| Điện tích | +1 | 0 (Trung tính) |
| Trạng thái | Tồn tại trong dung dịch hoặc dạng muối rắn | Là một chất khí ở điều kiện thường, hoặc tan trong dung dịch |
| Độc tính | Độc tính thấp, nhưng có thể chuyển hóa thành nitrit (NO₂⁻) độc hại | Độc tính cao, mùi khai nồng, gây kích ứng mạnh |
| Ảnh hưởng pH | Ổn định ở pH thấp (môi trường axit) | Tồn tại và chiếm ưu thế ở pH cao (môi trường kiềm) |
| Ứng dụng | Phân bón, dung dịch đệm | Chất làm lạnh, sản xuất hóa chất, chất tẩy rửa |
Mối quan hệ chuyển đổi: Sự tồn tại của chúng phụ thuộc chặt chẽ vào độ pH của môi trường theo cân bằng: NH₃ + H⁺ ⇌ NH₄⁺. Ở pH 7, khoảng 99% tồn tại ở dạng NH₄⁺.
Amoni có tác hại gì và cách xử lý an toàn như thế nào?
Tác hại chính của amoni là khả năng chuyển hóa thành nitrit (độc) và gây phú dưỡng nguồn nước. Các phương pháp xử lý bao gồm stripping bằng không khí (ở pH cao), trao đổi ion, và xử lý sinh học (nitrat hóa).
Mặc dù bản thân ion NH₄⁺ ít độc, nhưng sự hiện diện của nó với nồng độ cao trong môi trường có thể gây ra nhiều vấn đề:
- Chuyển hóa thành Nitrit (NO₂⁻): Trong môi trường nước, NH₄⁺ có thể bị oxy hóa thành nitrit, một chất rất độc có khả năng gây ra hiện tượng methemoglobinemia (thiếu oxy trong máu), đặc biệt nguy hiểm cho trẻ sơ sinh.
- Gây phú dưỡng: Nồng độ amoni cao trong nước thải khi xả ra sông hồ sẽ kích thích tảo và thực vật thủy sinh phát triển bùng nổ, làm cạn kiệt oxy trong nước và giết chết các loài cá.
- Tạo mùi hôi: Khi pH tăng, NH₄⁺ chuyển thành NH₃ bay hơi gây mùi khai khó chịu.
Các phương pháp xử lý amoni phổ biến:
- Stripping bằng không khí: Nâng pH của nước lên 10-11 để chuyển NH₄⁺ thành NH₃, sau đó sục khí để đuổi NH₃ ra khỏi nước.
- Trao đổi ion: Sử dụng các hạt nhựa cationit để hấp thụ ion NH₄⁺ và trao đổi nó bằng ion Na⁺ hoặc H⁺.
- Phương pháp sinh học (Nitrat hóa): Sử dụng các chủng vi khuẩn chuyên biệt như Nitrosomonas và Nitrobacter để chuyển hóa NH₄⁺ thành NO₂⁻ và sau đó là NO₃⁻ (ít độc hơn).
Cần có những lưu ý quan trọng nào khi làm việc với Amoni?
Khi làm việc với amoni, cần tuân thủ an toàn hóa chất (đeo đồ bảo hộ), không trộn với clo, và phải luôn giám sát, kiểm soát độ pH để ngăn chặn sự chuyển hóa thành amoniac (NH₃) độc hại.
- An toàn hóa chất: Luôn đeo găng tay và kính bảo hộ khi làm việc với dung dịch amoni đậm đặc. Tránh tuyệt đối việc trộn các hợp chất amoni với thuốc tẩy chứa clo, vì có thể tạo ra khí chloramine (NH₂Cl) rất độc.
- Giám sát môi trường: Nồng độ amoni trong nước thải phải được kiểm soát chặt chẽ theo các quy chuẩn môi trường (ví dụ: QCVN 40:2021/BTNMT).
- Kiểm soát pH: Luôn nhớ rằng pH là yếu tố quyết định. Sai lầm phổ biến nhất là không kiểm soát pH, dẫn đến việc amoni chuyển hóa thành amoniac gây độc.
Những câu hỏi thường gặp về Amoni NH₄⁺ là gì?
1. Ion NH₄⁺ có độc không?
Bản thân ion NH₄⁺ không độc trực tiếp, nhưng nó là tiền chất của nitrit (NO₂⁻) và amoniac (NH₃) là những chất độc hại. Nồng độ NO₂⁻ trên 0.5 mg/L đã có thể gây nguy hiểm.
2. Làm thế nào để đo nồng độ NH₄⁺ trong nước?
Có thể sử dụng các bộ test kit so màu (ví dụ: thuốc thử Nessler) hoặc các máy đo quang phổ, điện cực chọn lọc ion (ISE) cho kết quả chính xác hơn.
3. Ứng dụng quan trọng nhất của amoni trong nông nghiệp là gì?
Là thành phần cốt lõi của phân bón nitơ, cung cấp dinh dưỡng trực tiếp cho cây trồng để phát triển lá và thân, quyết định đến năng suất nông sản.
Với những thông tin chi tiết trên, hy vọng bạn đã có một cái nhìn toàn diện và sâu sắc về Amoni (NH₄⁺). Việc hiểu rõ bản chất và các tính chất của nó sẽ giúp chúng ta ứng dụng hiệu quả và kiểm soát an toàn hợp chất quan trọng này.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









