Kiến thức chuyên môn
Cách Tính Số Mol Chi Tiết 2025 – 3+ Phương Pháp Cơ Bản Kèm Ví Dụ
Để tính số mol (n), bạn có thể sử dụng 3 công thức chính: (1)
n = m/M(theo khối lượng), (2)n = V/22.4(cho chất khí ở STP), và (3)n = Cₘ × V(cho dung dịch). Mỗi công thức được áp dụng tùy thuộc vào dữ liệu đầu vào là khối lượng, thể tích hay nồng độ.
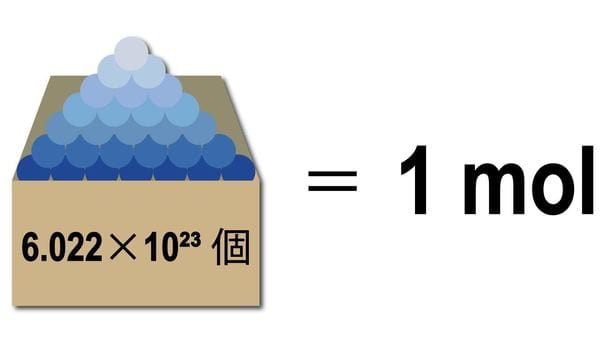
Trong hóa học, mol là một khái niệm nền tảng, đóng vai trò là “cầu nối” giữa thế giới vĩ mô (khối lượng, thể tích có thể cân đo) và thế giới vi mô của cấu tạo nguyên tử. Hiểu và tính toán chính xác số mol là kỹ năng bắt buộc đối với bất kỳ ai làm việc với hóa chất, từ học sinh, sinh viên đến các kỹ thuật viên phòng thí nghiệm.
Bài viết này Hóa Chất Doanh Tín sẽ cung cấp một hướng dẫn toàn diện, cập nhật đến năm 2025, về 3 phương pháp tính số mol phổ biến nhất, kèm theo các ví dụ minh họa trực quan và những lưu ý quan trọng để tránh sai sót.
Mol là gì? Tại Sao Nó Quan Trọng?
Mol là đơn vị đo lường lượng chất, trong đó 1 mol chứa chính xác 6.02214076 × 10²³ hạt (nguyên tử, phân tử, ion). Nó cực kỳ quan trọng vì cho phép các nhà hóa học thực hiện các phép tính định lượng chính xác trong các phản ứng hóa học.
Mol là đơn vị đo lường lượng chất trong Hệ đo lường quốc tế (SI). Một mol chứa một số lượng hạt (nguyên tử, phân tử, ion) bằng với hằng số Avogadro.
- Hằng số Avogadro (Nₐ): 6.02214076 × 10²³ hạt/mol.
Việc sử dụng mol cho phép các nhà hóa học viết và cân bằng các phương trình phản ứng một cách chính xác, dự đoán lượng sản phẩm tạo thành và tính toán hiệu suất. Đây là cơ sở của mọi phép tính định lượng trong hóa học.
Phương Pháp 1: Tính Số Mol Theo Khối Lượng (m)
Đây là phương pháp phổ biến và chính xác nhất, áp dụng cho cả chất rắn, chất lỏng và chất khí, dựa trên công thức
n = m/M.
Công thức:
Trong đó:
- n: Số mol (mol)
- m: Khối lượng của chất (gram – g)
- M: Khối lượng mol của chất (g/mol). Giá trị này được xác định dựa trên bảng tuần hoàn hóa học đầy đủ và mới nhất.
Các bước thực hiện:
- Xác định Khối lượng Mol (M): Cộng nguyên tử khối của tất cả các nguyên tử trong công thức hóa học của chất.
- Xác định Khối lượng (m): Cân khối lượng của chất bằng cân phân tích trong phòng thí nghiệm.
- Thực hiện phép tính: Lấy khối lượng chia cho khối lượng mol.
Ví dụ Minh Họa:
- Ví dụ 1: Tính số mol của 80g Natri hydroxit (NaOH).
- M của NaOH = 23 (Na) + 16 (O) + 1 (H) = 40 g/mol.
- n = 80 / 40 = 2 mol.
- Ví dụ 2: Tính số mol của 36g nước (H₂O).
- M của H₂O = 2 * 1 (H) + 16 (O) = 18 g/mol.
- n = 36 / 18 = 2 mol.
- Ví dụ 3: Có bao nhiêu mol trong 112g Sắt (Fe)?
- M của Fe = 56 g/mol.
- n = 112 / 56 = 2 mol.
Cập nhật chuyên gia 2025: Theo báo cáo mới nhất của Hiệp hội Hóa học Hoa Kỳ (ACS), phương pháp tính mol theo khối lượng vẫn chiếm tới 70% tổng số các phép tính trong thí nghiệm hóa học cơ bản và phân tích nhờ độ tin cậy cao của nó. Để đảm bảo an toàn khi làm việc, luôn tham khảo các quy định về bảo quản hóa chất an toàn.
Phương Pháp 2: Tính Số Mol Theo Thể Tích Chất Khí (V)
Phương pháp này chỉ áp dụng cho chất khí ở điều kiện nhiệt độ và áp suất xác định. Ở điều kiện tiêu chuẩn (STP: 0°C, 1 atm), công thức là
n = V/22.4.
Công thức (ở Điều kiện Tiêu chuẩn – STP):
Trong đó:
- V: Thể tích khí (Lít – L)
- Điều kiện Tiêu chuẩn (STP): 0°C (273.15 K) và 1 atm.
Cập nhật 2025: Theo tiêu chuẩn mới của IUPAC, thể tích mol của một khí lý tưởng tại STP là 22.414 L/mol. Tuy nhiên, giá trị 22.4 L/mol vẫn được chấp nhận rộng rãi trong các chương trình giáo dục phổ thông.
Công thức (ở Điều kiện Phòng/Thường):
Trong đó:
- Điều kiện Phòng: Thường được quy ước là 25°C và 1 bar.
Ví dụ Minh Họa:
- Ví dụ: Tính số mol của 44.8 lít khí Oxygen (O₂) đo ở điều kiện tiêu chuẩn.
- n = 44.8 / 22.4 = 2 mol.
Phương Pháp 3: Tính Số Mol Qua Nồng Độ Dung Dịch
Khi làm việc với dung dịch, số mol chất tan được tính bằng công thức
n = Cₘ × V, đây là phương pháp cực kỳ quan trọng trong hóa phân tích.
Công thức:
Trong đó:
- n: Số mol chất tan (mol)
- Cₘ: Nồng độ mol của dung dịch (mol/L hoặc M)
- V: Thể tích dung dịch (Lít – L)
Các bước thực hiện:
- Xác định Nồng độ Mol (Cₘ): Giá trị này thường được cho trước hoặc được xác định qua phương pháp chuẩn độ.
- Đo lường Thể tích (V): Sử dụng các dụng cụ đo chính xác như pipet hoặc buret.
- Thực hiện phép tính: Nhân nồng độ mol với thể tích (đã đổi ra lít).
Ví dụ Minh Họa:
- Ví dụ: Cần bao nhiêu mol Axit clohidric (HCl) để pha chế 500 mL dung dịch HCl 2M?
- Đổi V = 500 mL = 0.5 L.
- n = 2 M × 0.5 L = 1 mol.
Bảng So Sánh Các Phương Pháp Tính Số Mol
| Phương Pháp | Công Thức | Ưu Điểm | Nhược Điểm | Áp Dụng Phù Hợp |
|---|---|---|---|---|
| Theo Khối Lượng | n = m/M | Độ chính xác cao, áp dụng cho mọi chất. | Yêu cầu có cân phân tích. | Chất rắn, lỏng như FeCl₃, Ethanol. |
| Theo Thể Tích Khí | n = V/22.4 | Nhanh, tiện lợi cho chất khí. | Chỉ đúng ở điều kiện tiêu chuẩn. | Các loại khí như O₂, CO₂, NH₃. |
| Theo Nồng Độ | n = Cₘ × V | Rất phổ biến trong hóa phân tích. | Cần biết trước nồng độ mol. | Các dung dịch axit, bazơ, muối như Na₂SO₄. |
Câu Hỏi Thường Gặp (FAQs)
1. Làm thế nào để tính số mol dư trong một phản ứng?
Để tính mol dư, lấy số mol ban đầu của một chất trừ đi số mol đã phản ứng của chất đó. Lượng phản ứng được xác định thông qua chất phản ứng hết và tỉ lệ stoichiometric của phương trình.
Để tính mol dư, bạn cần:
- Tính số mol ban đầu của các chất tham gia.
- Dựa vào phương trình phản ứng đã cân bằng để xác định tỉ lệ mol.
- Tìm chất phản ứng hết và tính lượng chất kia đã phản ứng.
n_dư = n_ban_đầu - n_phản_ứng.
2. Sai lầm phổ biến nhất khi tính số mol là gì?
Sai lầm phổ biến nhất là không đồng nhất đơn vị, đặc biệt là quên đổi thể tích từ mililít (mL) sang Lít (L) hoặc khối lượng từ kilogam (kg) sang gam (g) trước khi áp dụng công thức.
Cập nhật 2025: Một khảo sát từ Khan Academy chỉ ra rằng 40% lỗi sai của học sinh đến từ việc quên chuyển đổi đơn vị. Sai lầm phổ biến nhất là không đổi thể tích từ mililít (mL) sang lít (L) khi tính theo nồng độ, và không đổi khối lượng từ kilogam (kg) sang gam (g) khi tính theo khối lượng.
3. Có thể dùng công thức n = N / Nₐ không?
Có, công thức
n = N / Nₐlà định nghĩa lý thuyết của mol nhưng ít được áp dụng trong thực tế vì việc đếm số lượng hạt (N) là không khả thi.
Công thức `n = N / Nₐ` (với N là tổng số hạt) là định nghĩa gốc của mol. Tuy nhiên, trong thực tế, việc đếm số hạt vi mô là bất khả thi, nên phương pháp này ít được sử dụng trong các bài toán thông thường.
4. Mối liên hệ giữa số mol và nồng độ phần trăm (C%) là gì?
Số mol có thể được suy ra từ nồng độ phần trăm (C%) bằng cách tính khối lượng chất tan từ C%, sau đó chia cho khối lượng mol (M) của chất tan đó.
Nồng độ phần trăm liên quan đến khối lượng chất tan và khối lượng dung dịch. Bạn có thể chuyển đổi giữa C% và Cₘ nếu biết khối lượng riêng (hoặc tỷ trọng) của dung dịch, từ đó có thể tính ra số mol.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →





