Kiến thức chuyên môn
Liên Kết Cộng Hóa Trị Là Gì? Phân Loại và Ứng Dụng Công Nghiệp
Từ Lý Thuyết Đến Thực Tiễn Nhà Máy: Giải Mã Liên Kết Cộng Hóa Trị và Tầm Quan Trọng Trong Việc Lựa Chọn Hóa Chất Công Nghiệp
Bạn có biết tại sao dầu không tan trong nước, hay tại sao cồn có thể dùng làm dung môi cho nhiều loại hóa chất? Câu trả lời nằm ở một trong những khái niệm nền tảng nhất của hóa học: liên kết cộng hóa trị. Đối với các doanh nghiệp trong ngành sản xuất, việc hiểu rõ bản chất của liên kết này không chỉ là kiến thức học thuật, mà là chìa khóa để tối ưu hóa quy trình, lựa chọn vật tư hiệu quả và đảm bảo an toàn.
Bài viết này từ các chuyên gia của Hóa Chất Doanh Tín sẽ giải mã toàn diện về liên kết cộng hóa trị và những ứng dụng thiết thực của nó.
Liên kết cộng hóa trị là gì và định nghĩa chuẩn cho người làm kỹ thuật ra sao?
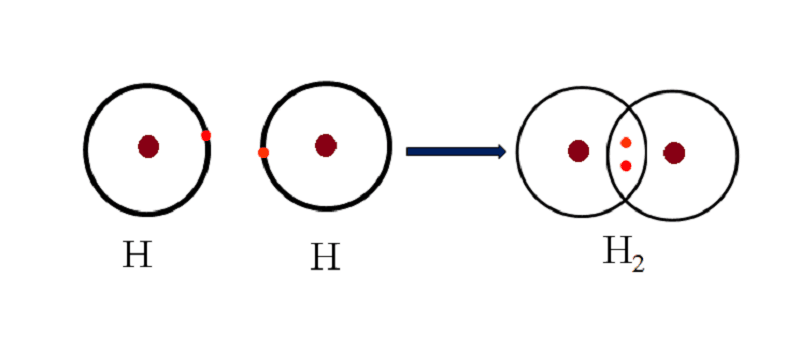
Liên kết cộng hóa trị là sự liên kết được hình thành giữa hai nguyên tử thông qua việc dùng chung một hay nhiều cặp electron. Các nguyên tử “góp chung” electron để đạt được cấu hình electron bền vững, thay vì cho hoặc nhận hẳn như trong liên kết ion.
Về cơ bản, cặp electron dùng chung này tạo ra một lực hút tĩnh điện, giữ chặt hai hạt nhân nguyên tử lại với nhau và hình thành nên phân tử. Đây là loại liên kết phổ biến nhất trong tự nhiên, là nền tảng tạo nên vô số hợp chất hữu cơ và vô cơ mà chúng ta sử dụng hàng ngày, từ nước (H₂O), khí oxy (O₂) cho đến các loại dung môi công nghiệp phức tạp.
Làm thế nào để phân loại liên kết cộng hóa trị nhằm chọn đúng hóa chất?
Liên kết cộng hóa trị được phân loại theo hai cách chính: dựa vào số cặp electron dùng chung (liên kết đơn, đôi, ba) và dựa vào sự phân cực của liên kết (phân cực và không phân cực), yếu tố quyết định tính tan và các thuộc tính khác.
Việc phân loại liên kết cộng hóa trị giúp chúng ta dự đoán được tính chất của một hợp chất. Có hai cách phân loại chính và quan trọng nhất đối với các ứng dụng công nghiệp.
Việc phân loại theo số cặp electron dùng chung có ý nghĩa gì?
Cách phân loại này cho biết độ bền và độ dài của liên kết. Liên kết ba ngắn nhất và bền vững nhất, trong khi liên kết đơn dài nhất và kém bền nhất.
- Liên kết đơn: Hai nguyên tử dùng chung một cặp electron (ví dụ trong phân tử H₂, Cl₂).
- Liên kết đôi: Hai nguyên tử dùng chung hai cặp electron (ví dụ trong phân tử O₂, CO₂).
- Liên kết ba: Hai nguyên tử dùng chung ba cặp electron (ví dụ trong phân tử N₂).
| Loại Liên kết | Ví dụ (Hợp chất) | Độ dài trung bình (pm) | Năng lượng liên kết (kJ/mol) | Độ bền |
|---|---|---|---|---|
| C-C (Đơn) | Ethane (C₂H₆) | 154 | ~347 | Bền |
| C=C (Đôi) | Ethene (C₂H₄) | 134 | ~611 | Rất bền |
| C≡C (Ba) | Ethyne (C₂H₂) | 120 | ~837 | Cực kỳ bền |
Góc nhìn chuyên gia Nguyễn Thị Mỹ Linh: “Nhiều người lầm tưởng liên kết đơn ổn định hơn, nhưng thực tế, năng lượng để phá vỡ một liên kết ba lớn hơn rất nhiều so với liên kết đơn, làm cho nó bền vững hơn về mặt hóa học. Sự trơ của khí N₂ chính là minh chứng rõ ràng nhất, được ứng dụng làm khí bảo vệ trong các quy trình hàn, luyện kim hoặc đóng gói thực phẩm để ngăn chặn quá trình oxy hóa.”
Sự phân cực ảnh hưởng đến việc lựa chọn hóa chất như thế nào?
Sự phân cực là yếu tố quyết định tính “hòa hợp” giữa các chất. Các dung môi phân cực hòa tan các chất phân cực, và ngược lại. Đây là nguyên tắc vàng “giống nhau hòa tan nhau” trong việc lựa chọn dung môi.
Đây là cách phân loại quan trọng nhất trong ứng dụng thực tế, đặc biệt là khi lựa chọn dung môi. Sự phân cực được quyết định bởi độ âm điện – khả năng hút electron của một nguyên tử.
Liên kết cộng hóa trị không phân cực (Hiệu độ âm điện: 0 → <0.4)
Khi hai nguyên tử tham gia liên kết có độ âm điện tương đương, cặp electron dùng chung sẽ nằm chính giữa.
Ứng dụng công nghiệp: Dung môi không phân cực như Hexane, Toluene được dùng để hòa tan dầu mỡ, cao su, nhựa.
Liên kết cộng hóa trị có cực (Hiệu độ âm điện: 0.4 → <1.7)
Khi hai nguyên tử có độ âm điện chênh lệch, cặp electron dùng chung bị lệch về phía nguyên tử mạnh hơn.
Ứng dụng công nghiệp: Các dung môi phân cực như nước, ethanol, acetone là “dung môi vạn năng” cho các chất phân cực và các hợp chất ion.

Đâu là sự khác biệt chính giữa liên kết cộng hóa trị và liên kết ion?
Sự khác biệt cốt lõi nằm ở bản chất tương tác electron: liên kết cộng hóa trị là “góp chung” electron giữa các phi kim, trong khi liên kết ion là “cho và nhận” electron giữa kim loại và phi kim.
Để tránh nhầm lẫn, điều quan trọng là phải phân biệt rõ ràng giữa hai loại liên kết hóa học chính này.
| Tiêu Chí | Liên Kết Cộng Hóa Trị | Liên Kết Ion |
|---|---|---|
| Bản chất | Góp chung electron | Cho và nhận electron |
| Cấu tạo | Giữa các nguyên tử phi kim | Giữa kim loại điển hình và phi kim điển hình |
| Hiệu độ âm điện | Thường < 1.7 | Thường ≥ 1.7 |
| Tính chất chất | Nhiệt độ sôi, nóng chảy thấp, không dẫn điện | Tinh thể, cứng, giòn, nhiệt độ sôi, nóng chảy cao, dẫn điện khi nóng chảy/tan. |
| Ví dụ | CO₂, H₂O, C₂H₅OH (Ethanol) | NaCl (Muối ăn) , MgO |
Case Study: Việc lựa chọn dung môi tẩy rửa dầu mỡ công nghiệp được giải quyết như thế nào?
Bằng cách xác định dầu mỡ là hợp chất không phân cực, Doanh Tín đã tư vấn khách hàng chuyển từ nước (phân cực) sang dung môi Toluen (không phân cực), giúp hòa tan vết bẩn hiệu quả và tăng năng suất lên 70%.
Tình huống: Một khách hàng của Doanh Tín trong ngành cơ khí chính xác cần làm sạch các chi tiết máy bị bám dầu bôi trơn và mỡ công nghiệp. Ban đầu, họ sử dụng nước và xà phòng nhưng hiệu quả không cao, tốn nhiều thời gian và công sức.
Phân tích của Doanh Tín: Chúng tôi xác định dầu mỡ là các hợp chất hydrocacbon, có liên kết cộng hóa trị không phân cực. Nước là dung môi phân cực mạnh. Theo nguyên tắc “giống nhau hòa tan nhau”, nước không thể hòa tan hiệu quả dầu mỡ.
Giải pháp: Đội ngũ Doanh Tín đã tư vấn khách hàng chuyển sang sử dụng Dung môi Toluen (C₇H₈).
Kết quả: Toluen nhanh chóng hòa tan và loại bỏ hoàn toàn lớp dầu mỡ, giúp tăng năng suất làm sạch lên 70% và giảm chi phí nhân công.
Những câu hỏi thường gặp (FAQ) về liên kết cộng hóa trị là gì?
Làm thế nào để biết một phân tử là phân cực hay không phân cực?
Ngoài việc xét hiệu độ âm điện, cần xem xét cả hình dạng không gian của phân tử. Nếu phân tử có cấu trúc đối xứng, nó sẽ không phân cực dù các liên kết riêng lẻ có thể phân cực.
Ngoài việc xét hiệu độ âm điện của từng liên kết, bạn cần xem xét cả hình dạng không gian của phân tử. Nếu phân tử có cấu trúc đối xứng (như CO₂, CH₄), các moment lưỡng cực của các liên kết sẽ triệt tiêu nhau, làm cho toàn bộ phân tử không phân cực, mặc dù từng liên kết C=O hay C-H là có cực.
Hợp chất cộng hóa trị có dẫn điện được không?
Hầu hết là không, vì chúng không có electron tự do. Tuy nhiên, có ngoại lệ như than chì (graphite) có khả năng dẫn điện do cấu trúc đặc biệt của nó.
Hầu hết là không. Tuy nhiên, có trường hợp ngoại lệ như than chì (graphite). Trong cấu trúc của than chì, mỗi nguyên tử Carbon chỉ tạo 3 liên kết cộng hóa trị, còn 1 electron hóa trị tự do có thể di chuyển, giúp nó dẫn được điện.
Tại sao các dung môi hữu cơ thường dễ bay hơi và dễ cháy?
Do lực tương tác giữa các phân tử cộng hóa trị (lực Van der Waals) rất yếu, chúng dễ dàng tách ra để chuyển sang thể hơi (dễ bay hơi) và có nhiệt độ sôi thấp, đồng thời dễ bắt lửa.
Các hợp chất này được tạo bởi liên kết cộng hóa trị, lực tương tác giữa các phân tử (lực Van der Waals) rất yếu. Do đó, chúng dễ dàng tách khỏi nhau để chuyển sang thể hơi (dễ bay hơi) và có nhiệt độ sôi thấp. Hầu hết chúng là hợp chất hữu cơ nên dễ bắt lửa. Đây là lý do cần tuân thủ nghiêm ngặt các quy định an toàn hóa chất và ghi nhãn theo chuẩn GHS khi lưu trữ và sử dụng.
Kết luận
Hiểu về liên kết cộng hóa trị là gì không chỉ là một bài học hóa học cơ bản. Đối với Hóa Chất Doanh Tín và các khách hàng của chúng tôi, đó là nền tảng khoa học để đưa ra các quyết định kỹ thuật chính xác, từ việc lựa chọn dung môi phù hợp cho quy trình sản xuất, pha chế sản phẩm đến việc đảm bảo an toàn lao động. Bằng cách nắm vững các nguyên tắc về sự phân cực và độ bền liên kết, doanh nghiệp của bạn có thể nâng cao hiệu quả và chất lượng sản phẩm một cách bền vững.
Nếu bạn có bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với đội ngũ chuyên gia của Hóa Chất Doanh Tín để được tư vấn và lựa chọn sản phẩm hóa chất phù hợp nhất.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →





