Kiến thức chuyên môn
Cấu tạo nguyên tử là gì? Thành phần, mô hình và ứng dụng chi tiết
Cấu Tạo Nguyên Tử: Nền Tảng Khoa Học Vật Liệu & Hóa Chất [Cập nhật 2025]
Trong vũ trụ bao la cũng như trong từng sản phẩm công nghiệp tinh vi, tất cả đều được cấu thành từ những đơn vị cơ bản nhất của vật chất: nguyên tử. Hiểu rõ cấu tạo nguyên tử không chỉ là kiến thức nền tảng của hóa học, mà còn là chìa khóa để làm chủ công nghệ vật liệu và sản xuất hóa chất. Bài viết này, với sự bảo chứng chuyên môn từ Hóa Chất Doanh Tín, sẽ cung cấp một cái nhìn toàn diện từ lý thuyết cơ bản đến những ứng dụng thực tiễn quan trọng.
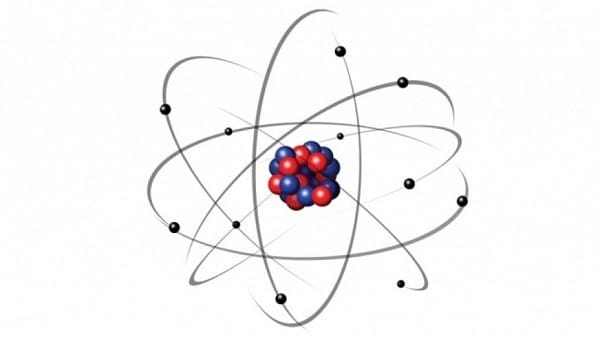
Lịch sử hình thành học thuyết nguyên tử đã trải qua những giai đoạn nào?
Học thuyết nguyên tử đã tiến hóa qua 6 giai đoạn chính: từ khái niệm “atomos” của người Hy Lạp cổ đại, đến mô hình quả cầu đặc của Dalton (1808), mô hình “bánh pudding mận” của Thomson (1897), mô hình hành tinh nguyên tử của Rutherford (1911), mô hình quỹ đạo năng lượng của Bohr (1913), và cuối cùng là mô hình đám mây electron dựa trên cơ học lượng tử của Schrödinger và Heisenberg (thập niên 1920), vốn là mô hình chính xác nhất được sử dụng đến ngày nay.
Hành trình khám phá nguyên tử là một câu chuyện hấp dẫn về trí tuệ con người. Việc nhìn lại lịch sử giúp chúng ta hiểu sâu sắc hơn bản chất của các mô hình hiện đại.
- Thế kỷ V TCN: Nhà triết học Hy Lạp Democritus lần đầu đề xuất khái niệm “atomos” (không thể phân chia), cho rằng vật chất không thể bị chia nhỏ mãi mãi.
- 1808 (John Dalton): Đặt nền móng cho hóa học hiện đại với thuyết nguyên tử, xem nguyên tử là những đơn chất được tạo thành từ những quả cầu đặc, không thể phân chia.
- 1897 (J.J. Thomson): Khám phá ra electron và đề xuất mô hình “bánh pudding mận,” cho rằng các electron âm phân bố trong một khối cầu điện tích dương.
- 1911 (Ernest Rutherford): Qua thí nghiệm bắn phá lá vàng, ông chứng minh nguyên tử có cấu trúc rỗng với một hạt nhân mang điện tích dương rất nhỏ ở trung tâm. Đây là cơ sở cho mô hình hành tinh nguyên tử.
- 1913 (Niels Bohr): Cải tiến mô hình của Rutherford, cho rằng electron chỉ chuyển động trên các quỹ đạo tròn xác định (các mức năng lượng) quanh hạt nhân.
- Thập niên 1920 (Schrödinger, Heisenberg): Cuộc cách mạng lượng tử ra đời, thay thế quỹ đạo của Bohr bằng khái niệm orbital nguyên tử (AO) – vùng không gian mà xác suất tìm thấy electron là lớn nhất. Đây là mô hình được chấp nhận rộng rãi ngày nay.
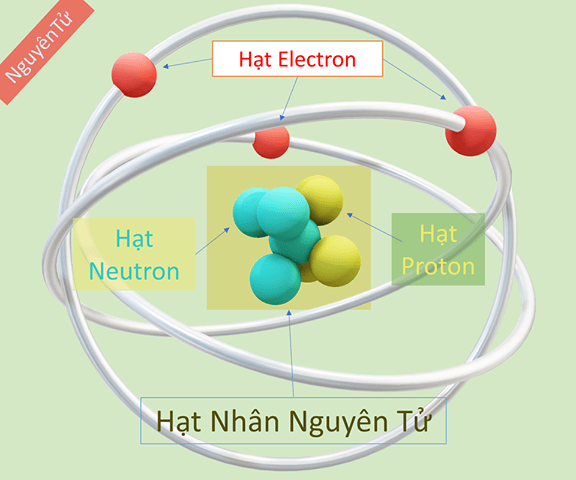
Những thành phần cốt lõi cấu tạo nên một nguyên tử là gì?
Một nguyên tử được cấu tạo từ ba hạt hạ nguyên tử cơ bản: Proton và Neutron hình thành nên hạt nhân ở trung tâm, và Electron tạo nên lớp vỏ bao quanh.
Mọi nguyên tử đều được xây dựng từ ba loại hạt hạ nguyên tử cơ bản. Việc nắm vững đặc tính của chúng là điều kiện tiên quyết để hiểu về hóa học.
Đặc tính của các hạt Proton, Neutron, và Electron khác nhau như thế nào?
Chúng khác nhau cơ bản về vị trí, điện tích và khối lượng. Proton (điện tích +1) và Neutron (không mang điện) nằm trong hạt nhân và có khối lượng xấp xỉ 1u. Electron (điện tích -1) chuyển động ở lớp vỏ và có khối lượng nhỏ không đáng kể.
| Đặc Điểm | Proton (p) | Neutron (n) | Electron (e) |
|---|---|---|---|
| Ký hiệu | p | n | e |
| Vị trí | Trong hạt nhân | Trong hạt nhân | Vỏ nguyên tử |
| Điện tích (q) | +1.602 x 10⁻¹⁹ C | 0 | -1.602 x 10⁻¹⁹ C |
| Khối lượng (kg) | 1.6726 x 10⁻²⁷ | 1.6749 x 10⁻²⁷ | 9.1094 x 10⁻³¹ |
| Khối lượng (u) | ~ 1 | ~ 1 | ~ 0 |
Hạt nhân nguyên tử có vai trò và cấu trúc ra sao?
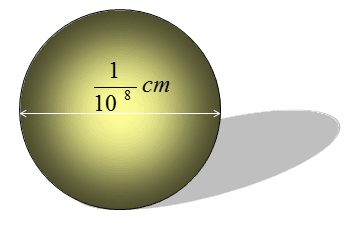
Hạt nhân là trung tâm của nguyên tử, chiếm tới 99.9% khối lượng nhưng có kích thước cực kỳ nhỏ. Vai trò của nó là xác định danh tính (số proton) và khối lượng (tổng số proton và neutron) của nguyên tố.
Hạt nhân chiếm một thể tích vô cùng nhỏ bé (đường kính ~10⁻¹⁵ m) nhưng lại tập trung đến 99.9% khối lượng của toàn nguyên tử.
- Proton (p): Số proton (ký hiệu là Z) quyết định một nguyên tử thuộc về nguyên tố hóa học nào. Ví dụ, mọi nguyên tử có 6 proton đều là Cacbon (C).
- Neutron (n): Đóng vai trò như “chất keo” hạt nhân, giúp các proton cùng dấu đẩy nhau không bị văng ra.
- Số khối (A): Là tổng số proton và neutron trong hạt nhân. A = Z + N.
Vỏ nguyên tử quyết định tính chất gì của nguyên tố?
Vỏ nguyên tử quyết định gần như toàn bộ tính chất hóa học của một nguyên tố, bao gồm khả năng hình thành liên kết, hóa trị, tính kim loại/phi kim, và độ âm điện.
Vỏ nguyên tử là không gian rộng lớn bao quanh hạt nhân, nơi các electron tồn tại. Cấu trúc vỏ electron quyết định gần như toàn bộ tính chất hóa học của một nguyên tố, bao gồm khả năng hình thành liên kết, tính kim loại/phi kim, và hóa trị.
Góc Nhìn Chuyên Gia
“Nhiều người cho rằng neutron chỉ là hạt ‘đệm’ trong hạt nhân. Nhưng thực tế, sự chênh lệch số neutron, tức các đồng vị, có thể thay đổi hoàn toàn tính chất vật lý của một nguyên tố. Ví dụ, ‘nước nặng’ (D₂O) với đồng vị Deuterium có tính chất khác hẳn nước thường (H₂O) và đóng vai trò cực kỳ quan trọng trong công nghệ hạt nhân.”
– Nguyễn Thị Mỹ Linh, Trưởng phòng R&D Hóa Chất Doanh Tín
Cấu trúc vỏ electron quyết định tính chất hóa học của một nguyên tố như thế nào?
Thông qua cách các electron được sắp xếp vào các lớp và phân lớp năng lượng. Cấu hình electron, đặc biệt là số electron ở lớp ngoài cùng, sẽ quyết định cách nguyên tử đó tương tác, nhường, nhận hay chia sẻ electron để tạo thành liên kết hóa học với các nguyên tử khác.
Electron được phân bố thành các lớp và phân lớp ra sao?
Các electron được sắp xếp vào 7 lớp năng lượng (K, L, M, N, O, P, Q). Mỗi lớp lại được chia thành các phân lớp nhỏ hơn theo thứ tự s, p, d, f. Mỗi phân lớp có một số lượng electron tối đa: s (2e), p (6e), d (10e), và f (14e).
Cấu hình electron là gì và nó được viết như thế nào?
Cấu hình electron là cách biểu diễn sự phân bố electron của một nguyên tử theo các lớp và phân lớp. Nó được viết bằng cách điền electron vào các phân lớp theo thứ tự mức năng lượng tăng dần (1s, 2s, 2p, 3s, 3p, 4s, 3d,…), với số mũ là số electron trong phân lớp đó.
Thứ tự này là nền tảng để xây dựng nên bảng tuần hoàn hóa học mà chúng ta biết.
Ví dụ: Viết cấu hình electron của Sắt (Fe, Z=26):
1s²2s²2p⁶3s²3p⁶4s²3d⁶. Viết lại theo thứ tự lớp: 1s²2s²2p⁶3s²3p⁶3d⁶4s².
Đồng vị và Ion là gì, chúng hình thành ra sao?
Đồng vị là các dạng khác nhau của cùng một nguyên tố, có cùng số proton nhưng khác số neutron. Ion là một nguyên tử hoặc phân tử bị mất hoặc nhận thêm electron, từ đó trở thành một hạt mang điện tích (dương hoặc âm).
- Đồng vị: Là các nguyên tử có cùng số proton (Z) nhưng khác nhau về số neutron (N). Ví dụ, Oxygen có 3 đồng vị bền là ¹⁶O, ¹⁷O, và ¹⁸O.
- Ion: Là phần tử mang điện được hình thành khi một nguyên tử trung hòa nhường hoặc nhận electron.
- Cation (Ion dương): Hình thành khi nguyên tử kim loại như Natri (Na) nhường electron (ví dụ: Na ⟶ Na⁺ + 1e).
- Anion (Ion âm): Hình thành khi nguyên tử phi kim như Fluor (F) nhận electron (ví dụ: F + 1e ⟶ F⁻). Quá trình này tạo ra các liên kết ion bền vững.
Kiến thức về cấu tạo nguyên tử có những ứng dụng thực tiễn nào trong công nghiệp?
Kiến thức này là nền tảng cho vô số ngành công nghiệp: từ sản xuất Polymer, công nghệ bán dẫn cho thiết bị điện tử, đến việc chế tạo chất xúc tác để tăng hiệu suất phản ứng hóa học. Nó giúp chúng ta hiểu và điều khiển vật chất ở cấp độ cơ bản nhất.
Tại Hóa Chất Doanh Tín, chúng tôi hiểu rằng lý thuyết nền tảng chính là cơ sở cho mọi ứng dụng thực tiễn.
- Sản xuất Polymer: Cấu hình electron của Cacbon cho phép nó tạo ra 4 liên kết cộng hóa trị bền vững, là nền tảng của toàn bộ ngành hóa hữu cơ và sản xuất polymer như PE, PP, PVC.
- Công nghệ bán dẫn: Sự khác biệt về mức năng lượng electron của Silic (Si) và các nguyên tố pha tạp như Photpho (P), Bo (B) tạo ra các chất bán dẫn loại N và P, trái tim của ngành công nghiệp điện tử.
- Xúc tác công nghiệp: Cấu trúc electron đặc biệt của các kim loại chuyển tiếp (Fe, Ni, Pt) với các orbital d chưa bão hòa giúp chúng trở thành những chất xúc tác hiệu quả cho vô số phản ứng hóa học.
Case Study: Lựa chọn đồng vị Chlorine trong xử lý nước công nghiệp
- Thách thức: Một nhà máy dệt may đối mặt với vấn đề vi sinh vật phát triển trong hệ thống nước làm mát, ảnh hưởng đến hiệu quả trao đổi nhiệt.
- Giải pháp: Hóa Chất Doanh Tín đã tư vấn sử dụng Chlorine (Cl₂). Chúng tôi phân tích và đề xuất hợp chất chứa đồng vị ³⁵Cl phổ biến. Việc hiểu rõ khối lượng nguyên tử trung bình của Clo (35.5) bắt nguồn từ sự tồn tại của hai đồng vị ³⁵Cl và ³⁷Cl là yếu tố then chốt để tính toán liều lượng chính xác.
- Kết quả: Hệ thống được kiểm soát vi sinh hiệu quả, tăng hiệu suất và giảm chi phí vận hành.
Làm thế nào để giải các dạng bài toán phổ biến về cấu tạo nguyên tử?
Phương pháp chính là lập và giải hệ phương trình dựa trên các dữ kiện đề bài cho. Các công thức cốt lõi cần nhớ là: Tổng số hạt = 2p + n và Số khối A = p + n (với p = số proton, n = số neutron).
Dạng 1: Xác định số lượng các loại hạt
Bài toán: Một nguyên tử X có tổng số hạt cơ bản là 52. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 16. Xác định p, n, e và tên nguyên tố X.
Phương pháp giải:
- Lập hệ phương trình:
- Tổng số hạt: 2p + n = 52 (vì p=e)
- Hiệu số hạt: 2p – n = 16
- Giải hệ phương trình, ta được: p = 17 và n = 18.
- Kết luận: p = e = 17, n = 18. Nguyên tố có Z = 17 là Clo (Cl), một trong những halogen quan trọng.
Dạng 2: Bài toán liên quan đến Ion
Bài toán: Ion X²⁺ có cấu hình electron ở lớp ngoài cùng là 3p⁶. Xác định cấu hình electron của nguyên tử X.
Phương pháp giải:
- Ion X²⁺ hình thành từ nguyên tử X bằng cách nhường đi 2 electron.
- Cấu hình của ion X²⁺ (18 electron) là 1s²2s²2p⁶3s²3p⁶, giống cấu hình của khí Argon.
- Vậy, nguyên tử X ban đầu phải có 18 + 2 = 20 electron.
- Kết luận: Cấu hình của X (Z=20) là 1s²2s²2p⁶3s²3p⁶4s². X là Canxi (Ca).
Câu Hỏi Thường Gặp (FAQ)
1. Tại sao khối lượng nguyên tử lại xấp xỉ bằng số khối?
Vì khối lượng của proton và neutron lớn hơn rất nhiều so với khối lượng electron. Do đó, khối lượng nguyên tử chủ yếu là tổng khối lượng của proton và neutron, tức là số khối.
2. Orbital và quỹ đạo có giống nhau không?
Không. Quỹ đạo (mô hình cũ) là một đường đi cụ thể. Orbital (mô hình hiện đại) là một vùng không gian mà ở đó xác suất tìm thấy electron là cao nhất (trên 90%).
3. Làm thế nào để nhớ thứ tự các mức năng lượng electron?
Bạn có thể sử dụng “Sơ đồ Klechkowski” (giản đồ chéo) để dễ dàng xác định thứ tự phân bố electron: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p…
4. Cấu tạo nguyên tử có liên quan gì đến an toàn hóa chất?
Có. Các nguyên tử có electron lớp ngoài cùng chưa bão hòa thường có hoạt tính hóa học cao, tiềm ẩn nguy cơ phản ứng mạnh. Việc hiểu rõ điều này là cơ sở cho các quy tắc ghi nhãn hóa chất theo GHS để cảnh báo nguy hiểm.
Kết Luận
Từ những hạt hạ nguyên tử vô hình, một thế giới vật chất đa dạng và phức tạp được hình thành. Việc nắm vững cấu tạo nguyên tử không chỉ là yêu cầu học thuật mà còn là nền tảng để đổi mới và phát triển trong ngành công nghiệp hóa chất. Hóa Chất Doanh Tín tự hào đồng hành cùng quý khách hàng và các bạn học sinh, sinh viên trên con đường chinh phục đỉnh cao tri thức khoa học.
Bạn cần tư vấn kỹ thuật chuyên sâu về ứng dụng hóa chất trong sản xuất?
Đội ngũ chuyên gia của Hóa Chất Doanh Tín luôn sẵn sàng hỗ trợ. Liên hệ với chúng tôi ngay hôm nay để nhận được giải pháp tối ưu nhất cho các sản phẩm như Xylene, Methanol, hay Axit Nitric.
Lưu ý: Thông tin trong bài viết chỉ mang tính chất tham khảo và giáo dục. Đối với các ứng dụng kỹ thuật cụ thể, vui lòng liên hệ trực tiếp với chuyên gia để được tư vấn chính xác.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →





