Kiến thức chuyên môn
Ether là gì? Cấu trúc, tính chất và vai trò trong đời sống
“Ether” là một thuật ngữ đa nghĩa, có thể khiến nhiều người nhầm lẫn nếu không đặt trong đúng bối cảnh. Nó vừa là tên gọi của một lớp hợp chất hữu cơ quan trọng trong hóa học, vừa là tên của một trong những đồng tiền điện tử hàng đầu thế giới. Trong bài viết này, Hóa Chất Doanh Tín sẽ cùng bạn phân tích chi tiết hai khái niệm này, từ công thức, tính chất, phương pháp điều chế trong hóa học đến vai trò, cách sử dụng và tiềm năng của nó trong thế giới crypto năm 2025.
Ether Trong Hóa Học: Cấu Trúc, Tính Chất Và Ứng Dụng
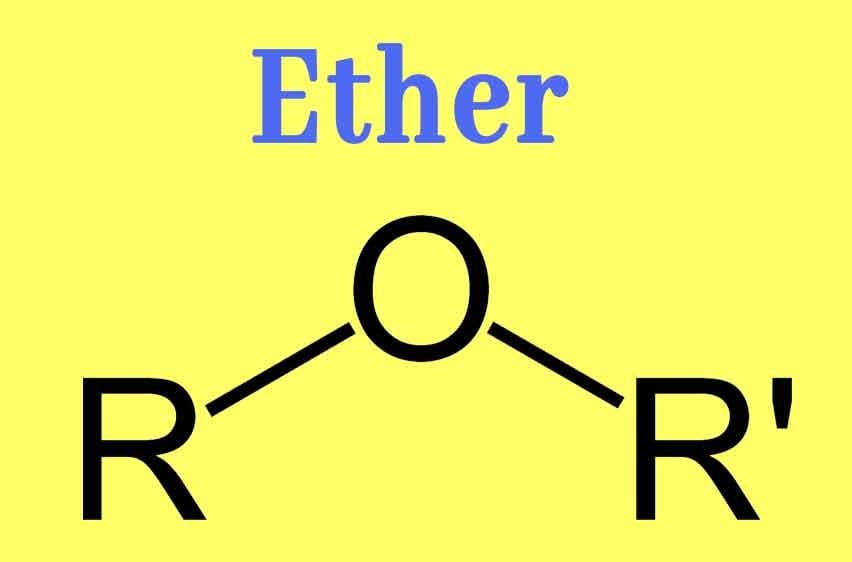
Ether trong hóa học là một lớp hợp chất hữu cơ có công thức chung R-O-R’, đặc trưng bởi một nguyên tử oxy liên kết với hai nhóm alkyl hoặc aryl. Diethyl ether ((C₂H₅)₂O) là dạng phổ biến nhất, được biết đến như một dung môi quan trọng và từng là thuốc mê trong y tế.
Trong lĩnh vực hóa học, ether là một lớp hợp chất hữu cơ có nhóm chức đặc trưng R-O-R’, trong đó một nguyên tử oxy liên kết với hai nhóm alkyl (R và R’) hoặc aryl. Khi nhắc đến ether, người ta thường nghĩ ngay đến diethyl ether ((C₂H₅)₂O), loại ether phổ biến nhất.

Tính chất vật lý nổi bật
Ether là chất lỏng không màu, có mùi đặc trưng, dễ bay hơi với điểm sôi thấp (34.6°C đối với diethyl ether), nhẹ hơn nước và là một dung môi hữu cơ hiệu quả nhưng ít tan trong nước.
- Trạng thái: Diethyl ether là chất lỏng không màu, linh động, có mùi ngọt đặc trưng nhưng hơi hắc.
- Dễ bay hơi: Nó có điểm sôi rất thấp, chỉ 34.6°C, nên bay hơi cực kỳ nhanh ở nhiệt độ phòng.
- Khả năng hòa tan: Là một dung môi hữu cơ aprotic quan trọng, ether có thể hòa tan tốt nhiều chất béo, dầu, sáp, nhựa và ancaloit. Tuy nhiên, nó lại ít tan trong nước.
- Tỷ trọng: Nhẹ hơn nước, với tỷ trọng khoảng 0.7134 g/cm³.
Tính chất hóa học quan trọng
Ether khá trơ nhưng có nguy cơ tạo thành peroxide dễ nổ khi tiếp xúc với không khí. Nó có thể phản ứng với axit mạnh và hoạt động như một bazơ Lewis yếu, tạo phức chất trong các phản ứng hóa học.
- Tạo Peroxide: Khi tiếp xúc lâu với không khí và ánh sáng, ether dễ dàng bị oxy hóa tạo thành các hợp chất peroxide không bền và cực kỳ dễ nổ. Đây là rủi ro lớn nhất khi bảo quản và sử dụng hóa chất này.
- Phản ứng với Axit mạnh: Ether có thể bị phân cắt bởi các axit mạnh như axit sunfuric (H₂SO₄) hoặc HBr ở nhiệt độ cao, tạo thành alcohol và alkyl halide.
- Là một bazơ Lewis: Do có cặp electron tự do trên nguyên tử oxy, ether có thể hoạt động như một bazơ Lewis yếu, tạo phức với các axit Lewis (ví dụ: trong phản ứng Grignard).
Phương pháp điều chế Ether phổ biến
Ether được điều chế chủ yếu bằng hai phương pháp: khử nước từ alcohol bằng axit sunfuric (phổ biến trong công nghiệp) hoặc tổng hợp Williamson, một phản ứng linh hoạt giữa alkoxide và alkyl halide.
- Dehydrat hóa Alken: Đây là phương pháp công nghiệp phổ biến để sản xuất diethyl ether. Quá trình này bao gồm việc đun nóng ethanol (ancol etylic) với axit sunfuric đậm đặc ở khoảng 140°C.
2C₂H₅OH ⟶ (C₂H₅)₂O + H₂O
- Tổng hợp Williamson: Đây là phương pháp linh hoạt nhất để điều chế các ether đối xứng và không đối xứng. Phản ứng diễn ra giữa một natri alkoxit (R’-ONa) và một alkyl halogenua (R-X).
R-X + R’-ONa ⟶ R-O-R’ + NaX
Ví dụ: Để điều chế methyl ethyl ether, người ta cho natri ethoxide phản ứng với methyl iodide.
Ứng dụng chính của Ether
Ether được ứng dụng rộng rãi làm dung môi trong công nghiệp sản xuất sơn và nhựa, chất chiết xuất trong phòng thí nghiệm, và trước đây là một loại thuốc gây mê quan trọng trong y học.
- Dung môi công nghiệp: Do khả năng hòa tan tốt và tính trơ, ether được dùng làm dung môi trong sản xuất nhựa, sơn, và trong các phản ứng hóa học như phản ứng Grignard. Nó là thành phần của một số loại dung môi công nghiệp như Toluene và Xylene.
- Chất chiết xuất: Dùng để chiết xuất các hợp chất hữu cơ từ thực vật và động vật.
- Thuốc mê (Lịch sử): Diethyl ether là một trong những loại thuốc mê toàn thân đầu tiên được sử dụng trong phẫu thuật. Tuy nhiên, do các tác dụng phụ và nguy cơ cháy nổ, nó đã được thay thế bằng các loại thuốc an toàn hơn.
- Chất khởi động động cơ: Hỗn hợp ether được sử dụng làm chất hỗ trợ khởi động cho động cơ diesel trong thời tiết lạnh.
Ether (ETH) Trong Tiền Điện Tử: “Nhiên Liệu” Của Mạng Ethereum
Ether (ETH) là tiền điện tử gốc của blockchain Ethereum. Nó hoạt động như “gas” để thanh toán phí giao dịch và thực thi hợp đồng thông minh, đồng thời là một tài sản kỹ thuật số có giá trị, nền tảng cho hệ sinh thái DeFi và dApps.
Hoàn toàn khác biệt với ether hóa học, Ether (ký hiệu: ETH) là đồng tiền điện tử bản địa của mạng lưới blockchain Ethereum, nền tảng hợp đồng thông minh lớn thứ hai thế giới sau Bitcoin.
Bản chất và vai trò
ETH đóng vai trò kép: vừa là “gas” để chi trả cho mọi hoạt động trên mạng Ethereum, vừa là một tài sản kỹ thuật số để đầu tư, lưu trữ giá trị và là xương sống của toàn bộ hệ sinh thái ứng dụng phi tập trung (dApps) và tài chính phi tập trung (DeFi).
- “Gas” của mạng lưới: Mọi giao dịch hoặc hoạt động trên mạng Ethereum, từ chuyển tiền, thực thi hợp đồng thông minh đến tạo NFT, đều yêu cầu một khoản phí gọi là “gas”. Phí này được thanh toán bằng ETH. Điều này tương tự như việc bạn cần xăng để chạy xe máy.
- Tài sản kỹ thuật số: Giống như Bitcoin, ETH là một tài sản có giá trị, có thể được mua, bán, giao dịch trên các sàn giao dịch và được sử dụng như một phương tiện lưu trữ giá trị. Tính đến cuối năm 2025, giá trị của ETH đã chứng tỏ sự tăng trưởng đáng kể.
- Nền tảng cho dApps và DeFi: ETH là nền tảng cho một hệ sinh thái tài chính phi tập trung (DeFi) và các ứng dụng phi tập trung (dApps) khổng lồ, từ cho vay, vay mượn đến các sàn giao dịch phi tập trung. Sau các bản nâng cấp quan trọng như Pectra, hiệu suất mạng lưới đã được cải thiện, giúp giảm phí và tăng tốc độ giao dịch cho các ứng dụng này.
Cách sở hữu và sử dụng ETH
Bạn có thể sở hữu ETH bằng cách mua trực tiếp trên các sàn giao dịch uy tín như Binance hoặc Coinbase. Sau khi mua, ETH được dùng để giao dịch, đầu tư, hoặc tham gia staking để kiếm phần thưởng, và nên được lưu trữ an toàn trong ví cá nhân.
- Mua trên sàn giao dịch: Cách phổ biến nhất là mua ETH trên các sàn giao dịch tập trung như Binance, Coinbase, Kraken.
- Staking: Người dùng có thể “stake” (khóa) ETH để trở thành một trình xác thực trên mạng lưới Ethereum và nhận phần thưởng là ETH mới. Bản nâng cấp Pectra đã giúp cơ chế staking linh hoạt hơn, cho phép gộp các khoản stake nhỏ.
- Lưu trữ: ETH nên được lưu trữ trong các ví cá nhân (ví nóng như MetaMask hoặc ví lạnh như Ledger, Trezor) để đảm bảo an toàn thay vì để trên sàn.
So Sánh Ether Hóa Học Và Ether Crypto (ETH)
Để tránh nhầm lẫn, hãy xem bảng so sánh chi tiết dưới đây:
| Đặc Điểm | Ether Hóa Học (Diethyl Ether) | Ether Crypto (ETH) |
|---|---|---|
| Bản Chất | Hợp chất hữu cơ, chất lỏng | Tiền kỹ thuật số, token trên blockchain |
| Công Thức | (C₂H₅)₂O | Token trên nền tảng Ethereum |
| Ứng Dụng | Dung môi, chất chiết xuất, thuốc mê (cũ) | Thanh toán phí “gas”, staking, đầu tư, DeFi |
| Rủi Ro | Dễ cháy nổ, độc hại khi hít phải | Biến động giá mạnh, rủi ro bị hack, lừa đảo |
| Giá trị (cuối 2025) | Khoảng 350.000 – 500.000 VND/lít (tùy độ tinh khiết) | ~4.500 USD (~115.000.000 VND)/ETH |
| Lưu Trữ | Bình chứa chuyên dụng, nơi thoáng mát | Ví tiền điện tử (nóng/lạnh) |
Những Lưu Ý Quan Trọng Về An Toàn Và Pháp Lý
An toàn hóa học
Ether hóa học là chất lỏng cực kỳ dễ cháy và có thể tạo peroxide gây nổ. Cần lưu trữ xa nguồn nhiệt, sử dụng thiết bị bảo hộ cá nhân (găng tay, kính) và đảm bảo không gian làm việc luôn thông thoáng.
Ether là hóa chất cực kỳ dễ cháy. Tuyệt đối không lưu trữ gần nguồn lửa hoặc nơi có nhiệt độ cao. Khi sử dụng phải đeo găng tay, kính bảo hộ và làm việc ở nơi thông thoáng. Việc hít phải hơi ether có thể gây chóng mặt, buồn nôn và mất ý thức.
An toàn Crypto
Để bảo vệ ETH, hãy kích hoạt xác thực hai yếu tố (2FA), cảnh giác với các email và trang web lừa đảo (phishing), và không bao giờ tiết lộ cụm từ khôi phục ví (seed phrase) cho bất kỳ ai.
Luôn sử dụng xác thực hai yếu tố (2FA) cho tài khoản sàn. Cảnh giác với các chiêu trò lừa đảo (phishing). Không bao giờ chia sẻ cụm từ khôi phục ví của bạn cho bất kỳ ai.
Khía cạnh pháp lý
Tại Việt Nam, ether hóa học là một hóa chất chịu sự quản lý chặt chẽ của pháp luật. Đối với Ether (ETH), pháp luật chưa công nhận là phương tiện thanh toán nhưng không cấm các hoạt động đầu tư, mua bán và lưu trữ.
Ở Việt Nam, ether hóa học là một hóa chất được quản lý. Trong khi đó, tiền điện tử ETH chưa được công nhận là phương tiện thanh toán hợp pháp nhưng việc đầu tư và lưu trữ không bị cấm.
Câu Hỏi Thường Gặp (FAQ)
1. Ether có phải là cồn (alcohol) không?
Không. Ether và alcohol là hai lớp hợp chất hữu cơ khác nhau. Mặc dù ether có thể được điều chế từ ancol, chúng có cấu trúc và tính chất hóa học riêng biệt.
2. Làm sao để phân biệt các loại ether?
Tên của ether được xác định bởi hai nhóm hữu cơ (alkyl hoặc aryl) liên kết với nguyên tử oxy. Ví dụ, Diethyl ether có hai nhóm ethyl, trong khi Methyl propyl ether có một nhóm methyl và một nhóm propyl.
3. Mua ETH có cần nhiều tiền không?
Không. Bạn không cần phải mua một ETH nguyên vẹn. Các sàn giao dịch cho phép mua một phần nhỏ của ETH (ví dụ: 0.001 ETH), giúp bạn có thể bắt đầu đầu tư chỉ với vài trăm nghìn đồng.
4. ETH và Bitcoin khác nhau như thế nào?
Điểm khác biệt cốt lõi là khả năng lập trình. Bitcoin chủ yếu đóng vai trò là “vàng kỹ thuật số” – một mạng lưới thanh toán và lưu trữ giá trị. Ngược lại, Ethereum là một “máy tính toàn cầu” cho phép các nhà phát triển xây dựng ứng dụng phi tập trung và hợp đồng thông minh, với ETH là nhiên liệu vận hành.
Hy vọng bài viết đã cung cấp cho bạn một cái nhìn toàn diện và dễ hiểu về “Ether” ở cả hai lĩnh vực. Nếu bạn có nhu cầu tìm hiểu thêm hoặc mua các loại dung môi, hóa chất công nghiệp, đừng ngần ngại liên hệ với Hóa chất Doanh Tín để được tư vấn chi tiết.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










