Kiến thức chuyên môn
S Hóa Trị Mấy? Hướng Dẫn Toàn Diện Về Lưu Huỳnh Công Nghiệp
Lưu huỳnh (Sulfur), một nguyên tố quen thuộc trong bảng tuần hoàn hóa học, không chỉ là câu hỏi trong sách giáo khoa mà còn là một trong những hóa chất nền tảng quan trọng bậc nhất của nền kinh tế công nghiệp toàn cầu. Theo thống kê, hơn 90% lượng lưu huỳnh sản xuất ra được dùng để điều chế acid sulfuric – “máu” của hàng loạt ngành công nghiệp.
Vậy, câu hỏi S hóa trị mấy? chỉ là điểm khởi đầu. Để thực sự khai thác hiệu quả và an toàn nguyên tố này, doanh nghiệp cần một sự am hiểu sâu sắc hơn về các tính chất, tiêu chuẩn kỹ thuật và ứng dụng chuyên sâu của nó.
Trong bài viết này, đội ngũ chuyên gia của Hóa Chất Doanh Tín sẽ cung cấp một góc nhìn toàn diện, từ kiến thức hóa học cơ bản đến những thông tin chuyên ngành dành riêng cho các đối tác công nghiệp.
1. Nền Tảng Cần Biết: Lưu Huỳnh (S) Có Hóa Trị Mấy?
Hóa trị của lưu huỳnh rất linh hoạt, phổ biến nhất là II, IV, và VI.

Sự đa dạng về hóa trị này xuất phát từ cấu hình electron của lưu huỳnh [Ne] 3s²3p⁴. Khi tham gia vào các liên kết cộng hóa trị, các electron ở phân lớp 3p và 3s có thể được kích thích lên phân lớp 3d còn trống, tạo ra số electron độc thân khác nhau và do đó, có các hóa trị khác nhau. Điều này giải thích tại sao lưu huỳnh có thể tham gia vào nhiều loại phản ứng hóa học khác nhau.
- Hóa trị II (-2): Đây là trạng thái phổ biến nhất khi S kết hợp với các nguyên tố có độ âm điện thấp hơn như hydro và kim loại. Ở đây, lưu huỳnh thể hiện vai trò của một chất oxi hóa. Các hợp chất tạo thành thường là các muối sulfide (ví dụ: FeS) và khí H₂S.
- Hóa trị IV (+4): Khi S tác dụng với nguyên tố có độ âm điện cao hơn như oxygen, tạo ra lưu huỳnh đioxit (SO₂).
- Hóa trị VI (+6): Đây là trạng thái oxi hóa cao nhất, thể hiện tính khử mạnh của S khi tác dụng với các chất oxi hóa mạnh nhất, tạo thành lưu huỳnh trioxit (SO₃) và hợp chất quen thuộc là axit sulfuric (H₂SO₄).
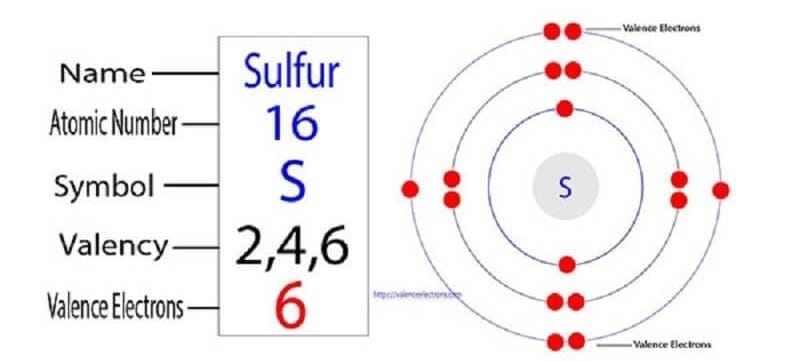
Hiểu rõ S hóa trị mấy trong từng hợp chất giúp các kỹ sư hóa học dự đoán được tính chất, khả năng phản ứng và ứng dụng phù hợp của chúng trong sản xuất.
Góc nhìn chuyên gia – Nguyễn Thị Mỹ Linh
“Việc xác định đúng hóa trị và số oxi hóa của lưu huỳnh trong một hợp chất không chỉ là lý thuyết. Trong thực tế, nó quyết định việc lựa chọn chất xúc tác, nhiệt độ và áp suất phản ứng để đạt hiệu suất chuyển hóa cao nhất, giúp khách hàng của chúng tôi tiết kiệm chi phí và tối ưu hóa sản xuất.”
2. Tính Chất Vật Lý Của Lưu Huỳnh Và Ý Nghĩa Trong Công Nghiệp Là Gì?
Câu trả lời ngắn gọn: Tính chất vật lý của lưu huỳnh, như trạng thái rắn màu vàng, các dạng thù hình, và điểm nóng chảy/sôi, ảnh hưởng trực tiếp đến việc bảo quản, vận chuyển và ứng dụng công nghiệp của nó.

Các đặc tính vật lý của lưu huỳnh không chỉ là thông tin lý thuyết mà còn có ý nghĩa thực tiễn quan trọng. Ví dụ, việc lưu huỳnh không tan trong nước nhưng tan trong dung môi hữu cơ quyết định phương pháp làm sạch và xử lý sự cố tràn đổ. Sự thay đổi độ nhớt theo nhiệt độ là một thông số quan trọng cần kiểm soát trong các lò đốt lưu huỳnh để sản xuất SO₂.
- Trạng thái & Màu sắc: Ở điều kiện tiêu chuẩn, lưu huỳnh là một đơn chất rắn, không mùi, không vị, có màu vàng chanh đặc trưng.
- Các Dạng Thù Hình: Lưu huỳnh tồn tại ở hai dạng tinh thể chính là tà phương (α-sulfur) và đơn tà (β-sulfur), bền ở các ngưỡng nhiệt độ khác nhau. Sự chuyển đổi giữa hai dạng này có thể ảnh hưởng đến thể tích và tính chất cơ học của vật liệu chứa lưu huỳnh.
- Nhiệt độ nóng chảy & sôi: Nóng chảy ở khoảng 115.2 °C và sôi ở 444.6 °C. Khi nhiệt độ tăng, độ nhớt của lưu huỳnh lỏng thay đổi một cách bất thường, đây là một yếu tố kỹ thuật cần được kiểm soát chặt chẽ.
- Tính tan: Lưu huỳnh không tan trong nước nhưng tan nhiều trong các dung môi không phân cực như carbon disulfide (CS₂).
3. Phân Tích Chuyên Sâu Tính Chất Hóa Học Của Lưu Huỳnh (S) Như Thế Nào?
Câu trả lời ngắn gọn: Lưu huỳnh thể hiện cả tính oxi hóa (khi phản ứng với kim loại, hydro) và tính khử (khi phản ứng với oxy, axit mạnh), tùy thuộc vào chất mà nó tác dụng.
Sự linh hoạt về số oxi hóa mang lại cho lưu huỳnh các tính chất hóa học đặc trưng, cho phép nó tham gia vào một loạt các phản ứng quan trọng trong công nghiệp. Khả năng vừa là chất oxi hóa, vừa là chất khử là chìa khóa cho sự đa dạng trong ứng dụng của nó.
Tính Oxi Hóa của Lưu huỳnh được thể hiện ra sao?
Khi đun nóng, lưu huỳnh phản ứng trực tiếp với hầu hết các kim loại (trừ Au, Pt) và hydro. Trong các phản ứng này, lưu huỳnh nhận electron và thể hiện tính oxi hóa. Phản ứng này là cơ sở cho nhiều quy trình luyện kim và xử lý hóa chất. Tuy nhiên, sản phẩm phụ như hydro sulfide (H₂S) là một chất khí rất độc, đòi hỏi quy trình sản xuất phải có hệ thống kiểm soát an toàn nghiêm ngặt.
Tính Khử của Lưu huỳnh được thể hiện ra sao?
Khi tác dụng với các chất có độ âm điện lớn hơn (như oxy, clo, flo), lưu huỳnh nhường electron và thể hiện tính khử. Đây là nhóm phản ứng quan trọng nhất trong công nghiệp, đặc biệt là phản ứng với oxy để tạo ra SO₂ – bước đầu tiên trong quy trình sản xuất Acid Sulfuric 98%. Nó cũng phản ứng với các axit mạnh như Axit Nitric (HNO₃).
4. Quy Trình Sản Xuất & Tiêu Chuẩn Lưu Huỳnh Công Nghiệp Là Gì?
Câu trả lời ngắn gọn: Lưu huỳnh chủ yếu được sản xuất qua quy trình Claus (thu hồi từ khí thải) và phải tuân thủ các tiêu chuẩn chất lượng như TCVN 6650:2000 tại Việt Nam.
Chất lượng lưu huỳnh ảnh hưởng trực tiếp đến hiệu suất phản ứng và chất lượng sản phẩm cuối cùng. Do đó, việc kiểm soát quy trình sản xuất và tuân thủ các tiêu chuẩn là vô cùng quan trọng đối với các nhà cung cấp uy tín.
Các Phương Pháp Sản Xuất Chính là gì?
Phổ biến nhất hiện nay là quy trình Claus, thu hồi lưu huỳnh từ các khí thải chứa H₂S của nhà máy lọc dầu. Quy trình này không chỉ kinh tế mà còn góp phần bảo vệ môi trường bằng cách giảm phát thải khí độc. So với phương pháp Frasch truyền thống (dùng nước nóng để khai thác), quy trình Claus chiếm ưu thế trong sản xuất lưu huỳnh toàn cầu, chiếm hơn 95% tổng sản lượng.
Tiêu Chuẩn Chất Lượng tại Việt Nam là gì?
Lưu huỳnh công nghiệp cần đáp ứng TCVN 6650:2000 về các chỉ tiêu như hàm lượng lưu huỳnh (thường trên 99.5%), độ tro, hàm lượng axit, và độ ẩm. Việc tuân thủ không chỉ đảm bảo chất lượng mà còn phù hợp với các điểm mới của Luật Hóa chất 2025.
Tải Về Bảng Tiêu Chuẩn Kỹ Thuật Lưu Huỳnh (PDF)
Nhận ngay tài liệu chi tiết về TCVN 6650:2000 và thông số kỹ thuật sản phẩm lưu huỳnh của Doanh Tín.
5. Những Ứng Dụng Then Chốt Của Lưu Huỳnh Trong Các Ngành Công Nghiệp Là Gì?
Câu trả lời ngắn gọn: Ứng dụng quan trọng nhất là sản xuất axit sulfuric, tiếp theo là trong nông nghiệp (phân bón, thuốc trừ sâu), và lưu hóa cao su.
Giá trị của lưu huỳnh được thể hiện rõ nét qua các ứng dụng đa dạng và không thể thay thế trong nhiều lĩnh vực sản xuất cốt lõi. Sản lượng tiêu thụ lưu huỳnh toàn cầu là một chỉ số quan trọng phản ánh sức khỏe của nền kinh tế công nghiệp.
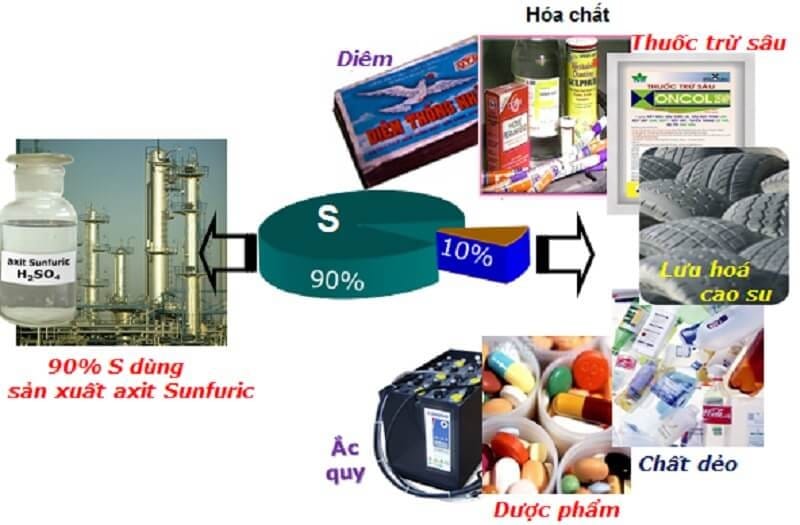
- Sản xuất Acid Sulfuric (H₂SO₄): Đây là ứng dụng chiếm ưu thế tuyệt đối. H₂SO₄ 98% là hóa chất được sử dụng trong sản xuất phân bón, lọc dầu, xử lý nước thải bằng hóa chất PAC, sản xuất thuốc nổ, và hàng ngàn quy trình khác.
- Nông nghiệp: Là thành phần chính trong nhiều loại phân bón như supephotphat (cung cấp dinh dưỡng lưu huỳnh cho cây trồng) và là hoạt chất trong các loại thuốc diệt nấm, trừ sâu hiệu quả.
- Lưu hóa Cao su: Lưu huỳnh là tác nhân “khâu mạch” các chuỗi polymer của cao su, tạo ra vật liệu có độ bền, độ đàn hồi và khả năng chịu nhiệt vượt trội, ứng dụng trong sản xuất lốp xe, ống dẫn, gioăng…
- Các ứng dụng khác: Sản xuất diêm, thuốc súng, dược phẩm, thuốc nhuộm, và gần đây là các nghiên cứu đột phá về pin Lithium-Sulfur (Li-S), hứa hẹn mang lại các giải pháp lưu trữ năng lượng hiệu quả hơn.
Case Study: Tối ưu hóa năng suất tại Tây Nguyên
Tại một nông trường cà phê lớn ở Tây Nguyên đối mặt với vấn đề đất bạc màu, chúng tôi đã tư vấn sử dụng phân bón gốc sunfat và cung cấp lưu huỳnh bột chất lượng cao. Kết quả, năng suất tăng 15% và tỉ lệ cây nhiễm bệnh giảm 40%, minh chứng cho hiệu quả kinh tế rõ rệt.
6. Các Câu Hỏi Thường Gặp (FAQ) Về Lưu Huỳnh
Lưu huỳnh có độc hại với con người không?
Câu trả lời ngắn gọn: Lưu huỳnh nguyên tố không độc, nhưng bụi và các hợp chất khí của nó (H₂S, SO₂) lại rất độc.
Lưu huỳnh nguyên tố không được xem là chất độc khi tiếp xúc qua da, nhưng bụi của nó có thể gây kích ứng mắt và hệ hô hấp. Nguy hiểm thực sự đến từ các hợp chất của nó. Do đó, việc tuân thủ nghiêm ngặt các biện pháp an toàn và bảo quản hóa chất (sử dụng đồ bảo hộ cá nhân như kính, khẩu trang, găng tay) là bắt buộc.
Tại sao lưu huỳnh lại quan trọng cho cây trồng?
Câu trả lời ngắn gọn: Lưu huỳnh là một dưỡng chất thiết yếu, cần thiết cho việc hình thành protein và enzyme trong cây.
Lưu huỳnh là một trong 17 dưỡng chất thiết yếu cho thực vật. Nó tham gia vào quá trình hình thành protein, axit amin (methionine, cysteine) và enzyme. Việc thiếu hụt lưu huỳnh có thể dẫn đến tình trạng vàng lá, còi cọc và giảm năng suất, do đó nó là thành phần không thể thiếu trong các loại phân bón hiện đại.
Hóa Chất Doanh Tín cung cấp lưu huỳnh ở dạng nào?
Câu trả lời ngắn gọn: Chúng tôi cung cấp lưu huỳnh công nghiệp ở nhiều dạng như bột, vảy, và hạt với quy cách đóng gói đa dạng.
Chúng tôi cung cấp lưu huỳnh công nghiệp chất lượng cao, đáp ứng TCVN, ở nhiều dạng khác nhau như bột, vảy, và hạt, với quy cách đóng gói đa dạng (bao 25kg, 50kg, bao jumbo) để phù hợp với mọi quy mô sản xuất của khách hàng.
Làm thế nào để nhận báo giá lưu huỳnh công nghiệp?
Câu trả lời ngắn gọn: Quý khách có thể điền vào form yêu cầu trên website hoặc gọi trực tiếp đến hotline của chúng tôi.
Quý khách hàng vui lòng điền vào form yêu cầu bên dưới hoặc gọi trực tiếp đến hotline của chúng tôi để nhận được báo giá cạnh tranh và tư vấn kỹ thuật nhanh chóng nhất từ đội ngũ chuyên gia.
7. Kết Luận Cuối Cùng Là Gì?
Câu trả lời ngắn gọn: Hiểu biết về lưu huỳnh vượt xa câu hỏi về hóa trị; đó là chìa khóa để ứng dụng hiệu quả và an toàn trong công nghiệp.
Việc hiểu S hóa trị mấy? chỉ là bước đầu tiên. Với vai trò là đối tác tin cậy, Hóa Chất Doanh Tín không chỉ cung cấp sản phẩm đạt chuẩn mà còn mang đến giải pháp kỹ thuật, giúp doanh nghiệp tối ưu hóa sản xuất, đảm bảo an toàn và nâng cao hiệu quả.
Cần Tư Vấn Kỹ Thuật Chuyên Sâu Về Lưu Huỳnh?
Đội ngũ kỹ sư của chúng tôi sẵn sàng giải đáp mọi thắc mắc và giúp bạn chọn lựa sản phẩm phù hợp nhất với dây chuyền sản xuất của mình.
Tuyên bố miễn trừ trách nhiệm (Disclaimer):
Thông tin trong bài viết này chỉ mang tính chất tham khảo. Việc sử dụng, bảo quản và xử lý hóa chất phải luôn tuân thủ các quy định an toàn và Luật Hóa chất hiện hành của pháp luật Việt Nam. Vui lòng liên hệ trực tiếp với chúng tôi để nhận được tư vấn kỹ thuật chính xác cho ứng dụng của bạn.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →





