Kiến thức chuyên môn
Tính Chất Hóa Học Của Muối & Ứng Dụng Trong Công Nghiệp
Muối, một hợp chất tưởng chừng quen thuộc trong đời sống, lại là nền tảng cho vô số quy trình sản xuất công nghiệp hiện đại. Vượt ra ngoài vai trò gia vị, sự am hiểu sâu sắc về tính chất hóa học của muối chính là chìa khóa để tối ưu hóa hiệu suất, đảm bảo chất lượng sản phẩm và tuân thủ các tiêu chuẩn an toàn nghiêm ngặt.
Bài viết này, được chuyên gia tại Hóa Chất Doanh Tín biên soạn, sẽ không chỉ hệ thống hóa kiến thức hóa học nền tảng mà còn đi sâu vào các ứng dụng kỹ thuật, cung cấp một góc nhìn toàn diện cho các đối tác trong ngành.

Muối là gì và được phân loại theo tiêu chuẩn công nghiệp như thế nào?
Muối là hợp chất hóa học tạo thành khi cation (thường là kim loại) thay thế ion hydro trong axit. Trong công nghiệp, muối được phân loại theo cấu tạo hóa học (trung hòa, axit, bazơ, phức) và theo độ tinh khiết (công nghiệp, thực phẩm, dược phẩm).
Trong hóa học, cation (ion dương, thường là kim loại hoặc amoni NH₄⁺) kết hợp với anion gốc axit thông qua một liên kết ion mạnh mẽ, tạo nên cấu trúc tinh thể bền vững với các đặc tính độc đáo. Sự phân loại này là yếu tố cốt lõi để xác định ứng dụng phù hợp cho từng loại muối trong sản xuất.
Phân loại theo cấu tạo hóa học của muối là gì?
Dựa trên thành phần ion, muối được chia thành bốn loại chính: muối trung hòa, muối axit, muối bazơ và muối phức, mỗi loại có những đặc tính và ứng dụng riêng biệt.
- Muối trung hòa: Là loại muối phổ biến nhất, trong gốc axit không còn hydro có khả năng phân ly ra H⁺. Ví dụ: NaCl, CuSO₄, Na₂CO₃.
- Muối axit: Trong anion gốc axit vẫn còn hydro có khả năng phân ly. Ví dụ: NaHCO₃, NaHSO₄. Chúng thường được dùng làm chất đệm pH.
- Muối bazơ: Ngoài cation kim loại và anion gốc axit, trong phân tử còn có nhóm hidroxyl (OH⁻). Ví dụ: Mg(OH)Cl.
- Muối phức: Được tạo thành từ sự kết hợp của các ion đơn giản, tạo ra ion phức. Ví dụ: K₃[Fe(CN)₆].
Phân loại theo ứng dụng và độ tinh khiết của muối có ý nghĩa gì đối với khách hàng B2B?
Đối với khách hàng B2B, việc phân loại muối theo cấp độ (Grade) công nghiệp, thực phẩm, và dược phẩm là quan trọng nhất, vì nó quyết định trực tiếp đến sự phù hợp, chi phí và tuân thủ tiêu chuẩn an toàn của sản phẩm cuối cùng.
- Grade Công nghiệp (Industrial Grade): Sử dụng cho các quy trình sản xuất không yêu cầu độ tinh khiết tuyệt đối như xử lý nước, sản xuất chất tẩy rửa, dệt nhuộm.
- Grade Thực phẩm (Food Grade): Đáp ứng các tiêu chuẩn an toàn nghiêm ngặt để sử dụng làm phụ gia thực phẩm.
- Grade Dược phẩm (Pharmaceutical Grade): Có độ tinh khiết cao nhất, dùng trong sản xuất dược phẩm, dung dịch y tế.
Góc nhìn Doanh Tín: Việc lựa chọn đúng “grade” muối giúp doanh nghiệp tối ưu chi phí mà vẫn đảm bảo tuân thủ các tiêu chuẩn chất lượng cho sản phẩm cuối cùng.
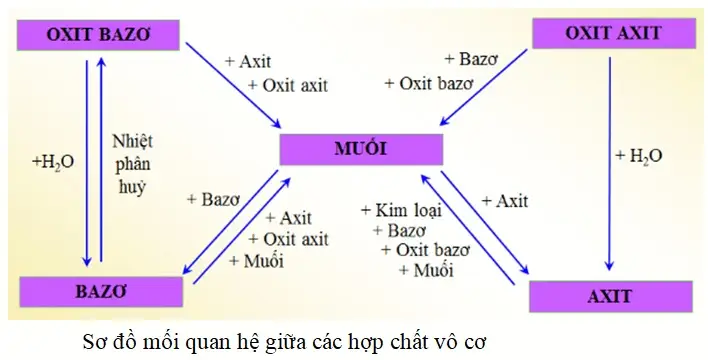
Những tính chất hóa học đặc trưng của muối là gì?
Muối có năm tính chất hóa học đặc trưng: tác dụng với kim loại, tác dụng với axit, tác dụng với bazơ, phản ứng với dung dịch muối khác và phản ứng nhiệt phân. Việc hiểu rõ các phản ứng này là nền tảng để kiểm soát và ứng dụng chúng hiệu quả trong sản xuất.
Muối tác dụng với kim loại theo nguyên tắc nào?
Muối tác dụng với kim loại theo nguyên tắc kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi dung dịch muối của nó, tuân thủ nghiêm ngặt theo dãy điện hóa của kim loại.
Điều kiện: Kim loại tham gia phản ứng phải mạnh hơn (đứng trước) kim loại trong muối trong dãy điện hóa.
Ví dụ công nghiệp: Thả Sắt (Fe) vào dung dịch Đồng(II) Sunfat để thu hồi Đồng (Cu).
Fe(r) + CuSO₄(dd) → FeSO₄(dd) + Cu(r)
Khi nào muối tác dụng với axit?
Muối tác dụng với axit khi sản phẩm của phản ứng tạo thành ít nhất một chất kết tủa, chất khí bay hơi hoặc một chất điện li yếu. Đây là một dạng của phản ứng trao đổi.
Ứng dụng thực tiễn: Sử dụng axit HCl để sản xuất khí CO₂ từ đá vôi (CaCO₃) trong công nghiệp.
CaCO₃(r) + 2HCl(dd) → CaCl₂(dd) + H₂O(l) + CO₂(k)↑
Khi nào muối tác dụng với bazơ?
Dung dịch muối tác dụng với dung dịch bazơ (kiềm) khi sản phẩm tạo thành một bazơ mới không tan (kết tủa) hoặc một muối mới không tan.
Ứng dụng trong xử lý nước: Dùng Natri Hidroxit (NaOH) để loại bỏ các ion kim loại nặng như Cu²⁺ ra khỏi nước thải.
CuSO₄(dd) + 2NaOH(dd) → Cu(OH)₂(r)↓ + Na₂SO₄(dd)
Khi nào hai dung dịch muối phản ứng với nhau?
Hai dung dịch muối phản ứng với nhau theo nguyên tắc trao đổi ion, nghĩa là phản ứng xảy ra khi sản phẩm tạo thành có ít nhất một chất kết tủa (không tan).
Ví dụ kinh điển: Phản ứng giữa Bạc Nitrat (AgNO₃) và Natri Clorua (NaCl) tạo ra kết tủa trắng Bạc Clorua (AgCl), thường dùng để nhận biết ion Cl⁻.
AgNO₃(dd) + NaCl(dd) → AgCl(r)↓ + NaNO₃(dd)
Phản ứng nhiệt phân của muối diễn ra như thế nào?
Phản ứng nhiệt phân là sự phân hủy của muối dưới tác dụng của nhiệt độ cao. Sản phẩm của phản ứng phụ thuộc vào bản chất của kim loại và gốc axit tạo nên muối, quyết định đến độ bền nhiệt và giới hạn ứng dụng của chúng. Đây có thể là một phản ứng tỏa nhiệt hoặc thu nhiệt đặc trưng.
Phản ứng nhiệt phân của muối Cacbonat (CO₃²⁻) có đặc điểm gì?
Muối cacbonat của kim loại kiềm rất bền với nhiệt, trong khi các muối cacbonat của kim loại khác thường dễ bị nhiệt phân để tạo thành oxit kim loại tương ứng và giải phóng khí cacbonic (CO₂).
Ứng dụng: Nung đá vôi (CaCO₃) để sản xuất vôi sống (CaO) trong ngành xây dựng.
CaCO₃(r) --t°--> CaO(r) + CO₂(k)
Phản ứng nhiệt phân của muối Nitrat (NO₃⁻) có phức tạp không?
Có, phản ứng nhiệt phân muối nitrat khá phức tạp và sản phẩm tạo thành phụ thuộc vào vị trí của kim loại trong dãy hoạt động hóa học.
- Kim loại hoạt động mạnh (trước Mg): Tạo muối nitrit và O₂.
2KNO₃(r) --t°--> 2KNO₂(r) + O₂(k) - Kim loại từ Mg đến Cu: Tạo oxit kim loại, khí NO₂ và O₂.
- Kim loại yếu (sau Cu): Tạo thành kim loại, khí NO₂ và O₂.
Làm thế nào để lưu trữ và sử dụng muối công nghiệp an toàn?
Để đảm bảo an toàn, cần bảo quản hóa chất và muối công nghiệp ở nơi khô ráo, thoáng mát, tuân thủ nghiêm ngặt các quy định về ghi nhãn GHS và trang bị đầy đủ đồ bảo hộ lao động (BHLĐ) khi tiếp xúc.
Insight từ Nguyễn Thị Mỹ Linh, Trưởng phòng Kỹ thuật Hóa Chất Doanh Tín: “Việc bảo quản hóa chất đúng cách là yếu tố then chốt. Muối công nghiệp có tính hút ẩm cao, nếu lưu trữ sai sẽ bị vón cục, ảnh hưởng đến chất lượng và an toàn. Đặc biệt với các muối có tính ăn mòn như CaCl₂, việc lựa chọn vật liệu chứa là cực kỳ quan trọng.”
- Lưu trữ: Bảo quản nơi khô ráo, thoáng mát.
- An toàn: Tuân thủ các quy định về ghi nhãn hóa chất theo GHS, trang bị đầy đủ BHLĐ.
- Tương thích: Không lưu trữ chung với các axit mạnh hoặc chất oxy hóa mạnh.
Bảng tính tan có tầm quan trọng như thế nào trong sản xuất?
Bảng tính tan là công cụ không thể thiếu, giúp dự đoán khả năng xảy ra phản ứng trao đổi ion, từ đó kiểm soát hiệu quả quá trình kết tủa, tinh chế sản phẩm và xử lý chất thải trong công nghiệp.
Việc nắm vững các quy luật về độ tan của các loại muối khác nhau cho phép các kỹ sư hóa học thiết kế quy trình sản xuất một cách chính xác và hiệu quả.
- Hầu hết muối Nitrat (NO₃⁻) và muối của kim loại kiềm (Na⁺, K⁺) đều tan.
- Hầu hết muối Clorua (Cl⁻) đều tan (trừ AgCl, PbCl₂).
- Hầu hết muối Sunfat (SO₄²⁻) đều tan (trừ BaSO₄, PbSO₄, CaSO₄).
- Hầu hết muối Cacbonat (CO₃²⁻) và Photphat (PO₄³⁻) không tan (trừ muối của kim loại kiềm và amoni).
Muối có những ứng dụng chuyên sâu nào trong các ngành công nghiệp?
Muối là hóa chất nền tảng trong nhiều ngành công nghiệp then chốt, bao gồm sản xuất hóa chất, xử lý nước, dệt nhuộm, sản xuất thủy tinh và nông nghiệp, đóng vai trò từ nguyên liệu thô đến chất xúc tác và phụ gia.
- Công nghiệp Hóa chất: NaCl là nguyên liệu cho quá trình điện phân dung dịch để sản xuất NaOH, Cl₂ (tuân thủ quy định về quản lý khí Clo), và H₂.
- Xử lý nước: Các loại muối như phèn nhôm và PAC (Poly Aluminium Chloride) được dùng làm chất keo tụ.
- Dệt nhuộm: Natri Sunfat (Na₂SO₄) được sử dụng để tăng khả năng bắt màu.
- Sản xuất Thủy tinh: Natri Cacbonat (Na₂CO₃) là chất trợ dung.
- Nông nghiệp: Các muối như Kali Nitrat (KNO₃) và phân Urea cung cấp dinh dưỡng cho cây trồng.

Case Study: Giải Pháp Xử Lý Nước Cho Nhà Máy Dệt May XYZ
Thách thức: Nước thải có độ màu cao, không đạt chuẩn.
Giải pháp: Đội ngũ Doanh Tín đã tư vấn sử dụng kết hợp PAC Vàng Chanh (để keo tụ) và Xút Lỏng (NaOH) (để điều chỉnh pH).
Kết quả: Nước thải sau xử lý đạt tiêu chuẩn, giúp doanh nghiệp tiết kiệm chi phí và nâng cao uy tín.
Các câu hỏi thường gặp (FAQ) về muối công nghiệp là gì?
Làm thế nào để phân biệt muối công nghiệp và muối ăn?
Muối ăn có độ tinh khiết rất cao, đã được loại bỏ tạp chất và thường được bổ sung i-ốt, an toàn cho tiêu dùng. Ngược lại, muối công nghiệp có độ tinh khiết thấp hơn và chứa các tạp chất không an toàn cho thực phẩm.
Tại sao muối lại được dùng để làm mềm nước?
Muối NaCl được dùng trong quá trình tái sinh (hoàn nguyên) các hạt nhựa trao đổi ion. Các ion Na⁺ trong dung dịch muối sẽ thay thế các ion Ca²⁺ và Mg²⁺ (gây ra độ cứng) đang bám trên bề mặt hạt nhựa, khôi phục khả năng làm mềm nước của hệ thống.
Tiêu chuẩn TCVN nào áp dụng cho muối công nghiệp?
Tiêu chuẩn quốc gia chính áp dụng cho muối công nghiệp là TCVN 3974:2014. Ngoài ra, các doanh nghiệp cần liên tục cập nhật các điểm mới của Luật Hóa chất 2025 để đảm bảo tuân thủ đầy đủ các quy định pháp luật hiện hành.
Kết luận
Việc nắm vững tính chất hóa học của muối không chỉ là kiến thức cơ bản mà còn là một lợi thế cạnh tranh trong môi trường công nghiệp. Từ việc dự đoán phản ứng đến lựa chọn nguyên liệu, mọi quy trình đều đòi hỏi sự am hiểu sâu sắc.
Hóa Chất Doanh Tín tự hào là đối tác đồng hành, sẵn sàng cung cấp các sản phẩm hóa chất công nghiệp đạt chuẩn từ cửa hàng của chúng tôi, cùng dịch vụ tư vấn kỹ thuật chuyên sâu, giúp doanh nghiệp của bạn vận hành hiệu quả và bền vững.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →