Kiến thức chuyên môn
Oxit Bazơ là gì? Định Nghĩa, Tính Chất, Phân Loại và Ứng Dụng
Trong thế giới hóa học, các hợp chất được phân loại dựa trên tính chất và thành phần cấu tạo của chúng. Oxit bazơ là một trong những nhóm hợp chất vô cơ quan trọng và phổ biến nhất, đóng vai trò nền tảng trong cả lý thuyết và ứng dụng thực tiễn.
Vậy oxit bazơ là gì? Làm thế nào để nhận biết và phân loại chúng? Hãy cùng Hóa chất Doanh Tín tìm hiểu chi tiết từ A-Z trong bài viết này.
Định Nghĩa Oxit Bazơ
Oxit bazơ là hợp chất tạo bởi nguyên tố kim loại và oxy, có tính chất của một bazơ, đặc trưng bởi khả năng tác dụng với axit để tạo thành sản phẩm là muối và nước.
Oxit bazơ (Basic Oxide) là oxit của kim loại và có tính chất của một bazơ. Đặc điểm cơ bản nhất của chúng là khả năng tác dụng với axit để tạo thành muối và nước.
- Ví dụ phương trình phản ứng:
Canxi oxit (CaO), một oxit bazơ, phản ứng với axit clohidric (HCl) tạo ra muối Canxi clorua (CaCl₂) và nước.
CaO + 2HCl ⟶ CaCl₂ + H₂O
Đặc Điểm Chính Của Oxit Bazơ
- Thành phần: Là sự kết hợp giữa một nguyên tố kim loại (thường là kim loại kiềm hoặc kim loại kiềm thổ) với oxy.
- Tính chất hóa học: Có khả năng tham gia phản ứng trung hòa với axit. Một số oxit bazơ có thể tan trong nước để tạo thành dung dịch kiềm (bazơ).
- Trạng thái: Hầu hết các oxit bazơ tồn tại ở trạng thái rắn trong điều kiện tiêu chuẩn.
Cách Nhận Biết Oxit Bazơ
Để nhận biết oxit bazơ, hãy kiểm tra công thức hóa học (là oxit của kim loại), thử phản ứng với axit (tạo ra muối và nước), hoặc hòa tan vào nước (nếu tan, dung dịch sẽ làm xanh giấy quỳ tím).
Để xác định một oxit có phải là oxit bazơ hay không, bạn có thể dựa vào các phương pháp cập nhật mới nhất năm 2025 sau đây:
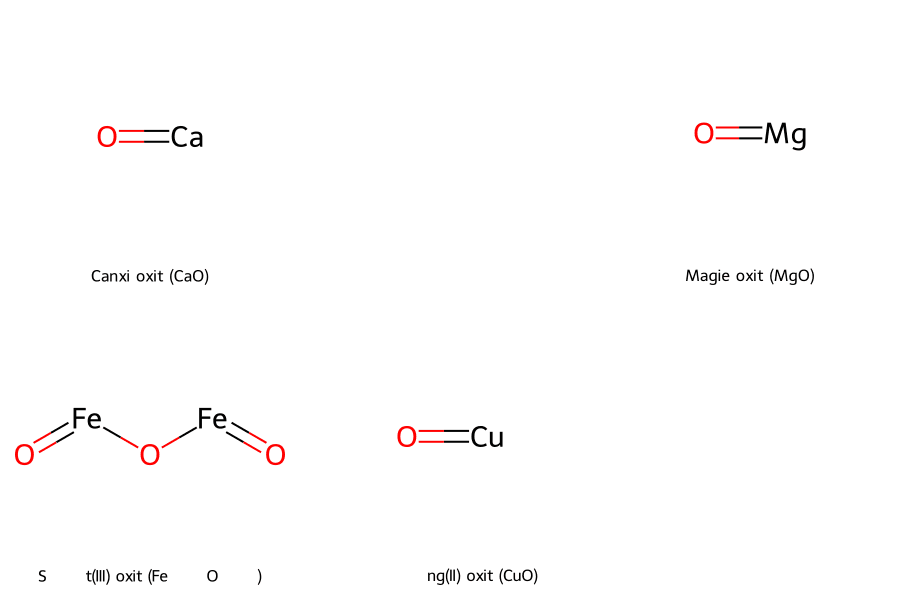
- Dựa vào công thức hóa học: Hầu hết các oxit của kim loại đều là oxit bazơ. Ví dụ: Na₂O, CuO, Fe₂O₃,…
- Thử phản ứng với axit: Khi cho oxit tác dụng với dung dịch axit (ví dụ: H₂SO₄, HCl), nếu sản phẩm thu được là muối và nước thì đó là oxit bazơ.
- Thử với nước và chất chỉ thị: Cho oxit tác dụng với nước. Nếu nó tan và tạo ra dung dịch làm giấy quỳ tím hóa xanh hoặc làm phenolphtalein hóa hồng, thì đó là oxit bazơ tan (oxit kiềm).
Lưu ý: Cần phân biệt oxit bazơ với oxit lưỡng tính như Al₂O₃, ZnO. Các oxit lưỡng tính vừa có thể tác dụng với axit, vừa có thể tác dụng với bazơ mạnh.
Phân Loại Oxit Bazơ
Oxit bazơ được phân loại thành hai nhóm chính dựa trên độ tan trong nước: Oxit bazơ tan (kiềm) và Oxit bazơ không tan.
Dựa vào khả năng hòa tan trong nước, oxit bazơ được chia thành hai nhóm chính với các tính chất và ứng dụng riêng biệt:
Oxit bazơ tan (Oxit kiềm)
Đây là những oxit có khả năng tan trong nước để tạo thành dung dịch bazơ tương ứng. Theo dữ liệu cập nhật năm 2025, nhóm này bao gồm các oxit của kim loại kiềm và một số kim loại kiềm thổ.
- Ví dụ điển hình: Natri oxit (Na₂O), Kali oxit (K₂O), Canxi oxit (CaO), Bari oxit (BaO).
- Phương trình phản ứng:
Na₂O + H₂O ⟶ 2NaOH - Ứng dụng: Nhóm oxit này là tiền chất để sản xuất các bazơ mạnh, được ứng dụng trong sản xuất xà phòng, chất tẩy rửa, điều chỉnh độ pH đất trong nông nghiệp.
Oxit bazơ không tan
Đây là những oxit bazơ không tan trong nước nhưng vẫn có khả năng tác dụng với axit để tạo thành muối và nước. Đây là nhóm chiếm đa số trong các oxit bazơ.
- Ví dụ điển hình: Sắt(III) oxit (Fe₂O₃), Đồng(II) oxit (CuO), Magie oxit (MgO).
- Phương trình phản ứng:
MgO + 2HCl ⟶ MgCl₂ + H₂O - Ứng dụng: Được sử dụng rộng rãi trong các ngành công nghiệp như sản xuất kim loại (từ quặng), làm chất xúc tác cho các phản ứng hóa học, sản xuất bột màu.
Ứng Dụng Thực Tế Của Các Oxit Bazơ Phổ Biến
Oxit bazơ có mặt trong nhiều lĩnh vực của đời sống và sản xuất. Dưới đây là bảng tổng hợp các ứng dụng nổi bật nhất được cập nhật đến năm 2025:
| Oxit Bazơ Phổ Biến | Công Thức | Ứng Dụng Nổi Bật |
|---|---|---|
| Canxi oxit | CaO | Hay còn gọi là vôi sống, là thành phần chính trong sản xuất xi măng, vôi tôi Ca(OH)₂, xử lý nước thải công nghiệp và nông nghiệp, trung hòa đất chua. |
| Natri oxit | Na₂O | Dùng để sản xuất xút (NaOH), một trong những hóa chất công nghiệp cơ bản nhất, dùng trong sản xuất giấy, xà phòng, tơ nhân tạo và thủy tinh. |
| Magie oxit | MgO | Dùng làm vật liệu chịu nhiệt trong các lò sản xuất sắt thép, xi măng. Trong y học, MgO được dùng làm thuốc kháng axit để giảm chứng khó tiêu, ợ nóng. |
| Sắt(III) oxit | Fe₂O₃ | Là thành phần chính của quặng hematit, được dùng để sản xuất sắt, gang, thép. Nó cũng được dùng làm bột màu trong sơn, gốm sứ. |
Lưu Ý Quan Trọng Khi Làm Việc Với Oxit Bazơ
Việc bảo quản hóa chất và tuân thủ an toàn là vô cùng quan trọng, đặc biệt với các oxit kiềm.
- An toàn: Các oxit bazơ tan và dung dịch của chúng có tính ăn mòn cao. Luôn sử dụng đồ bảo hộ cá nhân như găng tay, kính mắt khi làm việc.
- Bảo quản: Bảo quản oxit bazơ ở nơi khô ráo, thoáng mát, trong các thùng chứa kín để tránh chúng hút ẩm và tác dụng với CO₂ trong không khí.
- Thử nghiệm: Luôn thực hiện các thí nghiệm trong phòng thí nghiệm có hệ thống thông gió tốt.
Câu Hỏi Thường Gặp (FAQ)
1. Oxit bazơ khác oxit axit như thế nào?
Oxit bazơ là oxit của kim loại và tác dụng với axit, trong khi oxit axit thường là oxit của phi kim (ví dụ: SO₂, CO₂) và tác dụng với bazơ.
2. Làm thế nào để phân biệt oxit bazơ tan và không tan?
Cách đơn giản nhất là thử hòa tan chúng vào nước. Nếu oxit tan và làm đổi màu quỳ tím thành xanh, đó là oxit bazơ tan. Nếu không tan, bạn có thể thử cho nó phản ứng với axit mạnh để xác nhận tính chất bazơ. Tham khảo thêm bảng tính tan để tra cứu nhanh.
3. Oxit bazơ có nguy hiểm không?
Có, đặc biệt là các oxit kiềm như Na₂O, K₂O, CaO vì chúng phản ứng mãnh liệt với nước và tạo ra dung dịch kiềm ăn mòn mạnh. Cần phải hiểu rõ tác hại của hóa chất và tuân thủ nghiêm ngặt các quy tắc an toàn.
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn toàn diện và chi tiết về oxit bazơ. Nếu bạn có nhu cầu mua các loại hóa chất công nghiệp và dung môi như Xút vảy NaOH, HCl 32%, hoặc các hóa chất xử lý nước, hãy truy cập website hoachatdoanhtin.com hoặc liên hệ trực tiếp để được tư vấn và báo giá tốt nhất.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










