Kiến thức chuyên môn
Ancol Là Gì? Tính Chất Lý Hóa Học, Cách Điều Chế Và Ứng Dụng Thực Tế Của Ancol
Trong thế giới hóa học hữu cơ, Ancol là một trong những nhóm hợp chất quan trọng và phổ biến nhất, đóng vai trò nền tảng trong nhiều phản ứng và có vô số ứng dụng trong đời sống cũng như sản xuất công nghiệp. Từ các loại dung môi, nhiên liệu sinh học đến ngành dược phẩm, sự hiện diện của ancol là không thể thiếu. Bài viết này sẽ cung cấp một cái nhìn tổng quan từ cơ bản đến chuyên sâu: định nghĩa ancol là gì, các phương pháp phân loại, tính chất vật lý, hóa học đặc trưng và so sánh chi tiết giữa các bậc ancol.
Ancol là gì?
Ancol là hợp chất hữu cơ có công thức tổng quát R(OH)n, trong đó nhóm chức hiđroxyl (-OH) liên kết trực tiếp với một nguyên tử cacbon no (cacbon chỉ có liên kết đơn).

Về mặt cấu trúc, Ancol là những hợp chất hữu cơ mà phân tử chứa nhóm hiđroxyl (–OH) liên kết trực tiếp với nguyên tử cacbon no. Nhóm -OH này, hay còn gọi là nhóm chức ancol, chính là yếu tố quyết định các tính chất hóa học đặc trưng và độc đáo của cả dãy đồng đẳng.
- Công thức tổng quát: Thường được biểu diễn là R(OH)n, với n ≥ 1 và R là một gốc hidrocacbon. Đối với ancol no, đơn chức, mạch hở, công thức là CnH2n+1OH (với n ≥ 1).
- Điểm khác biệt chính với Phenol: Đây là một điểm cực kỳ quan trọng cần phân biệt. Nếu nhóm -OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen, hợp chất đó được gọi là phenol. Phenol có tính axit mạnh hơn đáng kể so với ancol do ảnh hưởng của vòng benzen.
Các phương pháp phân loại Ancol phổ biến
Ancol được phân loại chủ yếu dựa trên 3 tiêu chí: bậc của ancol (bậc 1, 2, 3), số lượng nhóm -OH (đơn chức hoặc đa chức), và đặc điểm gốc hidrocacbon (no, không no, thơm).
Để hệ thống hóa và nghiên cứu dễ dàng hơn, ancol được phân loại dựa trên nhiều tiêu chí khác nhau. Dưới đây là 3 phương pháp phổ biến và được ứng dụng rộng rãi nhất.
Phương Pháp 1: Phân Loại Ancol Theo Bậc
Bậc của ancol được xác định bằng bậc của nguyên tử cacbon mà nhóm -OH gắn vào. Có 3 bậc chính: bậc 1, bậc 2 và bậc 3.
Đây là cách phân loại quan trọng nhất vì nó liên quan trực tiếp đến khả năng phản ứng, đặc biệt là phản ứng oxi hóa.
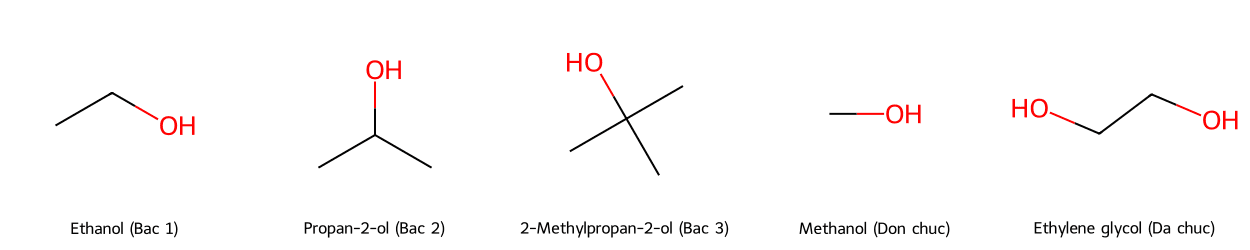
- Ancol bậc 1: Nhóm -OH gắn với carbon bậc 1 (carbon này chỉ liên kết với 1 nguyên tử carbon khác). Ví dụ điển hình là Ethanol (CH₃-CH₂-OH). Khi bị oxi hóa bởi các tác nhân như CuO, ancol bậc 1 sẽ tạo ra anđehit.
- Ancol bậc 2: Nhóm -OH gắn với carbon bậc 2 (gắn với 2 carbon khác). Ví dụ: Propan-2-ol hay Isopropyl alcohol (IPA) ((CH₃)₂CH-OH). Phản ứng oxi hóa ancol bậc 2 sẽ tạo ra xeton.
- Ancol bậc 3: Nhóm -OH gắn với carbon bậc 3 (gắn với 3 carbon khác). Ví dụ: 2-Methylpropan-2-ol ((CH₃)₃C-OH). Ancol bậc 3 rất khó bị oxi hóa trong điều kiện thông thường, đây cũng là một dấu hiệu dùng để nhận biết chúng.
Phương Pháp 2: Phân Loại Theo Số Nhóm -OH và Mạch Carbon
Dựa trên số lượng nhóm -OH, ancol được chia thành đơn chức (1 nhóm -OH) và đa chức (≥2 nhóm -OH). Dựa vào mạch carbon, có ancol no, không no và thơm.
- Ancol đơn chức: Phân tử chỉ chứa một nhóm -OH. Ví dụ phổ biến nhất là Methanol (CH₃OH) và Ethanol (C₂H₅OH).
- Ancol đa chức: Phân tử chứa hai hay nhiều nhóm -OH. Ví dụ tiêu biểu là Ethylene glycol (HO-CH₂-CH₂-OH), được dùng làm chất chống đông, hay Glycerol (HOCH₂(CHOH)CH₂OH). Ancol đa chức có các nhóm -OH kề nhau có khả năng tạo phức màu xanh lam đặc trưng với Cu(OH)₂.
- Ancol no, không no, thơm: Dựa vào đặc điểm của gốc hidrocacbon. Ancol no có gốc hidrocacbon là ankan. Ancol không no chứa liên kết đôi hoặc ba (ví dụ: ancol anlylic), và ancol thơm chứa vòng benzen nhưng nhóm -OH không gắn trực tiếp vào vòng (ví dụ: Ancol benzylic).
Tính Chất Vật Lý Đặc Trưng Của Ancol
Ancol có nhiệt độ sôi cao và tan tốt trong nước (đối với các ancol mạch ngắn) do khả năng tạo liên kết hydro mạnh giữa các phân tử và với nước.
- Trạng thái: Ở điều kiện thường, các ancol từ C1-C12 là chất lỏng không màu, mùi đặc trưng. Các ancol có số cacbon lớn hơn (từ C13 trở lên) tồn tại ở dạng rắn, giống sáp.
- Độ tan: Khả năng tan trong nước của ancol giảm dần khi mạch cacbon tăng lên do phần kỵ nước (gốc hidrocacbon) lớn dần. Các ancol đơn giản như methanol, ethanol, propanol tan vô hạn trong nước. Để hiểu rõ hơn về bản chất, bạn có thể tham khảo bài viết chi tiết độ tan là gì.
- Nhiệt độ sôi: Ancol có nhiệt độ sôi cao hơn đáng kể so với các hidrocacbon hoặc ete có khối lượng phân tử tương đương. Ví dụ, nhiệt độ sôi của ethanol (M=46) là 78.3°C, trong khi của propan (M=44) là -42°C. Nguyên nhân là do sự tồn tại của liên kết hydro bền vững giữa các phân tử ancol.
So Sánh Chi Tiết 3 Bậc Ancol (Bảng Tóm Tắt)
Ancol bậc 1, 2 và 3 khác biệt rõ rệt về khả năng phản ứng oxi hóa, tốc độ phản ứng thế và sản phẩm tách nước. Bậc 1 dễ bị oxi hóa thành anđehit, bậc 2 thành xeton, còn bậc 3 rất khó bị oxi hóa.
| Thuộc tính | Bậc 1 | Bậc 2 | Bậc 3 |
|---|---|---|---|
| Cấu trúc | -OH gắn C bậc 1 | -OH gắn C bậc 2 | -OH gắn C bậc 3 |
| Oxi hóa bởi CuO | Tạo anđehit | Tạo xeton | Không phản ứng |
| Tách nước (H₂SO₄ đặc) | Tạo alken theo quy tắc Zaitsev | Tạo hỗn hợp alken | Dễ dàng tạo alken nhất |
| Tính axit | Cao nhất (do hiệu ứng đẩy e yếu) | Trung bình | Thấp nhất (do hiệu ứng đẩy e mạnh) |
| Ứng dụng chính | Dung môi, nhiên liệu, sản xuất este | Dung môi, chất chống đông, sản xuất IPA | Dung môi, phụ gia xăng (MTBE) |
Những Lưu Ý Quan Trọng Khi Sử Dụng và Nhận Biết Ancol
Cần phân biệt rõ ancol với phenol, sử dụng phản ứng oxi hóa để xác định bậc, và tuân thủ an toàn khi thực hiện các phản ứng như tách nước với axit đặc. Luôn cập nhật các quy định mới về an toàn hóa chất.
- Phân biệt với Phenol: Cách đơn giản nhất là dùng giấy quỳ tím hoặc dung dịch Br₂. Ancol không làm đổi màu quỳ tím và không phản ứng với nước brom, trong khi phenol làm quỳ tím hóa hồng nhạt và tạo kết tủa trắng với dung dịch Br₂.
- Nhận biết bậc ancol: Phản ứng với chất oxi hóa nhẹ như CuO là phương pháp hiệu quả nhất. Ancol bậc 3 không phản ứng, giúp phân biệt nhanh chóng khỏi bậc 1 và 2.
- Phản ứng tách nước: Khi điều chế alken từ ancol, cần hết sức cẩn thận khi dùng axit sunfuric (H₂SO₄) đặc ở 170°C vì đây là axit mạnh, háo nước và gây bỏng nặng.
- Cập nhật 2025: Theo các cam kết Net-Zero toàn cầu và quy định khí thải mới như Euro 7, ứng dụng của ethanol làm nhiên liệu sinh học được dự báo sẽ tăng trưởng ít nhất 20% trong giai đoạn 2025-2027. Thị trường nhiên liệu sinh học toàn cầu dự kiến đạt giá trị trên 150 tỷ USD vào cuối năm 2025, nhấn mạnh vai trò của ancol trong lĩnh vực năng lượng tái tạo.
Câu Hỏi Thường Gặp (FAQ)
Ancol khác phenol như thế nào?
Ancol có nhóm -OH gắn vào cacbon no, trong khi phenol có nhóm -OH gắn trực tiếp vào vòng benzen. Do đó, phenol có tính axit mạnh hơn ancol và có những phản ứng hóa học đặc trưng riêng (phản ứng thế trên vòng benzen, phản ứng với dung dịch Br₂).
Làm thế nào để nhận biết ancol bậc 1, 2, 3?
Sử dụng phản ứng oxi hóa với CuO, t⁰: Ancol bậc 1 tạo anđehit (có thể tham gia phản ứng tráng gương với thuốc thử Tollens), bậc 2 tạo xeton (không có phản ứng tráng gương), và bậc 3 không bị oxi hóa trong điều kiện này.
Ứng dụng chính của ancol là gì?
Theo thống kê ngành hóa chất năm 2025, khoảng 55% sản lượng ethanol toàn cầu được dùng cho nhiên liệu; 30% làm dung môi công nghiệp và sản xuất hóa chất khác (như etyl axetat); 15% còn lại dành cho ngành đồ uống, dược phẩm và sát khuẩn.
Ancol được điều chế như thế nào?
Có hai phương pháp chính:
1. Tổng hợp hóa học: Hydrat hóa anken (ví dụ cộng nước vào ethylene với xúc tác H₂SO₄ loãng hoặc H₃PO₄). Đây là phương pháp chủ yếu để sản xuất ethanol công nghiệp.
2. Sinh học (Lên men): Lên men các nguồn nguyên liệu chứa tinh bột hoặc đường (ngô, sắn, mía) bằng vi sinh vật. Phương pháp này tạo ra ethanol dùng trong thực phẩm và nhiên liệu sinh học.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










