Kiến thức chuyên môn
Sulfide là gì? Tính Chất, Ăn Mòn & Ứng Dụng Công Nghiệp
Trong ngành công nghiệp hóa chất và vật liệu, sự hiện diện của một anion tưởng chừng đơn giản có thể là khởi nguồn cho những thách thức kỹ thuật vô cùng phức tạp. Sulfide, thường được biết đến qua mùi “trứng thối” đặc trưng của khí hydro sulfide (H₂S), thực chất là một nhóm hợp chất đa dạng với vai trò kép: vừa là tài nguyên quý giá, vừa là tác nhân gây ăn mòn và rủi ro an toàn hàng đầu.
Bài viết này từ các chuyên gia của Hóa Chất Doanh Tín sẽ không chỉ trả lời câu hỏi “Sulfide là gì?” ở mức độ cơ bản, mà còn đi sâu phân tích các đặc tính kỹ thuật, cơ chế phá hủy vật liệu và những ứng dụng chiến lược, giúp doanh nghiệp hiểu rõ để kiểm soát và khai thác hiệu quả hợp chất quan trọng này.
Hợp Chất Sulfide Được Hiểu Đúng và Toàn Diện Như Thế Nào?
Sulfide được định nghĩa theo ba dạng chính: ion sulfide (S²⁻) là gốc hóa học, muối sulfide vô cơ là hợp chất với kim loại (ví dụ FeS, Na₂S), và sulfide hữu cơ là hợp chất chứa liên kết carbon-lưu huỳnh-carbon.
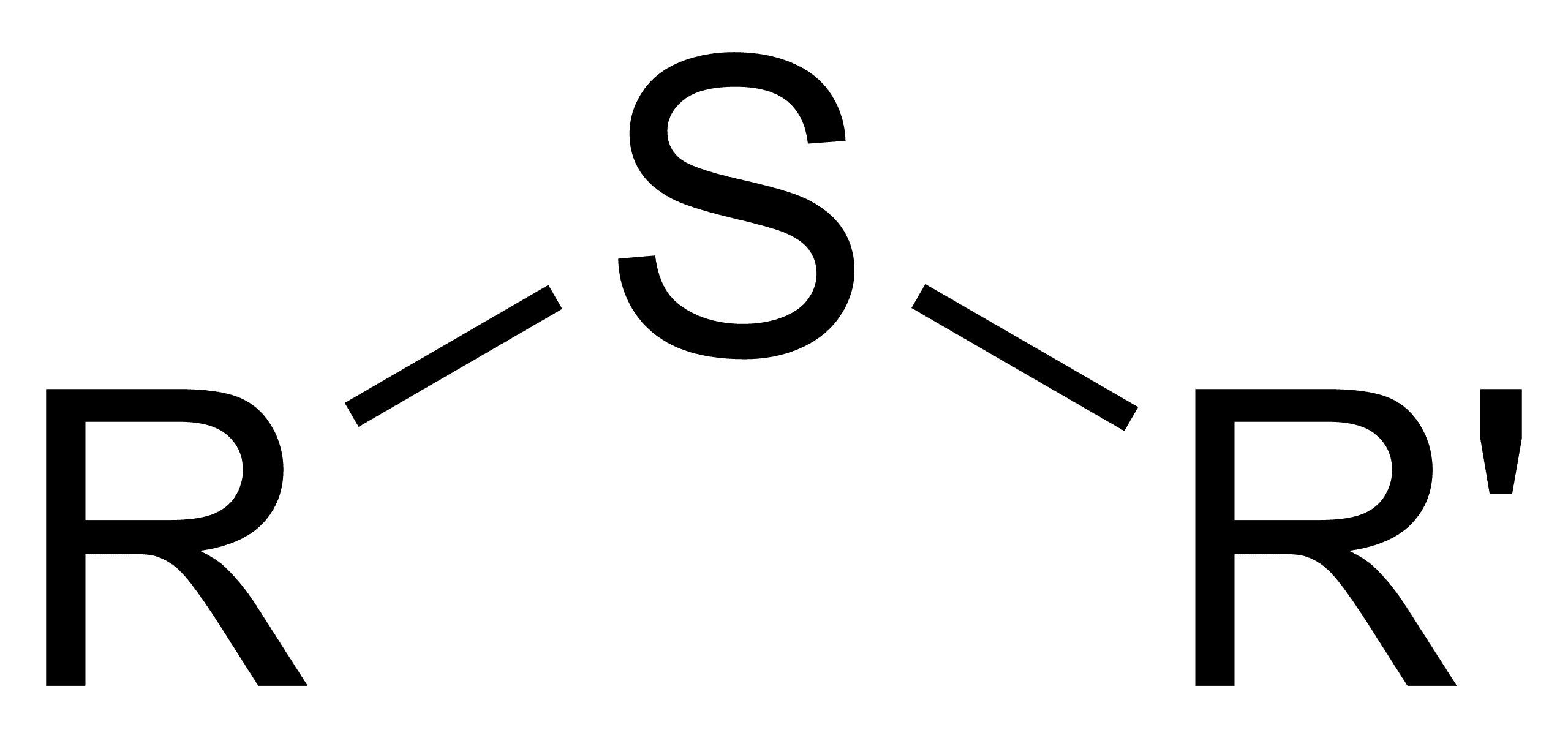
Khi nói về “sulfide”, chúng ta cần phân biệt rõ ba khái niệm liên quan mật thiết nhưng khác biệt về bản chất:
- Ion Sulfide (S²⁻): Đây là dạng cơ bản nhất, một anion (ion âm) được hình thành khi nguyên tử lưu huỳnh (S), một nguyên tố quan trọng trong bảng tuần hoàn hóa học, nhận thêm hai electron. Do có tính bazơ rất mạnh, ion S²⁻ gần như không tồn tại ở dạng tự do trong dung dịch mà chủ yếu tồn tại ở dạng hydrosulfide (HS⁻).
- Muối Sulfide Vô Cơ: Là các hợp chất ion được tạo thành giữa ion sulfide (S²⁻) với một cation kim loại. Ví dụ điển hình bao gồm Sắt(II) sulfide (FeS), Natri sulfide (Na₂S), và Kẽm sulfide (ZnS). Các hợp chất này thể hiện đầy đủ tính chất hóa học của muối.
- Sulfide Hữu Cơ (Thioethers): Là nhóm hợp chất hữu cơ có chứa liên kết Carbon-Lưu huỳnh-Carbon (C-S-C). Chúng khác biệt hoàn toàn với muối sulfide vô cơ và có vai trò quan trọng trong sinh hóa, ví dụ như amino acid methionine, một hợp chất tương tự Glycin.
Trong khuôn khổ bài viết này, chúng tôi tập trung chủ yếu vào các sulfide vô cơ và hydro sulfide (H₂S), những tác nhân có ảnh hưởng sâu rộng nhất đến các quy trình công nghiệp.
Làm thế nào để phân biệt Sulfide, Sulfite và Sulfate?
Chúng được phân biệt chủ yếu qua công thức ion và số oxy hóa của lưu huỳnh: Sulfide (S²⁻, số oxy hóa -2), Sulfite (SO₃²⁻, số oxy hóa +4), và Sulfate (SO₄²⁻, số oxy hóa +6).
Để tránh nhầm lẫn, bảng dưới đây phân biệt rõ 3 anion gốc lưu huỳnh phổ biến:
| Tiêu Chí | Sulfide | Sulfite | Sulfate |
|---|---|---|---|
| Công thức Ion | S²⁻ | SO₃²⁻ | SO₄²⁻ |
| Số Oxy Hóa (S) | -2 | +4 | +6 |
| Tính Chất | Chất khử mạnh, bazơ mạnh | Vừa oxy hóa, vừa khử | Chất oxy hóa (yếu), bền |
| Nguồn Gốc Phổ Biến | Quặng kim loại, phân hủy yếm khí | Chất bảo quản, sản phẩm phụ SO₂ | Khoáng vật (thạch cao), phân bón |
| Mùi Đặc Trưng | Mùi trứng thối (khi tạo H₂S) | Mùi hắc (khi tạo SO₂) | Không mùi |
Các Đặc Tính Hóa Lý Cốt Lõi của Sulfide là gì?
Về vật lý, sulfide tồn tại ở dạng rắn tinh thể với màu sắc và độ tan đa dạng. Về hóa học, chúng là chất khử mạnh, có tính bazơ, và phản ứng đặc trưng với axit để giải phóng khí H₂S độc hại.
Hiểu rõ các tính chất hóa lý là chìa khóa để kiểm soát và ứng dụng sulfide một cách an toàn.
Tính Chất Vật Lý Đặc Trưng của Sulfide biểu hiện như thế nào?
Sulfide thường là chất rắn tinh thể, có màu sắc phụ thuộc vào kim loại liên kết (vàng, đen, xám). Độ tan của chúng cũng khác nhau: sulfide kim loại nặng thường không tan, trong khi sulfide kim loại kiềm lại tan tốt.
Trạng thái của muối sulfide phụ thuộc vào bản chất của kim loại liên kết. Chúng có thể tồn tại ở dạng tinh thể rắn. Nhiều muối sulfide kim loại nặng có độ tan trong nước rất thấp, một tính chất được thể hiện rõ trong bảng tính tan. Ngược lại, sulfide của kim loại kiềm như Na₂S lại tan tốt, tạo ra một dung dịch có tính kiềm mạnh.
[Hình ảnh: Các mẫu tinh thể quặng sulfide kim loại với màu sắc khác nhau như Pyrite (vàng), Galena (xám bạc), Sphalerite (nâu). Alt text: Hình ảnh các loại quặng sulfide kim loại phổ biến trong tự nhiên.]
Những Tính Chất Hóa Học Quan Trọng của Sulfide là gì?
Hai tính chất hóa học quan trọng nhất là khả năng phản ứng với axit mạnh để tạo khí H₂S và vai trò là một chất khử mạnh do lưu huỳnh có số oxy hóa thấp nhất (-2).
Phản Ứng với Axit – Nguồn Gốc của Khí H₂S: Đây là phản ứng đặc trưng và quan trọng nhất về mặt an toàn. Khi các muối sulfide tiếp xúc với một axit mạnh, ví dụ như axit clohidric (HCl) hoặc axit sunfuric (H₂SO₄), chúng sẽ tham gia phản ứng trung hòa và giải phóng khí hydro sulfide (H₂S).
FeS(r) + 2HCl(dd) ⟶ FeCl₂(dd) + H₂S(k)
Tính Khử và Phản Ứng Oxy Hóa: Lưu huỳnh trong sulfide có số oxy hóa thấp nhất (-2), do đó sulfide là một chất khử mạnh. Nó có thể bị oxy hóa bởi các tác nhân như oxy, clo, hoặc brom để tạo thành lưu huỳnh tự do (S) hoặc các hợp chất có số oxy hóa cao hơn.
Những Rủi Ro về Ăn Mòn và Độc Tính của Sulfide là gì?
Sulfide gây ra rủi ro kép: gây ăn mòn nghiêm trọng cho kết cấu kim loại (đặc biệt là thép) thông qua các cơ chế hóa học và vi sinh, đồng thời khí hydro sulfide (H₂S) phát sinh từ nó là một chất độc thần kinh cực mạnh, có thể gây tử vong ở nồng độ cao.

Dù hữu ích, sulfide cũng là nguồn gốc của nhiều vấn đề nghiêm trọng, đòi hỏi sự quản lý chặt chẽ.
Sulfide Gây Ăn Mòn Kết Cấu Thép Như Thế Nào?
Sulfide hòa tan tấn công thép qua 3 cơ chế chính: ăn mòn hóa học trực tiếp, nứt gãy do ứng suất (SSC) khi hydro khuếch tán vào kim loại, và ăn mòn do vi sinh vật (MIC) khi vi khuẩn tạo ra sulfide cục bộ.
Sulfide hòa tan là một trong những tác nhân gây ăn mòn nghiêm trọng nhất đối với thép. Theo các báo cáo cập nhật đến năm 2025, chi phí do ăn mòn tại Việt Nam có thể chiếm tới 3-5% GDP, trong đó ăn mòn do sulfide là một phần đáng kể, đặc biệt trong ngành dầu khí và xử lý nước thải. Quá trình này bắt đầu khi H₂S hòa tan và làm axit hóa dung dịch, thúc đẩy quá trình ăn mòn điện hóa, một hiện tượng liên quan đến các chất điện li.
Nứt Gãy do Sulfide (Sulfide Stress Cracking – SSC): Đây là một dạng ăn mòn cực kỳ nguy hiểm trong ngành dầu mỏ và hóa chất. Trong môi trường chứa H₂S, các nguyên tử hydro khuếch tán vào bên trong cấu trúc thép, gây ra hiện tượng giòn hydro, dẫn đến nứt gãy đột ngột.
Ăn Mòn do Vi Sinh Vật (MIC): Trong các môi trường yếm khí, các vi khuẩn khử sulfate (SRB) sẽ chuyển hóa sulfate thành sulfide, gây ra ăn mòn cục bộ cực kỳ nhanh chóng và khó kiểm soát.
Mức Độ Độc Hại của Hydro Sulfide (H₂S) Cao Như Thế Nào?
H₂S cực kỳ độc. Ở nồng độ thấp (dưới 5 ppm) nó gây mùi trứng thối. Ở nồng độ trên 100 ppm, nó làm mất khứu giác và trên 500 ppm có thể gây bất tỉnh và tử vong trong vài phút.

Tuyệt đối không thể xem nhẹ sự nguy hiểm của H₂S. Việc tuân thủ nghiêm ngặt các quy định về an toàn và bảo quản hóa chất là bắt buộc. Theo QCVN 06:2009/BTNMT, nồng độ tối đa cho phép của H₂S trong không khí xung quanh là rất thấp.
- Ở nồng độ thấp (0.1 – 5 ppm): Gây mùi trứng thối đặc trưng, có thể gây kích ứng mắt và đường hô hấp.
- Trên 50 ppm: Gây tổn thương hô hấp nghiêm trọng, phù phổi.
- Trên 100 ppm: Gây mất khứu giác nhanh chóng, làm nạn nhân không còn cảm nhận được mùi nguy hiểm.
- Trên 500-700 ppm: Gây mất ý thức và tử vong chỉ trong vài phút.
TẢI NGAY: Hướng Dẫn An Toàn Khi Làm Việc Với H₂S (PDF)
Các Ứng Dụng Chiến Lược của Hợp Chất Sulfide trong Công Nghiệp là gì?
Sulfide có vai trò không thể thiếu trong nhiều ngành: làm quặng chính để khai thác kim loại, hóa chất nền tảng trong sản xuất giấy và dệt nhuộm, hoạt chất trị gàu trong dược phẩm, và tiềm năng trong sản xuất pin năng lượng cao.
Vượt qua những rủi ro, sulfide vẫn đóng vai trò không thể thiếu trong nhiều ngành.
Ứng dụng của Sulfide trong ngành Khai Khoáng và Luyện Kim là gì?
Đây là lĩnh vực ứng dụng lớn nhất, nơi sulfide tồn tại dưới dạng quặng để khai thác các kim loại quan trọng như chì (từ PbS), kẽm (từ ZnS), và đồng (từ CuFeS₂).
Hàng loạt kim loại quan trọng tồn tại trong tự nhiên dưới dạng quặng sulfide như galen (PbS), sphalerit (ZnS – Kẽm), chalcopyrit (CuFeS₂). Quá trình tuyển nổi (flotation) được sử dụng để tách các khoáng vật sulfide này trước khi đưa vào luyện kim để chiết xuất kim loại tinh khiết.
Sulfide được dùng trong Sản Xuất Hóa Chất và Giấy như thế nào?
Natri sulfide (Na₂S) là hóa chất chủ chốt trong quy trình Kraft để tách lignin khỏi sợi gỗ khi sản xuất giấy, và cũng được dùng làm chất khử trong ngành dệt nhuộm và xử lý da.
Natri sulfide (Na₂S) là một hóa chất quan trọng trong quy trình Kraft để sản xuất bột giấy, giúp loại bỏ lignin khỏi sợi gỗ. Trong quy trình này, các bazơ mạnh như NaOH cũng đóng vai trò thiết yếu.
Vai trò của Sulfide trong Dược Phẩm và Chăm Sóc Cá Nhân là gì?
Selenium Sulfide (SeS₂) là một hoạt chất trị gàu phổ biến trong dầu gội, có tác dụng kháng nấm và kháng khuẩn mạnh mẽ, giúp kiểm soát vi nấm gây gàu.
Selenium Sulfide (SeS₂) là một hoạt chất quen thuộc trong các sản phẩm dầu gội trị gàu nhờ đặc tính kháng nấm và kháng khuẩn, tương tự như khả năng khử trùng của Chloramin B. Nó giúp kiểm soát hiệu quả vi nấm Malassezia globosa – nguyên nhân chính gây ra gàu và viêm da tiết bã.

Các Ứng Dụng Chuyên Ngành Khác của Sulfide là gì?
Sulfide còn được dùng làm chất bảo quản thực phẩm, thành phần cốt lõi trong pin Lithium-Sulfur thế hệ mới, và vật liệu sản xuất chất bán dẫn, cảm biến quang.
- Chất bảo quản: Một số sulfide được dùng làm phụ gia thực phẩm để ngăn vi khuẩn.
- Sản xuất Pin: Pin Lithium-Sulfur, sử dụng Liti (Li), hứa hẹn mang lại mật độ năng lượng cao.
- Chất bán dẫn: Kẽm sulfide (ZnS) và Cadmium sulfide (CdS) được sử dụng trong sản xuất chất phát quang.
Case Study từ Hóa Chất Doanh Tín
Dự án: Xử lý ăn mòn đường ống tại nhà máy chế biến khí gas ở Vũng Tàu.
Thách thức: Nồng độ H₂S cao trong dòng khí gây ăn mòn nghiêm trọng (tốc độ > 1.5 mm/năm), dẫn đến rò rỉ và phải dừng hoạt động đột xuất.
Giải pháp: Đội ngũ Doanh Tín đã tư vấn và cung cấp hóa chất Sulfide Scavenger gốc Triazine, được bơm trực tiếp vào đường ống.
Kết quả: Tốc độ ăn mòn giảm xuống dưới 0.1 mm/năm, giảm 93% chi phí bảo trì và tăng tính an toàn vận hành.
Các Câu Hỏi Thường Gặp (FAQ) về Sulfide là gì?
1. Làm thế nào để loại bỏ mùi H₂S trong nước giếng khoan?
Có thể loại bỏ mùi H₂S bằng các phương pháp oxy hóa (sục khí, dùng hóa chất) hoặc hấp phụ (dùng than hoạt tính).
Sử dụng các hệ thống sục khí oxy hóa, bộ lọc than hoạt tính công nghiệp, hoặc châm hóa chất oxy hóa như Chlorine hoặc Kali Permanganat (KMnO₄) có thể loại bỏ H₂S hiệu quả.
2. Sulfide Scavenger là gì và hoạt động như thế nào?
Đây là hóa chất chuyên dụng được tiêm vào dòng lưu chất để phản ứng và trung hòa H₂S, biến nó thành hợp chất ổn định và không ăn mòn.
Đó là các hóa chất chuyên dụng (ví dụ: gốc Triazine) được tiêm vào dòng lưu chất để phản ứng và trung hòa H₂S, chuyển nó thành các hợp chất không ăn mòn và ổn định hơn.
3. Ở Việt Nam, ngành nào chịu ảnh hưởng nặng nề nhất từ ăn mòn do sulfide?
Ngành dầu khí, xử lý nước thải, và sản xuất giấy là ba ngành chịu ảnh hưởng nặng nề nhất từ các vấn đề ăn mòn do sulfide gây ra.
Ngành công nghiệp dầu khí (khai thác, vận chuyển, chế biến), các nhà máy xử lý nước thải, và ngành sản xuất giấy là những nơi đối mặt với thách thức ăn mòn do sulfide lớn nhất.
Kết Luận và Định Hướng từ Hóa Chất Doanh Tín là gì?
Hiểu biết sâu sắc về sulfide là chìa khóa để doanh nghiệp nhận diện rủi ro, tuân thủ quy định an toàn và áp dụng các giải pháp kỹ thuật phù hợp để bảo vệ tài sản và con người, định vị Hóa Chất Doanh Tín không chỉ là nhà cung cấp mà còn là đối tác giải pháp.
Từ một anion cơ bản S²⁻, sulfide thể hiện rõ vai trò kép trong thế giới hóa học. Đối với doanh nghiệp, việc hiểu rõ “Sulfide là gì” là nền tảng để nhận diện rủi ro, tuân thủ các quy định trong Luật Hóa chất mới nhất, và áp dụng các giải pháp kỹ thuật phù hợp.
Góc Nhìn Chuyên Gia
“Nhiều doanh nghiệp thường chỉ tập trung vào việc sửa chữa hậu quả của ăn mòn mà quên mất việc phòng ngừa từ gốc. Việc lựa chọn vật liệu phù hợp và sử dụng các hóa chất ức chế hoặc scavenger ngay từ đầu sẽ tiết kiệm chi phí hơn rất nhiều trong dài hạn.”
– Nguyễn Thị Mỹ Linh, Chuyên gia Hóa chất, Hóa Chất Doanh Tín
Tại Hóa Chất Doanh Tín, chúng tôi không chỉ cung cấp hóa chất chất lượng cao, mà còn mang đến sự tư vấn chuyên sâu về các giải pháp kiểm soát ăn mòn và xử lý H₂S.
Tuyên bố miễn trừ trách nhiệm pháp lý
Thông tin trong bài viết này chỉ nhằm mục đích tham khảo và giáo dục. Việc áp dụng bất kỳ hóa chất hoặc quy trình nào vào thực tế sản xuất cần có sự tư vấn và giám sát của các kỹ sư và chuyên gia có trình độ. Hóa Chất Doanh Tín không chịu trách nhiệm cho bất kỳ tổn thất nào phát sinh từ việc sử dụng thông tin trong bài viết này mà không có sự tư vấn chuyên môn.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









