Kiến thức chuyên môn
Phản Ứng Tỏa Nhiệt Là Gì? Khám Phá Phản Ứng Hóa Học Giải Phóng Nhiệt
Phản ứng tỏa nhiệt là một quá trình hóa học hoặc vật lý trong đó năng lượng được giải phóng ra môi trường xung quanh, thường ở dạng nhiệt. Điều này dẫn đến việc nhiệt độ của môi trường tăng lên và năng lượng nội tại của hệ phản ứng giảm. Các ví dụ điển hình bao gồm quá trình đốt cháy củi, phản ứng trung hòa axit-bazơ, hay đơn giản là khi hòa tan một số hóa chất vào nước.
Bài viết này sẽ cung cấp một cái nhìn toàn diện về khái niệm, đặc điểm, các ví dụ thực tế và cách nhận biết một phản ứng tỏa nhiệt, giúp bạn hiểu sâu hơn về một trong những khái niệm nền tảng của hóa học.
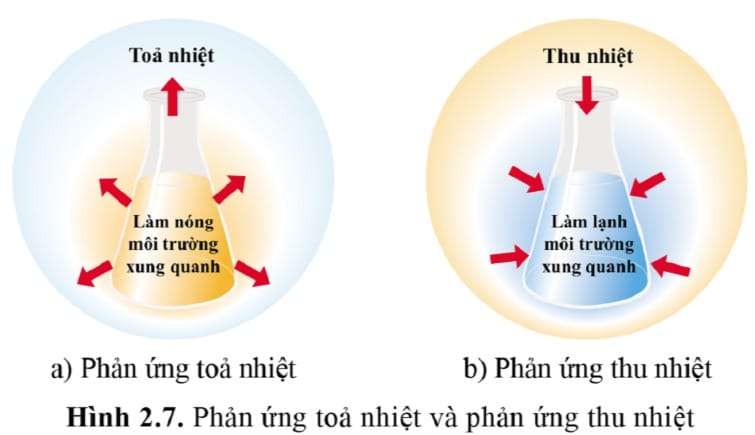
Đặc Điểm Chính Của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt có đặc điểm chính là giải phóng năng lượng (nhiệt), làm giảm entanpi của hệ (ΔH < 0), thường có tính tự phát và được ứng dụng rộng rãi để tạo ra năng lượng.
Một phản ứng tỏa nhiệt có những đặc điểm cơ bản sau:
- Giải phóng năng lượng: Đây là dấu hiệu đặc trưng nhất. Năng lượng được giải phóng dưới dạng nhiệt, làm nóng môi trường xung quanh.
- Biến thiên entanpi âm (ΔH < 0): Trong nhiệt động hóa học, sự giải phóng năng lượng ra môi trường có nghĩa là entanpi (H) của hệ giảm. Do đó, biến thiên entanpi của phản ứng sẽ có giá trị âm.
- Thường có tính tự phát: Nhiều phản ứng tỏa nhiệt có thể tự xảy ra trong điều kiện thường mà không cần cung cấp năng lượng liên tục để duy trì.
- Ứng dụng rộng rãi: Các phản ứng này đóng vai trò quan trọng trong đời sống và sản xuất, từ việc tạo ra năng lượng đến các quy trình công nghiệp.
Ví dụ kinh điển là phản ứng đốt cháy metan (CH₄):
CH₄ + 2O₂ ⟶ CO₂ + 2H₂O
Trong phản ứng này, năng lượng được giải phóng mạnh mẽ dưới dạng nhiệt và ánh sáng.
Cách Nhận Biết Phản Ứng Tỏa Nhiệt
Để nhận biết phản ứng tỏa nhiệt, bạn có thể quan sát nhiệt độ môi trường xung quanh tăng lên, hoặc sử dụng các dụng cụ chuyên dụng để đo và xác định biến thiên entanpi của phản ứng có giá trị âm (ΔH < 0).
Bạn có thể xác định một phản ứng có phải là tỏa nhiệt hay không qua các phương pháp sau:
- Quan sát sự thay đổi nhiệt độ: Cách đơn giản nhất là cảm nhận hoặc đo nhiệt độ của môi trường. Nếu bình phản ứng nóng lên, đó chắc chắn là phản ứng tỏa nhiệt.
- Đo lường biến thiên entanpi (ΔH): Trong phòng thí nghiệm, các nhà hóa học sử dụng nhiệt lượng kế để đo lượng nhiệt tỏa ra và xác định ΔH < 0.
- Xem xét bản chất liên kết hóa học: Phản ứng tạo ra các sản phẩm có liên kết bền vững hơn (năng lượng liên kết lớn hơn) so với chất phản ứng ban đầu thường là phản ứng tỏa nhiệt.
- Kiểm tra điều kiện phản ứng: Nếu phản ứng tự xảy ra mà không cần gia nhiệt liên tục, khả năng cao đó là phản ứng tỏa nhiệt.
Các Ví Dụ Thực Tế Về Phản Ứng Tỏa Nhiệt
Các ví dụ thực tế phổ biến của phản ứng tỏa nhiệt bao gồm mọi quá trình đốt cháy nhiên liệu (xăng, gas), phản ứng trung hòa axit-bazơ, hòa tan vôi sống vào nước, và phản ứng nhiệt nhôm dùng để hàn đường ray.
Phản ứng tỏa nhiệt xuất hiện ở khắp mọi nơi trong cuộc sống hàng ngày và trong công nghiệp.
Đốt cháy nhiên liệu
Phản ứng cháy của than, xăng, dầu hay khí gas là ví dụ quen thuộc nhất. Chẳng hạn, carbon trong than cháy trong oxygen để tạo ra khí CO₂ và tỏa ra lượng nhiệt lớn:
C + O₂ ⟶ CO₂
Phản ứng trung hòa
Đây là một trong những phản ứng trung hòa điển hình. Khi một axit mạnh như axit clohidric (HCl) tác dụng với một bazơ mạnh như natri hidroxit (NaOH), nhiệt độ dung dịch sẽ tăng lên đáng kể.
HCl + NaOH ⟶ NaCl + H₂O
Phản ứng của kiềm thổ với nước
Hòa tan vôi sống (CaO) vào nước để tạo ra vôi tôi (Ca(OH)₂) là một quá trình tỏa nhiệt mạnh, có thể làm cho nước sôi lên.
Hòa tan muối vào nước
Việc hòa tan một số muối như canxi clorua (CaCl₂) hoặc axit đậm đặc như axit sunfuric (H₂SO₄) vào nước cũng giải phóng một lượng nhiệt đáng kể. Đây là nguyên lý hoạt động của các túi chườm nóng.
Phản ứng nhiệt nhôm
Đây là một phản ứng nhiệt nhôm kinh điển, trong đó bột nhôm (Al) khử oxit sắt (Fe₂O₃) để tạo ra sắt nóng chảy và oxit nhôm. Phản ứng này tỏa nhiệt cực kỳ mạnh, đủ để làm sắt nóng chảy và được ứng dụng trong kỹ thuật hàn đường ray xe lửa.
2Al + Fe₂O₃ ⟶ Al₂O₃ + 2Fe
Phân Biệt Giữa Phản Ứng Tỏa Nhiệt và Phản Ứng Thu Nhiệt
Phản ứng tỏa nhiệt giải phóng năng lượng (làm nóng môi trường, ΔH < 0), trong khi phản ứng thu nhiệt hấp thụ năng lượng (làm lạnh môi trường, ΔH > 0).
Để ghi nhớ một cách đơn giản, hãy xem bảng so sánh dưới đây:
| Tiêu chí | Phản Ứng Tỏa Nhiệt | Phản Ứng Thu Nhiệt (Hấp Nhiệt) |
|---|---|---|
| Năng Lượng | Giải phóng nhiệt ra môi trường (ΔH < 0) | Hấp thụ nhiệt từ môi trường (ΔH > 0) |
| Nhiệt độ môi trường | Tăng lên | Giảm xuống (môi trường lạnh đi) |
| Tính tự phát | Thường có xu hướng tự phát | Cần cung cấp năng lượng liên tục |
| Ví dụ | Đốt cháy, phản ứng trung hòa | Phân hủy nước, quang hợp của cây xanh |
Mẹo ghi nhớ: Phản ứng “tỏa nhiệt” là tỏa nhiệt ra bên ngoài, làm môi trường nóng lên. Ngược lại, phản ứng “thu nhiệt” (hấp nhiệt) là thu nhiệt từ môi trường vào, làm môi trường lạnh đi.
Ứng Dụng Thực Tiễn Của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt được ứng dụng rộng rãi trong sản xuất năng lượng (nhiệt điện), y học (túi chườm nóng), nấu nướng hàng ngày và trong nhiều quy trình sản xuất hóa chất công nghiệp như sản xuất phân đạm.
Phản ứng tỏa nhiệt có vô số ứng dụng quan trọng trong cuộc sống:
- Sản xuất năng lượng: Đốt cháy nhiên liệu hóa thạch trong các nhà máy nhiệt điện là nguồn cung cấp điện năng chính cho toàn thế giới.
- Y học và đời sống: Các túi chườm nóng tức thời sử dụng phản ứng hòa tan CaCl₂ để tạo nhiệt, giúp giảm đau cơ.
- Nấu nướng: Đốt khí gas (chủ yếu là propan, butan) để nấu chín thức ăn hàng ngày.
- Công nghiệp hóa chất: Phản ứng tổng hợp amoniac (NH₃) từ nitơ và hydro (quy trình Haber-Bosch) là một phản ứng tỏa nhiệt quan trọng, tạo ra nguyên liệu sản xuất phân đạm.
Hướng Dẫn Thí Nghiệm Đơn Giản
Một thí nghiệm đơn giản để minh họa phản ứng tỏa nhiệt là cho dung dịch axit clohidric (HCl) tác dụng với dung dịch natri hidroxit (NaOH) và quan sát nhiệt độ của hỗn hợp tăng lên bằng nhiệt kế.
Bạn có thể tự thực hiện một thí nghiệm về phản ứng tỏa nhiệt ngay tại phòng thí nghiệm trường học.
Thí nghiệm: Phản ứng trung hòa giữa HCl và NaOH.
- Chuẩn bị: Cốc cách nhiệt (hoặc cốc thủy tinh), nhiệt kế, dung dịch HCl 1M, dung dịch NaOH 1M.
- Bước 1: Rót 50ml dung dịch HCl vào cốc và đo nhiệt độ ban đầu.
- Bước 2: Rót từ từ 50ml dung dịch NaOH vào cốc, khuấy nhẹ.
- Bước 3: Quan sát sự thay đổi nhiệt độ trên nhiệt kế.
- Kết quả: Bạn sẽ thấy nhiệt độ của dung dịch tăng lên vài độ, chứng tỏ đây là một phản ứng tỏa nhiệt.
Lưu ý an toàn: Luôn đeo kính bảo hộ và găng tay khi làm việc với axit và bazơ, dù ở nồng độ loãng.
Câu Hỏi Thường Gặp (FAQ)
Phản ứng tỏa nhiệt có nguy hiểm không?
Có, các phản ứng tỏa nhiệt mạnh có thể gây nguy hiểm như bỏng hoặc cháy nổ nếu không được kiểm soát cẩn thận. Luôn phải tuân thủ các quy tắc an toàn.
Làm thế nào để đo chính xác lượng nhiệt tỏa ra?
Để đo chính xác lượng nhiệt tỏa ra, người ta sử dụng một thiết bị chuyên dụng gọi là nhiệt lượng kế (calorimeter) và áp dụng các công thức vật lý để tính toán.
Phản ứng tỏa nhiệt có thể đảo ngược được không?
Về lý thuyết, có thể. Tuy nhiên, để đảo ngược một phản ứng tỏa nhiệt, cần phải cung cấp một lượng năng lượng lớn cho hệ, biến quá trình ngược lại thành một phản ứng thu nhiệt.
Kết Luận
Phản ứng tỏa nhiệt là một phần không thể thiếu trong thế giới tự nhiên và các hoạt động của con người. Hiểu rõ về bản chất, đặc điểm và ứng dụng của nó không chỉ giúp chúng ta học tốt hơn môn hóa học mà còn biết cách áp dụng và phòng tránh các rủi ro liên quan một cách an toàn và hiệu quả.
Mình rất hào hứng khi chia sẻ về phản ứng tỏa nhiệt, một khái niệm hóa học quan trọng xuất hiện trong cả tự nhiên lẫn công nghiệp. Phản ứng tỏa nhiệt giải phóng nhiệt năng, mang lại năng lượng cho sản xuất và đời sống, như cháy metan hay tôi vôi. Trong bài viết này, mình – đại diện Hóa Chất Doanh Tín – sẽ giải thích chi tiết phản ứng tỏa nhiệt là gì, tính chất, ứng dụng thực tiễn, ví dụ cụ thể, so sánh với phản ứng thu nhiệt, và cách đo biến thiên enthalpy. Hãy cùng khám phá để hiểu tại sao phản ứng tỏa nhiệt đóng vai trò lớn trong hóa học và công nghiệp!
Phản ứng tỏa nhiệt là gì?
Mình bắt đầu với câu hỏi chính: Phản ứng tỏa nhiệt là gì? Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng nhiệt năng, làm tăng nhiệt độ môi trường xung quanh, với biến thiên enthalpy âm (ΔH < 0). Đây là phản ứng tự phát, không cần cung cấp năng lượng liên tục, như cháy metan hoặc tôi vôi. Phản ứng tỏa nhiệt rất quan trọng trong sản xuất xi măng, năng lượng, và trong tự nhiên như hô hấp tế bào. Để hiểu thêm về cấu trúc hóa học, bạn có thể tham khảo bảng tuần hoàn hóa học.
Phản ứng tỏa nhiệt giải phóng nhiệt năng, tự phát.
Mình thấy phản ứng tỏa nhiệt thật sự đặc biệt vì nó cung cấp năng lượng hiệu quả. Ví dụ, khi đốt metan trong nhà máy, phản ứng tỏa nhiệt tạo ra CO₂ và H₂O, cung cấp năng lượng cho các quy trình công nghiệp. Các công ty như VietChem thường nghiên cứu các phản ứng này để tối ưu hóa sản xuất.
Tính chất của phản ứng tỏa nhiệt
Mình rất ấn tượng với các tính chất của phản ứng tỏa nhiệt, vì chúng giúp hiểu rõ cơ chế hóa học:
- Giải phóng nhiệt năng: Làm nóng môi trường xung quanh, như khi đốt than hoặc metan.
- Biến thiên enthalpy âm: ΔH < 0, đo bằng kJ/mol, cho thấy hệ thống mất năng lượng.
- Tự phát: Không cần cung cấp năng lượng liên tục, như phản ứng CaO + H₂O → Ca(OH)₂.
Phản ứng tỏa nhiệt có biến thiên enthalpy âm.
Mình thấy tính tự phát của phản ứng tỏa nhiệt là yếu tố then chốt, giúp tiết kiệm năng lượng trong công nghiệp. Ví dụ, phản ứng tôi vôi tạo Ca(OH)₂ được sử dụng rộng rãi trong sản xuất xi măng.
Ứng dụng của phản ứng tỏa nhiệt
Mình tin rằng phản ứng tỏa nhiệt có vai trò quan trọng trong nhiều lĩnh vực:
- Sản xuất xi măng: Phản ứng tôi vôi (CaO + H₂O → Ca(OH)₂) giải phóng nhiệt năng, dùng để sản xuất xi măng.
- Năng lượng công nghiệp: Đốt nhiên liệu như metan, than tạo năng lượng cho nhà máy, lò hơi. Để hiểu thêm về hóa chất trong công nghiệp, bạn có thể xem giải pháp hóa chất công nghiệp.
- Hô hấp tế bào: Trong cơ thể, phản ứng tỏa nhiệt giải phóng nhiệt để duy trì sự sống.
Phản ứng tỏa nhiệt ứng dụng trong sản xuất xi măng.
Mình thấy phản ứng tỏa nhiệt thật sự đa năng, từ việc cung cấp năng lượng cho các nhà máy đến duy trì sự sống. Ví dụ, khi đốt metan trong nhà máy điện, phản ứng tỏa nhiệt tạo ra CO₂ và H₂O, cung cấp nhiệt năng hiệu quả.
Ví dụ phản ứng tỏa nhiệt
Mình thấy việc đưa ra các ví dụ cụ thể giúp hiểu rõ hơn về phản ứng tỏa nhiệt:
- Cháy metan:
CH₄ + 2O₂ → CO₂ + 2H₂O, ΔH = -890,2 kJ/mol.

Phản ứng này giải phóng nhiệt năng lớn, dùng trong lò hơi.
- Tôi vôi:
CaO + H₂O → Ca(OH)₂, ΔH = -65 kJ/mol.
Phản ứng này phổ biến trong sản xuất xi măng. Để hiểu thêm về Ca(OH)₂, bạn có thể xem clorua vôi là gì. - Trung hòa axit-bazơ:
HCl + NaOH → NaCl + H₂O, giải phóng nhiệt. Để tìm hiểu về HCl, bạn có thể xem axit clohidric.
Metan cháy tạo CO₂ trong phản ứng tỏa nhiệt.
Mình thấy các ví dụ này rất thực tế, giúp minh họa cách phản ứng tỏa nhiệt hoạt động trong công nghiệp và đời sống.
So sánh phản ứng tỏa nhiệt và thu nhiệt
Mình thấy việc so sánh phản ứng tỏa nhiệt với phản ứng thu nhiệt giúp làm rõ sự khác biệt:
- Phản ứng tỏa nhiệt:
- Giải phóng nhiệt năng, ΔH < 0, tự phát.
- Ví dụ: Cháy metan, tôi vôi.
- Phản ứng thu nhiệt:
- Hấp thụ nhiệt, ΔH > 0, cần cung cấp năng lượng.
- Ví dụ: Phân hủy CaCO₃ thành CaO và CO₂.
Phản ứng tỏa nhiệt khác với phản ứng thu nhiệt ở nhiệt năng.
Mình thấy sự khác biệt này rất quan trọng, vì phản ứng tỏa nhiệt cung cấp năng lượng, còn phản ứng thu nhiệt cần năng lượng để sản xuất hóa chất như phân bón. Để hiểu thêm về CaCO₃, bạn có thể xem vôi bột là gì.
Cách đo biến thiên enthalpy
Mình rất thích khám phá cách đo biến thiên enthalpy để hiểu rõ hơn về phản ứng tỏa nhiệt:
- Tính ΔH bằng năng lượng liên kết:
ΔH = (Tổng năng lượng liên kết chất phản ứng) – (Tổng năng lượng liên kết sản phẩm).
Ví dụ: Cháy H₂: H₂ + ½O₂ → H₂O, ΔH = -241,8 kJ/mol. - Sử dụng nhiệt lượng kế: Đo nhiệt năng tỏa ra từ phản ứng.
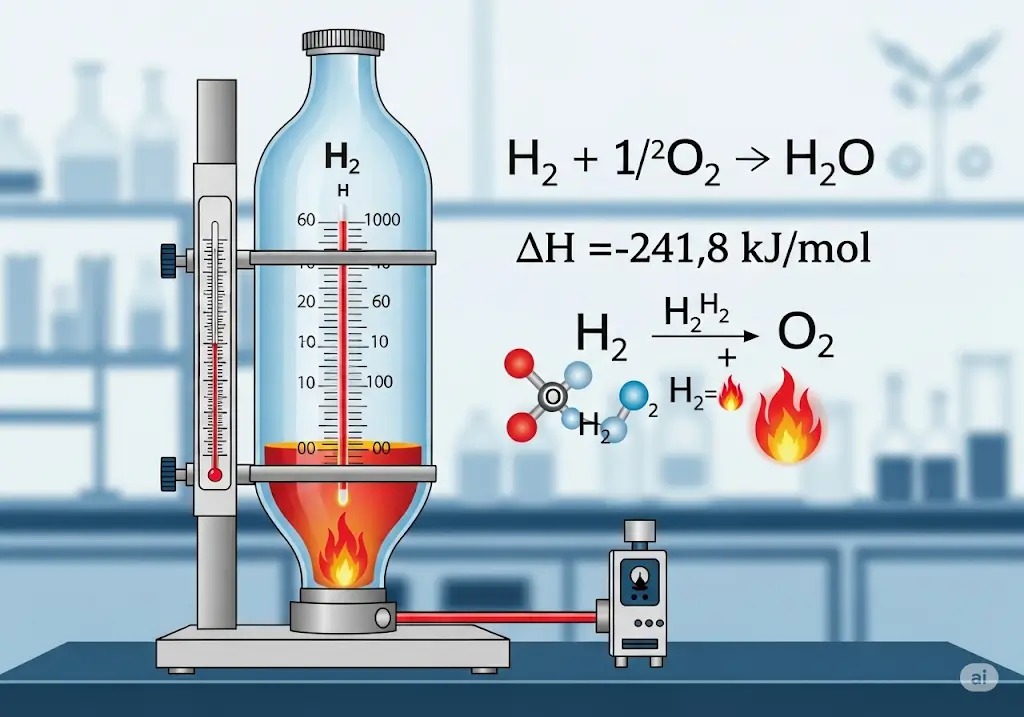
- Ứng dụng thực tế: Đo ΔH để tối ưu hóa sản xuất năng lượng hoặc hóa chất.
Biến thiên enthalpy đo bằng nhiệt lượng kế.
Mình thấy việc đo ΔH rất quan trọng trong công nghiệp, giúp các nhà máy như VietChem tính toán hiệu quả năng lượng.
Câu Hỏi Thường Gặp (FAQs)
1. Phản ứng tỏa nhiệt là gì?
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng nhiệt năng, có biến thiên enthalpy âm.
2. Tính chất của phản ứng tỏa nhiệt là gì?
Phản ứng tỏa nhiệt tự phát, giải phóng nhiệt, ΔH < 0, làm nóng môi trường.
3. Ứng dụng của phản ứng tỏa nhiệt là gì?
Dùng trong sản xuất xi măng, đốt nhiên liệu, và hô hấp tế bào.
4. Ví dụ phản ứng tỏa nhiệt là gì?
Cháy metan, tôi vôi, trung hòa HCl với NaOH.
5. Phản ứng tỏa nhiệt khác gì thu nhiệt?
Phản ứng tỏa nhiệt giải phóng nhiệt, tự phát; thu nhiệt hấp thụ nhiệt, cần năng lượng.
6. Làm sao đo biến thiên enthalpy?
Dùng nhiệt lượng kế hoặc tính năng lượng liên kết của phản ứng tỏa nhiệt.
Kết luận
Mình hy vọng bài viết đã giúp bạn hiểu rõ phản ứng tỏa nhiệt là gì và vai trò của nó. Hãy để lại bình luận, chia sẻ, hoặc khám phá thêm tại Hóa Chất Doanh Tín để cập nhật kiến thức hóa chất!
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









