Kiến thức chuyên môn
Oxit là gì? Thành phần và đặc điểm nhận diện
Oxit, một trong những hợp chất hóa học phổ biến nhất trên vỏ Trái Đất, không chỉ là kiến thức nền tảng trong sách giáo khoa mà còn là thành phần sống còn trong hàng loạt ngành công nghiệp hiện đại. Từ xi măng xây dựng nên những công trình kiên cố đến chất tạo màu trong sơn và mỹ phẩm, hiểu đúng và đủ về oxit là chìa khóa để tối ưu hóa sản xuất và đảm bảo chất lượng sản phẩm. Vậy bản chất oxit là gì? Chúng được phân loại và ứng dụng trong thực tiễn ra sao?
Với kinh nghiệm 20 năm trong ngành cung ứng hóa chất công nghiệp, Hóa Chất Doanh Tín sẽ cung cấp một góc nhìn toàn diện, kết hợp giữa lý thuyết hóa học chuẩn xác và những ứng dụng thực tiễn có giá trị cho doanh nghiệp của bạn. Bài viết được tham vấn và kiểm duyệt bởi đội ngũ kỹ sư hóa học với hơn 20 năm kinh nghiệm thực chiến của chúng tôi.
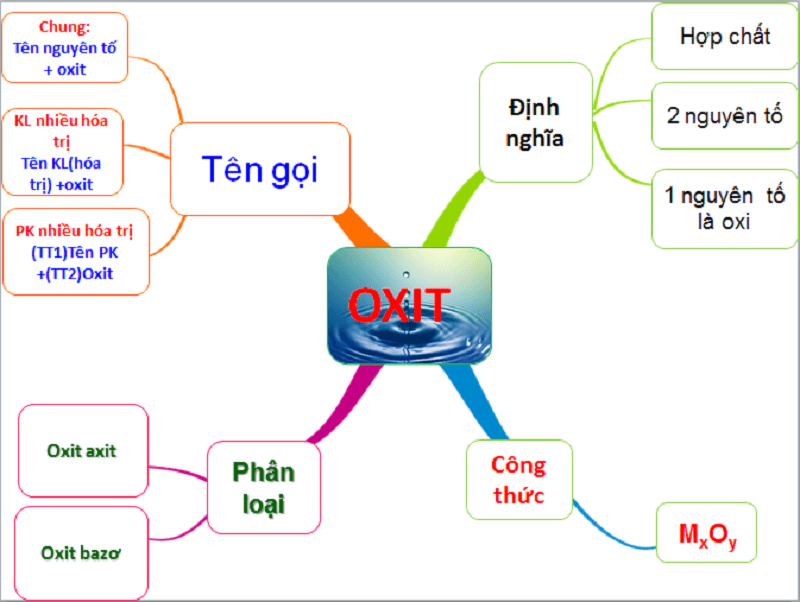
1. Oxit được định nghĩa chính xác là gì?
Oxit là một hợp chất hóa học được tạo thành từ hai nguyên tố, trong đó bắt buộc phải có một nguyên tố là oxy với số oxi hóa -2.

Về mặt hóa học, công thức tổng quát của oxit là M_xO_y, trong đó M là ký hiệu của một nguyên tố hóa học khác (có thể là kim loại hoặc phi kim), còn x và y là các chỉ số nguyên tử tương ứng của nguyên tố đó và oxy. Cấu trúc này là nền tảng cho sự đa dạng của các loại oxit trong tự nhiên và công nghiệp.
Làm thế nào để gọi tên oxit chuẩn theo IUPAC?
Quy tắc gọi tên oxit phụ thuộc vào việc nguyên tố kết hợp với oxy là kim loại hay phi kim và hóa trị của chúng.
Việc gọi tên chính xác giúp phân biệt hàng ngàn loại oxit khác nhau, điều này đặc biệt quan trọng trong môi trường công nghiệp và nghiên cứu để đảm bảo an toàn và chất lượng. Có ba quy tắc chính:
- Đối với oxit của kim loại có một hóa trị: Tên Kim Loại + “Oxit”. Ví dụ: CaO – Canxi Oxit, Al_2O_3 – Nhôm Oxit.
- Đối với oxit của kim loại có nhiều hóa trị: Tên Kim Loại + (Hóa trị) + “Oxit”. Ví dụ: FeO – Sắt (II) Oxit, Fe_2O_3 – Sắt (III) Oxit.
- Đối với oxit của phi kim: (Tiền tố chỉ số phi kim) + Tên Phi kim + (Tiền tố chỉ số Oxy) + “Oxit”. Các tiền tố phổ biến bao gồm mono- (1), đi- (2), tri- (3), penta- (5). Ví dụ: CO_2 – Cacbon Đioxit, P_2O_5 – Điphotpho Pentaoxit.
2. Oxit được phân loại trong hóa học và công nghiệp như thế nào?
Dựa trên khả năng phản ứng hóa học, oxit được chia thành bốn nhóm chính: oxit bazơ, oxit axit, oxit lưỡng tính và oxit trung tính.
Hiểu rõ cách phân loại oxit là nền tảng để dự đoán tính chất hóa học và xác định đúng ứng dụng của chúng trong thực tiễn sản xuất. Mỗi loại có những đặc điểm và vai trò riêng biệt.
Oxit bazơ (Basic Oxides) là gì?
Oxit bazơ thường là oxit của kim loại và có khả năng tác dụng với axit để tạo thành muối và nước.
Định nghĩa chi tiết có thể xem tại bài viết oxit bazơ là gì. Một số oxit bazơ tan được trong nước tạo thành dung dịch bazơ (kiềm), ví dụ như Na_2O, K_2O, CaO, BaO.
Tính chất đặc trưng: CuO + 2HCl → CuCl_2 + H_2O
Phản ứng với nước: CaO + H_2O → Ca(OH)_2
Ứng dụng công nghiệp: Vôi sống (CaO) được dùng trong xây dựng, xử lý nước, sản xuất thép. MgO được dùng làm vật liệu chịu lửa.
Oxit axit (Acidic Oxides) là gì?
Oxit axit thường là oxit của phi kim và có khả năng tác dụng với dung dịch bazơ để tạo thành muối và nước.
Hầu hết các oxit axit khi tác dụng với nước sẽ tạo ra dung dịch axit tương ứng, đây là một tính chất quan trọng trong nhiều quy trình công nghiệp.
Tính chất đặc trưng: CO_2 + 2NaOH → Na_2CO_3 + H_2O
Phản ứng với nước: SO_3 + H_2O → H_2SO_4 (Axit Sunfuric)
Ứng dụng công nghiệp: SO_2 là tiền chất sản xuất axit sunfuric. SiO_2 (Silic Đioxit) là thành phần chính của thủy tinh, gốm sứ. CO_2 dùng trong sản xuất đồ uống có ga, chữa cháy.
Oxit lưỡng tính (Amphoteric Oxides) là gì?
Đây là nhóm oxit đặc biệt, có khả năng phản ứng vừa như một axit, vừa như một bazơ, tức là tác dụng được với cả dung dịch axit và dung dịch bazơ mạnh.
Các oxit lưỡng tính phổ biến bao gồm Al_2O_3 (Nhôm Oxit), ZnO (Kẽm Oxit), Cr_2O_3, và PbO.
Phương trình minh họa (Al_2O_3):
Tác dụng với axit: Al_2O_3 + 6HCl → 2AlCl_3 + 3H_2O
Tác dụng với bazơ: Al_2O_3 + 2NaOH → 2NaAlO_2 + H_2O
Ứng dụng công nghiệp: Al_2O_3 dùng trong sản xuất nhôm, làm vật liệu mài, gốm kỹ thuật. ZnO được dùng trong ngành cao su, mỹ phẩm, dược phẩm.
Oxit trung tính (Neutral Oxides) là gì?
Oxit trung tính, hay còn gọi là oxit không tạo muối, là những oxit không tác dụng với axit, bazơ hay nước ở điều kiện thường.
Các oxit trung tính điển hình là CO (Cacbon Monoxit) và NO (Nitơ Monoxit). Cần lưu ý rằng mặc dù chúng “trơ” về mặt tạo muối, các oxit này lại có những phản ứng hóa học quan trọng khác và thường có độc tính cao, ảnh hưởng đến sức khỏe con người và môi trường.
3. Làm thế nào để so sánh nhanh các loại oxit?
Sử dụng bảng so sánh các đặc điểm chính như nguyên tố tạo thành, khả năng phản ứng với axit/bazơ, và sản phẩm khi tác dụng với nước là cách hiệu quả nhất.
Để dễ dàng nhận biết và áp dụng, bảng so sánh dưới đây tổng hợp các đặc điểm chính:
| Đặc điểm | Oxit Bazơ | Oxit Axit | Oxit Lưỡng Tính | Oxit Trung Tính |
|---|---|---|---|---|
| Nguyên tố tạo thành | Hầu hết Kim loại | Hầu hết Phi kim | Al, Zn, Cr, Pb… | N, C… |
| Phản ứng với Axit | Có ✅ | Không ❌ | Có ✅ | Không ❌ |
| Phản ứng với Bazơ | Không ❌ | Có ✅ | Có ✅ | Không ❌ |
| Sản phẩm với nước | Dung dịch Bazơ | Dung dịch Axit | Không phản ứng | Không phản ứng |
| Ví dụ công nghiệp | CaO, Fe_2O_3 | SiO_2, SO_3 | Al_2O_3, ZnO | CO, NO |
4. Những tính chất hóa học và vật lý quan trọng của oxit là gì?
Tính chất hóa học cốt lõi của oxit là khả năng phản ứng với nước, axit, và bazơ, trong khi tính chất vật lý quan trọng bao gồm trạng thái, nhiệt độ nóng chảy và màu sắc.
Các tính chất này là yếu tố quyết định vai trò và ứng dụng của chúng trong các quy trình sản xuất.
- Tác dụng với nước: Nhiều oxit axit tạo thành axit; một số oxit bazơ tạo thành bazơ (kiềm).
- Tác dụng với axit: Oxit bazơ và oxit lưỡng tính tạo thành muối và nước.
- Tác dụng với bazơ: Oxit axit và oxit lưỡng tính tạo thành muối và nước.
- Tác dụng lẫn nhau: Oxit axit tác dụng với oxit bazơ tạo thành muối. Phản ứng này, về bản chất là một dạng phản ứng trung hòa, là nền tảng của nhiều quy trình sản xuất công nghiệp như sản xuất thủy tinh hay luyện kim.
Những tính chất vật lý nào cần lưu ý?
Trạng thái (rắn, lỏng, khí), nhiệt độ nóng chảy, và màu sắc là các đặc tính vật lý cực kỳ quan trọng trong ứng dụng thực tế của oxit.
Ngoài tính chất hóa học, các đặc tính vật lý đóng vai trò không thể thiếu:
- Trạng thái: Hầu hết các oxit tồn tại ở trạng thái rắn ở điều kiện thường (ví dụ: CaO, Al_2O_3), một số ở thể khí (CO_2, SO_2).
- Nhiệt độ nóng chảy: Rất đa dạng. SiO_2 có nhiệt độ nóng chảy rất cao (~1700°C), là cơ sở để làm thủy tinh và vật liệu chịu lửa.
- Màu sắc: Nhiều oxit kim loại chuyển tiếp có màu sắc đặc trưng, được ứng dụng làm bột màu. Ví dụ, Fe_2O_3 (màu đỏ nâu), Cr_2O_3 (màu lục), TiO_2 (màu trắng).
5. Các phương pháp điều chế và sản xuất oxit công nghiệp là gì?
Hai phương pháp chính để sản xuất oxit trong công nghiệp là oxi hóa trực tiếp nguyên tố và nhiệt phân các hợp chất không bền như muối hoặc bazơ.
Quy mô và phương pháp điều chế oxit phụ thuộc vào mục đích sử dụng, từ phòng thí nghiệm đến nhà máy sản xuất hàng ngàn tấn.
- Oxi hóa trực tiếp nguyên tố: Đốt cháy kim loại hoặc phi kim trong oxy. Quá trình này về cơ bản là dùng chất oxi hóa là oxy để tạo ra hợp chất mới.
Ví dụ: S + O_2 → SO_2; 4Al + 3O_2 → 2Al_2O_3 - Nhiệt phân muối hoặc bazơ không bền: Đây là phương pháp phổ biến để sản xuất nhiều oxit công nghiệp.
Ví dụ sản xuất vôi sống (CaO): CaCO_3 → CaO + CO_2
Ví dụ khác: Cu(OH)_2 → CuO + H_2O
Góc Nhìn Chuyên Gia – Nguyễn Thị Mỹ Linh (Giám đốc Kỹ thuật Hóa Chất Doanh Tín)
“Trong sản xuất công nghiệp, phương pháp điều chế ảnh hưởng trực tiếp đến độ tinh khiết và cấu trúc hạt của sản phẩm oxit. Ví dụ, Kẽm Oxit (ZnO) sản xuất bằng phương pháp ‘French process’ (đốt cháy kẽm kim loại) sẽ có độ tinh khiết và độ mịn cao hơn, phù hợp cho ngành dược và mỹ phẩm. Trong khi đó, phương pháp ‘American process’ (đốt cháy quặng kẽm) có thể cho ra sản phẩm với chi phí thấp hơn, đáp ứng tốt cho ngành cao su. Việc hiểu rõ quy trình và lựa chọn đúng nhà cung cấp có năng lực là yếu tố then chốt để đảm bảo chất lượng đầu ra của sản phẩm cuối cùng.”
6. Những tiêu chuẩn chất lượng và an toàn nào cần tuân thủ khi sử dụng oxit công nghiệp?
Các sản phẩm oxit công nghiệp phải tuân thủ nghiêm ngặt các tiêu chuẩn chất lượng (TCVN, ISO) về độ tinh khiết, tạp chất và các quy định về an toàn lao động (sử dụng đồ bảo hộ, có MSDS).
Trong môi trường B2B, chất lượng và an toàn là yếu tố được đặt lên hàng đầu.
- Tiêu chuẩn chất lượng: Các chỉ số như độ tinh khiết (%), kích thước hạt, độ ẩm, và hàm lượng tạp chất được kiểm soát chặt chẽ theo TCVN (Tiêu chuẩn Việt Nam) hoặc ISO. Ví dụ, ZnO dùng cho ngành dược đòi hỏi độ tinh khiết > 99.5%, trong khi dùng cho ngành cao su có thể có tiêu chuẩn thấp hơn.
- An toàn lao động: Việc tiếp xúc với bụi oxit (như SiO_2, CaO) đòi hỏi trang bị bảo hộ lao động đầy đủ (kính, khẩu trang, găng tay). Cần có Bảng dữ liệu an toàn vật liệu (MSDS) cho mỗi loại hóa chất để hướng dẫn xử lý và ứng phó sự cố.
Doanh nghiệp có thể tìm thấy các tài nguyên an toàn và kỹ thuật ở đâu?
Hóa Chất Doanh Tín cung cấp các tài liệu kỹ thuật quan trọng như Bảng dữ liệu an toàn (MSDS) và hướng dẫn bảo quản để hỗ trợ khách hàng sử dụng sản phẩm an toàn và hiệu quả.
- ➡️ [Tải về] Bảng Dữ Liệu An Toàn (MSDS) cho Canxi Oxit (CaO)
- ➡️ [Tải về] Hướng Dẫn Bảo Quản Hóa Chất Công Nghiệp Theo Tiêu Chuẩn Việt Nam
- ➡️ [Tham khảo] Nguyên Tắc Chung Về Bảo Quản Hóa Chất An Toàn
Yêu Cầu Tư Vấn Kỹ Thuật Miễn Phí
7. Tại sao nên chọn Hóa Chất Doanh Tín làm đối tác cung cấp oxit công nghiệp?
Vì Hóa Chất Doanh Tín không chỉ cung cấp sản phẩm giá tốt mà còn cam kết về chất lượng ổn định, nguồn cung bền vững và dịch vụ tư vấn kỹ thuật chuyên sâu.
Việc lựa chọn nhà cung cấp oxit không chỉ đơn thuần là tìm kiếm một mức giá tốt, mà là tìm kiếm một đối tác có thể đảm bảo sự ổn định về chất lượng, nguồn cung và cung cấp sự hỗ trợ kỹ thuật cần thiết.
Tại Hóa Chất Doanh Tín, chúng tôi cam kết:
- Chất lượng đảm bảo: Cung cấp các sản phẩm oxit (CaO, ZnO,…) với đầy đủ chứng nhận chất lượng (COA) và tuân thủ các TCVN hiện hành.
- Nguồn cung ổn định: Hệ thống kho bãi và logistics hiện đại đảm bảo giao hàng đúng tiến độ cho mọi quy mô sản xuất.
- Tư vấn kỹ thuật: Đội ngũ chuyên gia của chúng tôi sẵn sàng tư vấn để giúp bạn lựa chọn đúng loại oxit với thông số kỹ thuật tối ưu nhất cho ứng dụng của mình.
8. Các câu hỏi thường gặp (FAQ) về oxit là gì?
1. Làm thế nào để phân biệt oxit axit và oxit bazo trong phòng thí nghiệm?
Cách đơn giản nhất là dùng giấy quỳ tím ẩm. Quỳ tím hóa đỏ là oxit axit, hóa xanh là oxit bazơ.
Bạn chỉ cần đặt một mẩu giấy quỳ tím ẩm lên bề mặt của oxit cần thử. Tuy nhiên, cần lưu ý rằng phương pháp này chỉ hiệu quả đối với các loại oxit có khả năng tác dụng với nước để tạo ra dung dịch axit hoặc bazơ tương ứng.
2. Sắt (III) oxit (Fe_2O_3) có phải là oxit lưỡng tính không?
Không. Fe_2O_3 chủ yếu thể hiện tính chất của một oxit bazơ.
Mặc dù sắt là kim loại, Sắt (III) oxit phản ứng tỏa nhiệt mạnh với các axit mạnh nhưng không phản ứng với dung dịch kiềm ở điều kiện thường, do đó nó được phân loại là một oxit bazơ.
3. Ứng dụng quan trọng nhất của Silic Đioxit (SiO_2) là gì?
Ứng dụng quan trọng nhất của SiO_2 là làm thành phần chính để sản xuất thủy tinh và gốm sứ.
Nhờ có nhiệt độ nóng chảy rất cao và tính trơ, Silic Đioxit là vật liệu lý tưởng cho ngành công nghiệp sản xuất vật liệu xây dựng và dân dụng. Ở dạng tinh khiết, nó còn được dùng trong sản xuất sợi quang và các linh kiện điện tử công nghệ cao.
4. Tại sao Cacbon Monoxit (CO) lại nguy hiểm?
CO là một chất khí không màu, không mùi, rất độc vì nó có khả năng liên kết với hemoglobin trong máu mạnh hơn oxy rất nhiều lần, gây ngạt thở.
CO là một oxit trung tính nhưng rất nguy hiểm và độc. Khi hít phải, CO sẽ chiếm chỗ của oxy trong máu, ngăn cản quá trình vận chuyển oxy đến các tế bào, có thể nhanh chóng dẫn đến tử vong. Đây là lý do tại sao ngộ độc khí CO (ví dụ từ bếp than) lại cực kỳ nguy hiểm.
Tuyên bố miễn trừ trách nhiệm: Thông tin trong bài viết này chỉ mang tính chất tham khảo và giáo dục. Việc ứng dụng bất kỳ hóa chất nào vào quy trình sản xuất cụ thể cần có sự tư vấn và giám sát của các chuyên gia có trình độ. Vui lòng liên hệ Hóa Chất Doanh Tín để được tư vấn kỹ thuật chính xác.
Bạn đã sẵn sàng tối ưu hóa quy trình sản xuất với nguồn cung oxit chất lượng cao?
Liên hệ ngay với Hóa Chất Doanh Tín để nhận báo giá cạnh tranh và giải pháp toàn diện.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









