Kiến thức chuyên môn
Oleum Là Gì? Hướng Dẫn Kỹ Thuật, An Toàn & Ứng Dụng 2025
Trong ngành công nghiệp hóa chất, việc nắm vững bản chất và đặc tính của từng hợp chất là yếu tố sống còn, kiến tạo nên hiệu quả sản xuất và an toàn vận hành. Một trong những hóa chất công nghiệp nền tảng nhưng thường bị hiểu nhầm là Oleum. Thường được biết đến với tên gọi “axit sunfuric bốc khói”, Oleum không chỉ đơn thuần là axit sunfuric (H₂SO₄) đậm đặc. Vậy Oleum là gì và tại sao nó lại đóng vai trò không thể thiếu trong nhiều quy trình sản xuất hiện đại?
Bài viết này từ các chuyên gia của Hóa Chất Doanh Tín sẽ cung cấp một góc nhìn kỹ thuật sâu sắc, toàn diện về Oleum: từ cấu trúc hóa học, các cấp nồng độ thương mại, ứng dụng chiến lược cho đến các quy định an toàn và tuân thủ nghiêm ngặt tại Việt Nam.
Cần tư vấn mua Oleum chất lượng cao? Gọi ngay hotline của chúng tôi hoặc yêu cầu báo giá trực tuyến.
1. Oleum là gì và được phân biệt với Axit Sunfuric như thế nào?
Oleum, hay Axit Sunfuric bốc khói, là một dung dịch của lưu huỳnh trioxit (SO₃) hòa tan trong axit sunfuric (H₂SO₄) 100%. Điểm khác biệt chính là Oleum chứa SO₃ “tự do”, trong khi nồng độ H₂SO₄ tối đa trong nước chỉ là 98.3%.

Về bản chất, Oleum (còn gọi là Axit Fuming Sunfuric) là một dung dịch của lưu huỳnh trioxit (SO₃) được hòa tan trong 100% axit sunfuric (H₂SO₄). Công thức hóa học tổng quát của nó là H₂SO₄·xSO₃ hoặc đôi khi được biểu diễn dưới dạng H₂S₂O₇ (axit disulfuric), một thành phần chính trong Oleum.
Điểm khác biệt cốt lõi nằm ở sự hiện diện của SO₃ “tự do”:
- Axit Sunfuric (H₂SO₄): Nồng độ tối đa trong nước là 98.3%. Bất kỳ sự bổ sung SO₃ nào vượt qua ngưỡng này sẽ không tạo thành H₂SO₄ nữa mà bắt đầu tồn tại dưới dạng SO₃ tự do.
- Oleum: Chứa hàm lượng SO₃ tự do, tạo ra một hợp chất có khả năng phản ứng và tính chất vật lý khác biệt hoàn toàn. Chính lượng SO₃ tự do này khi tiếp xúc với hơi ẩm trong không khí sẽ tạo ra làn khói trắng dày đặc đặc trưng, do đó có tên gọi “axit bốc khói”, một dạng axit ăn mòn cực mạnh.
Các cấp nồng độ thương mại của Oleum là gì?
Nồng độ Oleum được quy định bởi phần trăm khối lượng SO₃ tự do (% free SO₃), thường được quy đổi tương đương sang nồng độ % H₂SO₄ lớn hơn 100%.
Nồng độ của Oleum không được biểu thị bằng % H₂SO₄ như thông thường. Thay vào đó, nó được quy định bởi phần trăm khối lượng của SO₃ tự do (% free SO₃) hoặc được quy đổi tương đương sang nồng độ % H₂SO₄ (lớn hơn 100%).
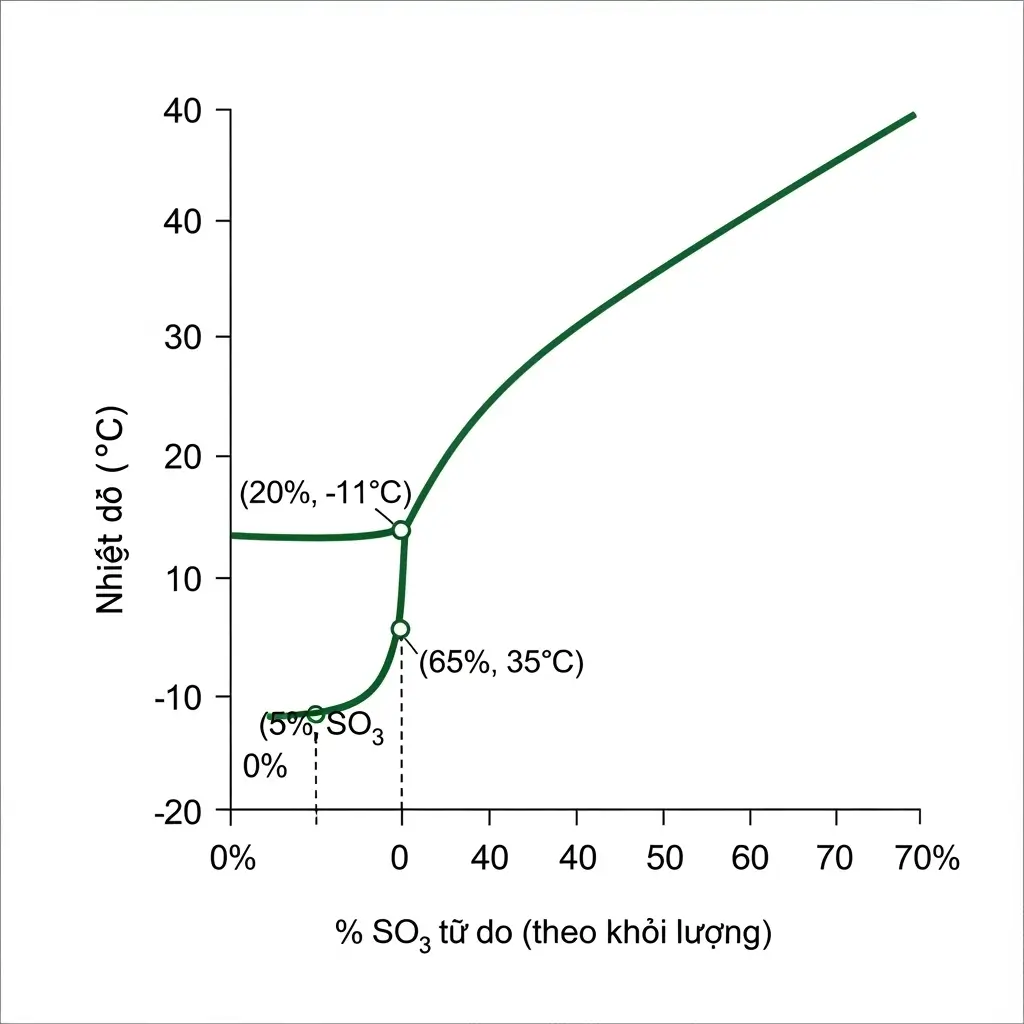
| % SO₃ Tự Do | Tương Đương % H₂SO₄ | Điểm Đông Đặc (Xấp xỉ °C) | Ứng Dụng Chính |
|---|---|---|---|
| 20% | 104.5% | -11°C | Sản xuất H₂SO₄, chất tẩy rửa |
| 30% | 106.75% | 15°C | Tổng hợp hữu cơ, hóa dược |
| 65% | 114.6% | 35°C | Sản xuất thuốc nổ, chất xúc tác |
Ghi chú chuyên gia từ ông Nguyễn Văn An, Trưởng phòng Kỹ thuật Hóa Chất Doanh Tín: Việc lựa chọn nồng độ Oleum phụ thuộc rất nhiều vào điều kiện khí hậu và hệ thống lưu trữ của nhà máy. Tại Việt Nam, với khí hậu nóng ẩm, Oleum 65% cần hệ thống gia nhiệt đường ống để tránh đông đặc, trong khi Oleum 20% linh hoạt hơn trong vận hành.
2. Các tính chất vật lý và hóa học quan trọng của Oleum là gì?
Oleum là chất lỏng nhờn, nặng hơn nước, có điểm đông đặc thay đổi theo nồng độ. Về mặt hóa học, nó là một tác nhân oxy hóa và khử nước cực mạnh, phản ứng mãnh liệt với nước và ít ăn mòn thép carbon hơn axit sunfuric loãng.
Những tính chất vật lý nổi bật của Oleum là gì?
- Trạng thái: Là chất lỏng, nhờn, không màu đến hơi vàng hoặc nâu tùy thuộc vào độ tinh khiết.
- Khối lượng riêng: Nặng hơn đáng kể so với nước (khoảng 1.9 g/cm³), thay đổi theo nồng độ SO₃.
- Điểm đông đặc: Đây là một đặc tính kỹ thuật cực kỳ quan trọng. Không giống như H₂SO₄ 98% có điểm đông đặc thấp, điểm đông đặc của Oleum thay đổi phức tạp theo nồng độ. Oleum với hàm lượng SO₃ tự do cao có thể đông đặc ở nhiệt độ phòng, đòi hỏi hệ thống lưu trữ và đường ống phải có cơ chế gia nhiệt.
Những tính chất hóa học đặc trưng của Oleum là gì?
- Tính khử nước và oxy hóa cực mạnh: Do sự hiện diện của SO₃, Oleum là một trong những chất khử nước và tác nhân oxy hóa mạnh nhất. Nó có thể carbon hóa nhiều hợp chất hữu cơ (như đường, vải) ngay lập tức khi tiếp xúc.
- Phản ứng với nước: Đây là một phản ứng tỏa nhiệt điển hình, diễn ra cực kỳ mãnh liệt. Tuyệt đối không được đổ nước vào Oleum, mà phải thêm từ từ Oleum vào nước với hệ thống làm mát và khuấy trộn liên tục.
- Tính ăn mòn: Một nghịch lý thú vị là Oleum ít ăn mòn thép carbon hơn axit sunfuric loãng. Lý do là vì thiếu “nước tự do” để tham gia vào quá trình ăn mòn điện hóa. Điều này cho phép vận chuyển Oleum trong các bồn chứa bằng thép chuyên dụng.
3. Quy trình điều chế Oleum trong công nghiệp diễn ra như thế nào?
Oleum được sản xuất qua phương pháp tiếp xúc (Contact Process) gồm 3 giai đoạn: tạo khí SO₂, oxy hóa SO₂ thành SO₃, và cuối cùng là hấp thụ khí SO₃ bằng H₂SO₄ đậm đặc để tạo thành Oleum.
Oleum là sản phẩm trung gian trong phương pháp tiếp xúc (Contact Process), phương pháp sản xuất H₂SO₄ hiện đại và phổ biến nhất trên thế giới.
Quy trình gồm 3 giai đoạn chính:
- Tạo SO₂: Đốt lưu huỳnh (S), một đơn chất quan trọng, hoặc quặng pirit sắt (FeS₂) trong không khí để tạo ra khí lưu huỳnh đioxit (SO₂).
S(s) + O₂(g) → SO₂(g) - Oxy hóa thành SO₃: Hỗn hợp khí SO₂ và oxy dư được dẫn qua các lớp chất xúc tác (thường là Vanadium pentoxide, V₂O₅) ở nhiệt độ 400-450°C để tạo thành lưu huỳnh trioxit (SO₃).
2SO₂(g) + O₂(g) ⇌ 2SO₃(g) (xúc tác V₂O₅, t°) - Hấp thụ SO₃ bằng H₂SO₄: SO₃ được dẫn vào tháp hấp thụ, nơi nó được phun ngược chiều với dòng axit sunfuric 98% đậm đặc. SO₃ hòa tan dễ dàng vào H₂SO₄ để tạo thành Oleum.
H₂SO₄(đặc) + nSO₃(g) → H₂SO₄·nSO₃(l)
Sau đó, Oleum được pha loãng với một quy trình được kiểm soát chặt chẽ để tạo ra axit sunfuric ở nồng độ mong muốn.
4. Các ứng dụng chiến lược của Oleum trong các ngành công nghiệp tại Việt Nam là gì?
Oleum được ứng dụng rộng rãi làm hóa chất trung gian sản xuất và vận chuyển H₂SO₄, sản xuất thuốc nổ, tổng hợp hữu cơ (sản xuất chất tẩy rửa, dược phẩm, thuốc nhuộm), và trong ngành tinh chế dầu mỏ.
Khả năng phản ứng vượt trội của Oleum làm cho nó trở thành một hóa chất không thể thay thế trong nhiều lĩnh vực.
Tại sao Oleum được dùng làm hóa chất trung gian và vận chuyển H₂SO₄?
Đây là ứng dụng lớn nhất. Sản xuất Oleum và sau đó pha loãng giúp quá trình sản xuất H₂SO₄ hiệu quả hơn. Đồng thời, việc vận chuyển Oleum trong bồn thép an toàn và kinh tế hơn.
Vai trò của Oleum trong sản xuất thuốc nổ và nhiên liệu tên lửa là gì?
Trong quá trình tổng hợp các chất nổ như Trinitrotoluene (TNT), Oleum được sử dụng như một tác nhân khử nước cực mạnh trong hỗn hợp axit nitrat hóa (axit nitric và axit sunfuric), giúp phản ứng diễn ra hoàn toàn và an toàn.
Oleum được ứng dụng trong tổng hợp hữu cơ và sulfonat hóa như thế nào?
Oleum là tác nhân sulfonat hóa hàng đầu, nền tảng để sản xuất:
- Chất tẩy rửa tổng hợp: Sản xuất LAS (Linear Alkylbenzene Sulfonate), thành phần chính trong bột giặt và nước rửa chén tại các nhà máy lớn ở Đồng Nai, Bình Dương.
- Dược phẩm: Tổng hợp các loại thuốc sulfa.
- Thuốc nhuộm: Tạo ra các phẩm nhuộm cho ngành dệt may phát triển mạnh tại Việt Nam.
Ứng dụng của Oleum trong tinh chế dầu mỏ và hóa dầu là gì?
Tại các nhà máy tinh chế dầu mỏ như Dung Quất, Nghi Sơn, Oleum được sử dụng trong các quy trình alkyl hóa và tinh chế để loại bỏ tạp chất, nâng cao chỉ số octan của xăng.
Case Study: Ứng dụng Oleum tại Nhà máy Dệt Nhuộm
Công ty Dệt May ABC, một đối tác lâu năm của chúng tôi tại Long An, đã đối mặt với thách thức về độ bền màu của sản phẩm. Sau khi được đội ngũ kỹ thuật của Hóa Chất Doanh Tín tư vấn, họ đã chuyển đổi từ việc sử dụng H₂SO₄ đặc sang Oleum 20% trong giai đoạn sulfonat hóa thuốc nhuộm. Kết quả: độ bền màu tăng 15%, giảm 10% lượng thuốc nhuộm sử dụng, và tiết kiệm chi phí xử lý nước thải do phản ứng hiệu quả hơn. Đây là một minh chứng cho việc lựa chọn đúng loại hóa chất và nồng độ có thể tạo ra lợi thế cạnh tranh đáng kể.
5. Cần tuân thủ các quy định an toàn lao động và pháp luật nào khi làm việc với Oleum tại Việt Nam?
Khi làm việc với Oleum, phải tuân thủ nghiêm ngặt các biện pháp an toàn (sử dụng PPE đầy đủ, khu vực làm việc thông thoáng có trang bị khẩn cấp) và các quy định của pháp luật Việt Nam, cụ thể là Nghị định 113/2017/NĐ-CP và các tiêu chuẩn về ghi nhãn hóa chất GHS.
Giống như nhiều hóa chất công nghiệp có thể gây hại, Oleum cực kỳ nguy hiểm, đòi hỏi sự tuân thủ nghiêm ngặt các quy trình bảo quản hóa chất an toàn. Tại Hóa Chất Doanh Tín, an toàn luôn là ưu tiên số một.
Các mối nguy chính từ Oleum là gì?
- Bỏng hóa học nặng: Gây bỏng sâu và phá hủy mô ngay lập tức.
- Tổn thương hô hấp: Hít phải khói SO₃ gây phù phổi và có thể gây tử vong.
- Phản ứng dữ dội: Phản ứng tỏa nhiệt cực mạnh với nước, có nguy cơ gây nổ.
Các biện pháp an toàn bắt buộc khi sử dụng Oleum là gì?
- Trang bị bảo hộ cá nhân (PPE): Luôn sử dụng quần áo bảo hộ chống axit (level A/B), găng tay butyl, ủng, mặt nạ phòng độc toàn mặt có phin lọc ABEK và kính bảo hộ.
- Khu vực làm việc: Phải thông gió tốt, có sẵn vòi sen khẩn cấp, trạm rửa mắt và các vật liệu trung hòa sự cố tràn đổ (như soda ash).
- Lưu trữ: Chứa trong các bồn chứa bằng thép carbon, tránh xa các nguồn nước, chất dễ cháy và bazơ.
Những quy định nào của Việt Nam cần tuân thủ?
Tại Việt Nam, Oleum nằm trong danh mục hóa chất nguy hiểm và phải tuân thủ:
- Nghị định 113/2017/NĐ-CP: Quy định chi tiết và hướng dẫn thi hành một số điều của Luật Hóa chất. Oleum thuộc danh mục hóa chất sản xuất, kinh doanh có điều kiện.
- Thông tin an toàn hóa chất (MSDS): Mọi lô hàng Oleum phải đi kèm với Bảng Dữ liệu An toàn bằng tiếng Việt, tuân thủ các tiêu chuẩn về ghi nhãn hóa chất theo GHS.
TẢI VỀ HƯỚNG DẪN XỬ LÝ SỰ CỐ TRÀN ĐỔ OLEUM (PDF)
Tài liệu độc quyền từ Hóa Chất Doanh Tín, cung cấp quy trình 5 bước xử lý sự cố tràn đổ Oleum an toàn và hiệu quả, giúp doanh nghiệp xây dựng kế hoạch ứng phó sự cố hóa chất theo quy định.
6. Các câu hỏi thường gặp (FAQ) về Oleum là gì?
Tại sao không thể vận chuyển H₂SO₄ 100% mà phải là Oleum?
Thực tế, H₂SO₄ 100% có điểm đông đặc cao (~10°C), gây khó khăn cho việc bơm và vận chuyển. Trong khi đó, Oleum 20-30% hoặc H₂SO₄ 98% có điểm đông đặc thấp hơn nhiều, thuận tiện hơn trong vận hành.
Làm thế nào để tính toán lượng nước cần để pha loãng Oleum?
Đây là một tính toán hóa học quan trọng. Ví dụ, để pha loãng Oleum 20% thành H₂SO₄ 98%, cần tính toán dựa trên phản ứng SO₃ + H₂O → H₂SO₄. Đội ngũ kỹ thuật của chúng tôi sẵn sàng hỗ trợ bạn tính toán chính xác cho quy trình sản xuất của mình.
[NÚT BẤM: YÊU CẦU TƯ VẤN KỸ THUẬT]
Hóa Chất Doanh Tín cung cấp những loại Oleum nào?
Chúng tôi cung cấp Oleum với các cấp nồng độ khác nhau, phổ biến là 20%, 30% và 65%, được nhập khẩu từ các nhà sản xuất uy tín, đảm bảo chất lượng và độ tinh khiết theo tiêu chuẩn công nghiệp.
Disclaimer: Các thông tin kỹ thuật và an toàn trong bài viết này chỉ mang tính chất tham khảo. Người sử dụng phải luôn tuân thủ theo Bảng Dữ liệu An toàn (MSDS) đi kèm sản phẩm và các quy định an toàn tại nơi làm việc. Hóa Chất Doanh Tín không chịu trách nhiệm cho bất kỳ thiệt hại nào phát sinh từ việc sử dụng thông tin này không đúng cách.
Kết Luận: Lựa Chọn Đối Tác Cung Cấp Oleum Uy Tín
Từ việc là một chất trung gian thiết yếu trong sản xuất H₂SO₄ đến vai trò không thể thay thế trong tổng hợp hữu cơ, Oleum rõ ràng là một trụ cột của ngành công nghiệp hóa chất hiện đại. Tuy nhiên, sức mạnh của nó luôn đi kèm với những yêu cầu nghiêm ngặt về kỹ thuật và an toàn.
Hiểu rõ Oleum là gì không chỉ dừng lại ở công thức hóa học, mà còn là việc nắm bắt các sắc thái về nồng độ, tính chất vật lý và các quy trình vận hành an toàn. Việc lựa chọn một nhà cung cấp như Hóa Chất Doanh Tín, một đơn vị không chỉ cung cấp sản phẩm đạt chuẩn mà còn có đủ chuyên môn để tư vấn kỹ thuật, hỗ trợ an toàn và đảm bảo tuân thủ pháp luật, là một quyết định đầu tư chiến lược cho sự phát triển bền vững và an toàn của doanh nghiệp bạn.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










