Kiến thức chuyên môn
Natri Oxit (Na₂O) là gì? Tính Chất & Ứng Dụng Công Nghiệp
Bạn có biết rằng một thay đổi nhỏ về hàm lượng Natri Oxit (Na₂O) có thể quyết định độ trong, độ bền và cả chi phí năng lượng trong sản xuất thủy tinh và gốm sứ? Trong ngành hóa chất công nghiệp, Na₂O không chỉ là một công thức hóa học, mà là một yếu tố chiến lược giúp tối ưu hóa sản xuất và nâng cao chất lượng sản phẩm.
Tại Hóa Chất Doanh Tín, chúng tôi hiểu rằng việc nắm vững kiến thức kỹ thuật về các hợp chất nền tảng như Na₂O là chìa khóa để tạo ra lợi thế cạnh tranh. Hãy cùng các chuyên gia của chúng tôi đi sâu phân tích hợp chất oxit bazơ quan trọng này.
1. Natri Oxit (Na₂O) là gì và có tổng quan kỹ thuật như thế nào?
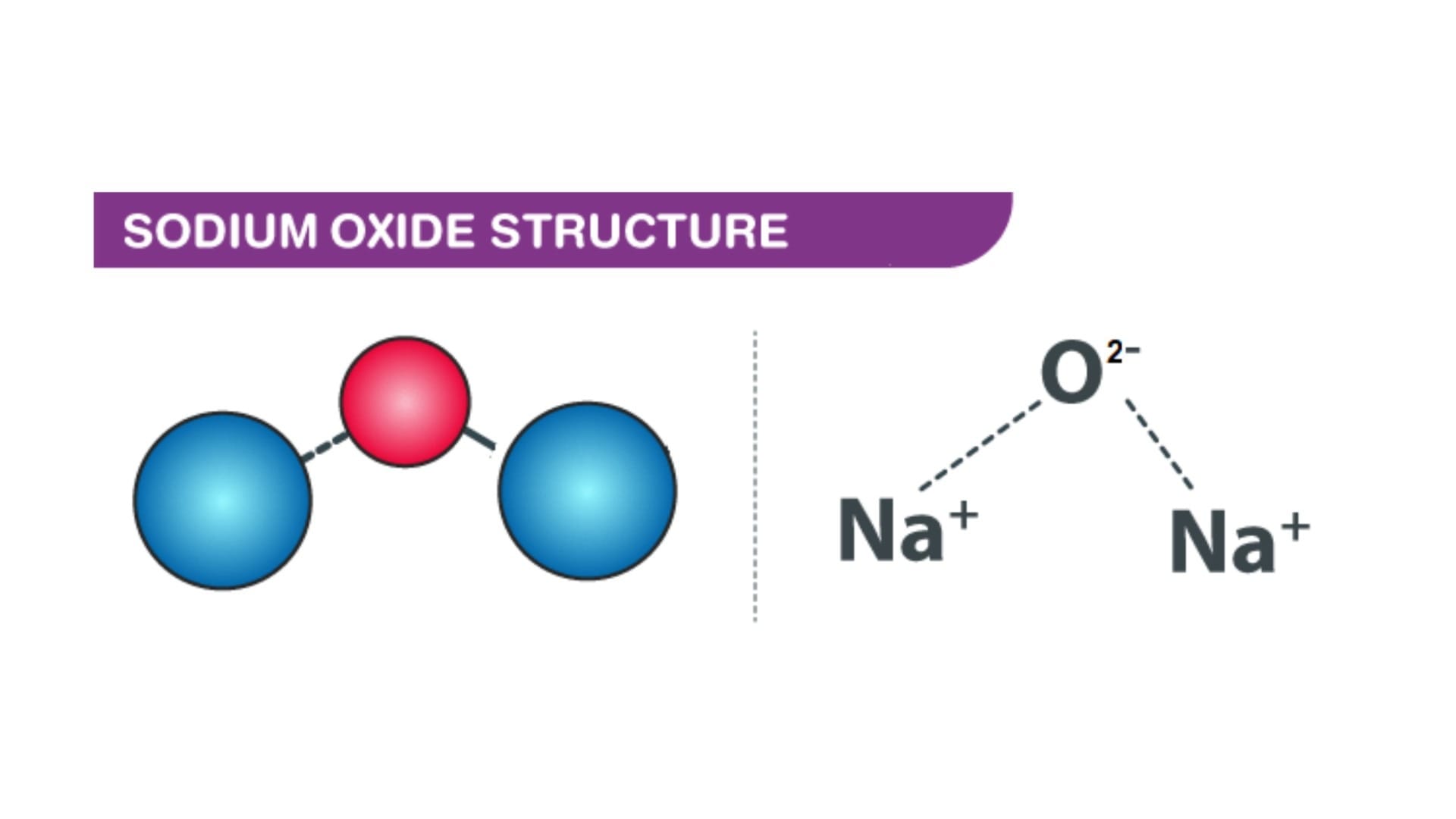
Natri Oxit (Na₂O) là một hợp chất vô cơ dạng bột trắng, được tạo thành từ liên kết ion giữa Natri và Oxy. Về mặt kỹ thuật, nó là một oxit bazơ mạnh với cấu trúc tinh thể antiflorite, đóng vai trò nền tảng để sản xuất nhiều hợp chất kiềm quan trọng khác.
Natri Oxit, công thức hóa học là Na₂O, là một hợp chất vô cơ được tạo thành từ liên kết ion giữa hai nguyên tử Natri (Na⁺) và một nguyên tử Oxy (O²⁻). Ở điều kiện tiêu chuẩn, nó tồn tại dưới dạng bột rắn hoặc tinh thể màu trắng.

Bột Natri Oxit (Na₂O) tinh khiết, thể hiện màu trắng đặc trưng và trạng thái rắn ở điều kiện thường.
Về mặt cấu trúc, Na₂O có mạng tinh thể antiflorite đặc trưng, một cấu trúc giúp nó có những tính chất hóa học và vật lý độc đáo. Đây là một trong những oxit bazơ mạnh và điển hình nhất, đóng vai trò là chất nền để sản xuất nhiều hợp chất kiềm quan trọng khác.
2. Các tính chất vật lý của Natri Oxit được phân tích như thế nào?
Các thông số vật lý của Na₂O được xác định thông qua các phép đo tiêu chuẩn trong phòng thí nghiệm, bao gồm trạng thái (bột rắn trắng), khối lượng phân tử (61.979 g/mol), mật độ (2.27 g/cm³), điểm nóng chảy và điểm sôi cao, cùng khả năng phản ứng mạnh với nước để tạo thành Natri Hydroxide.
Các thông số vật lý của Na₂O ảnh hưởng trực tiếp đến cách nó được sử dụng và xử lý trong môi trường công nghiệp. Việc hiểu rõ các đặc tính này giúp đảm bảo hiệu quả và an toàn trong sản xuất. Dữ liệu cập nhật đến tháng 9 năm 2025 cho thấy các thông số này vẫn là tiêu chuẩn tham chiếu trong ngành.
- Trạng thái: Bột rắn màu trắng, không mùi.
- Khối lượng phân tử: 61.979 g/mol.
- Mật độ: 2.27 g/cm³.
- Nhiệt độ nóng chảy: 1,132 °C (1,405 K) – Một ngưỡng nhiệt độ cao, cho thấy sự ổn định của nó trong các ứng dụng nhiệt.
- Nhiệt độ sôi: 1,950 °C (2,223 K), tuy nhiên hợp chất này thăng hoa ở nhiệt độ nóng chảy và bắt đầu phân hủy.
- Độ hòa tan: Phản ứng mạnh với nước để tạo thành Natri Hydroxide (NaOH).
Góc nhìn chuyên gia – Nguyễn Thị Mỹ Linh (Trưởng phòng Kỹ thuật Hóa Chất Doanh Tín):
“Khi làm việc với khách hàng ngành gốm sứ, chúng tôi luôn nhấn mạnh tầm quan trọng của nhiệt độ nóng chảy. Mặc dù Na₂O nóng chảy ở 1,132°C, nhưng vai trò của nó là làm giảm điểm nóng chảy của cả hệ thống phối liệu men. Việc kiểm soát chính xác hàm lượng Na₂O giúp khách hàng đạt được nhiệt độ nung tối ưu, tiết kiệm gas và tăng hiệu suất lò nung lên tới 15%.”
3. Những tính chất hóa học then chốt và ứng dụng của Na₂O là gì?
Các tính chất hóa học then chốt của Na₂O bao gồm khả năng phản ứng mãnh liệt với nước tạo bazơ, tác dụng với axit tạo muối và nước (phản ứng trung hòa), và phản ứng với oxit axit để tạo muối. Những đặc tính này là chìa khóa cho các ứng dụng công nghiệp quan trọng.
Bản chất của Natri Oxit được thể hiện rõ nhất qua các phản ứng hóa học của nó. Với vai trò là một oxit bazơ mạnh, Na₂O là chìa khóa cho nhiều quy trình công nghiệp.
3.1. Phản ứng với Nước tạo nền tảng của Tính Kiềm diễn ra như thế nào?
Na₂O phản ứng cực kỳ mãnh liệt và tỏa nhiệt lớn khi tiếp xúc với nước, tạo ra dung dịch Natri Hydroxide (NaOH), một bazơ mạnh. Đây là tính chất đặc trưng và quan trọng nhất của nó.
Đây là tính chất đặc trưng và quan trọng nhất. Na₂O phản ứng cực kỳ mãnh liệt với nước, tạo ra dung dịch Natri Hydroxide (NaOH) và giải phóng một lượng nhiệt lớn (một ví dụ điển hình của phản ứng tỏa nhiệt).
Na₂O + H₂O → 2NaOH
Ý nghĩa thực tiễn: Phản ứng này là cơ sở để sản xuất xút (NaOH), một trong những hóa chất công nghiệp cơ bản nhất. Tuy nhiên, chính vì phản ứng mạnh này mà việc bảo quản hóa chất như Na₂O phải tuyệt đối tránh xa môi trường ẩm.
3.2. Tại sao Na₂O tác dụng với Axit là một phản ứng Trung hòa điển hình?
Vì Na₂O là một oxit bazơ, nó phản ứng với axit để tạo ra sản phẩm là muối và nước, đây chính là định nghĩa của một phản ứng trung hòa, làm mất đi tính axit và tính bazơ của các chất tham gia.
Là một oxit bazơ, Na₂O dễ dàng phản ứng với các axit mạnh như HCl, H₂SO₄ để tạo thành muối và nước. Đây là một phản ứng trung hòa cổ điển.
Na₂O + 2HCl → 2NaCl + H₂O
Na₂O + H₂SO₄ → Na₂SO₄ + H₂O
Ý nghĩa thực tiễn: Khả năng trung hòa axit được ứng dụng trong việc xử lý các dòng thải có tính axit hoặc điều chỉnh độ pH trong một số quy trình hóa học.
3.3. Phản ứng với Oxit Axit của Na₂O là chìa khóa trong ngành Thủy tinh như thế nào?
Na₂O phản ứng với Silic Dioxit (SiO₂, một oxit axit và là thành phần chính của cát), hoạt động như một chất trợ dung (flux). Nó phá vỡ mạng lưới silica bền vững, làm giảm đáng kể nhiệt độ nóng chảy cần thiết để sản xuất thủy tinh, qua đó tiết kiệm năng lượng và chi phí.
Na₂O phản ứng với các oxit axit như Silic Dioxit (SiO₂, thành phần chính của cát) và Carbon Dioxit (CO₂) để tạo thành muối silicat và cacbonat.
Na₂O + SiO₂ → Na₂SiO₃ (Natri Silicat)
Na₂O + CO₂ → Na₂CO₃ (Natri Cacbonat)
Ý nghĩa thực tiễn: Phản ứng với SiO₂ là cốt lõi của ngành sản xuất thủy tinh. Na₂O hoạt động như một “chất trợ dung” (flux), phá vỡ cấu trúc mạng lưới Si-O-Si bền vững, làm giảm đáng kể nhiệt độ nóng chảy của silica (từ trên 1700°C xuống khoảng 800-900°C). Điều này giúp tiết kiệm một lượng lớn năng lượng và chi phí sản xuất.
4. Các ứng dụng công nghiệp chiến lược của Natri Oxit là gì?
Các ứng dụng chiến lược của Na₂O tập trung vào các ngành công nghiệp mũi nhọn: sản xuất thủy tinh và thủy tinh lỏng (vai trò trợ dung), chế tạo gốm sứ và men gốm (tăng độ bóng, giảm nhiệt độ nung), và là tiền chất trong ngành hóa chất và chất tẩy rửa.
Từ những tính chất hóa học kể trên, Hóa Chất Doanh Tín cung cấp Na₂O (thường ở dạng hợp chất nguồn như soda ash) cho các ngành công nghiệp mũi nhọn, nơi nó đóng vai trò không thể thay thế.
4.1. Vai trò của Na₂O trong Ngành Sản xuất Thủy tinh và Thủy tinh lỏng?
Trong ngành thủy tinh, Na₂O là thành phần không thể thiếu, chiếm khoảng 15% khối lượng. Nó giúp giảm nhiệt độ nóng chảy của silica, giảm độ nhớt của thủy tinh lỏng để dễ gia công, và cải thiện độ trong suốt của sản phẩm cuối cùng.
Đây là lĩnh vực tiêu thụ Na₂O lớn nhất. Na₂O chiếm khoảng 15% khối lượng trong các loại thủy tinh thông thường, một thành phần thiết yếu để tạo ra các sản phẩm từ chai lọ đến vật liệu phức tạp như sợi thủy tinh.
- Giảm nhiệt độ nóng chảy: Như đã phân tích, đây là lợi ích kinh tế lớn nhất, giúp giảm chi phí năng lượng.
- Giảm độ nhớt: Na₂O giúp hỗn hợp thủy tinh nóng chảy trở nên lỏng hơn, dễ dàng cho việc tạo hình, thổi và gia công.
- Cải thiện tính chất quang học: Góp phần tạo ra thủy tinh trong suốt và sáng bóng.
 Sản phẩm thủy tinh bao bì và xây dựng chất lượng cao, có độ trong suốt vượt trội nhờ tối ưu hóa thành phần Na₂O.
Sản phẩm thủy tinh bao bì và xây dựng chất lượng cao, có độ trong suốt vượt trội nhờ tối ưu hóa thành phần Na₂O.
4.2. Na₂O được ứng dụng trong Ngành Sản xuất Gốm sứ và Men gốm như thế nào?
Trong ngành gốm sứ, Na₂O là chất trợ dung mạnh trong men gốm, giúp hạ nhiệt độ nung, tạo lớp men chảy đều, tăng độ bóng và độ cứng cho bề mặt sản phẩm, đồng thời ảnh hưởng đến sự phát triển màu sắc của men.
Trong ngành gốm sứ, Na₂O là một thành phần quan trọng trong công thức men (glaze).
- Chất trợ dung mạnh: Tương tự như trong thủy tinh, Na₂O giúp hạ nhiệt độ nung của men, cho phép men chảy và phủ đều lên bề mặt sản phẩm ở nhiệt độ thấp hơn.
- Tăng độ bóng và độ cứng: Na₂O góp phần tạo ra một lớp men thủy tinh hóa hoàn hảo, có độ bóng cao, bề mặt cứng và khả năng chống trầy xước tốt.
- Phát triển màu sắc: Nó ảnh hưởng đến cách các oxit kim loại khác (tác nhân tạo màu) thể hiện màu sắc trong men, đặc biệt là các màu như xanh đồng và xanh coban.
4.3. Na₂O đóng vai trò gì trong Ngành Hóa chất và Chất tẩy rửa?
Na₂O là tiền chất để sản xuất các hợp chất Natri quan trọng khác như Natri Silicat (“thủy tinh lỏng”) và Natri Cacbonat (soda ash), vốn là những thành phần thiết yếu trong sản xuất chất tẩy rửa, giấy, dệt nhuộm và xử lý nước.
Na₂O là tiền chất để sản xuất các hợp chất Natri quan trọng khác:
- Natri Silicat (Na₂SiO₃): Còn gọi là “thủy tinh lỏng”, được sử dụng rộng rãi làm chất kết dính, chất độn trong sản xuất xà phòng và chất tẩy rửa, chất chống ăn mòn và trong xử lý nước.

- Natri Cacbonat (Na₂CO₃): Là một hóa chất công nghiệp thiết yếu, có sẵn tại Doanhtín dưới dạng sản phẩm Soda Ash Light (Na₂CO₃), được dùng trong sản xuất giấy, dệt nhuộm và làm mềm nước.
5. Case Study: Tối Ưu Hóa Sản Xuất Men Sứ tại Gốm sứ Minh Long?
Thông qua việc tư vấn và cung cấp nguồn Soda Ash (chứa Na₂O) có độ tinh khiết ổn định, Hóa Chất Doanh Tín đã giúp một doanh nghiệp gốm sứ giả định giải quyết vấn đề bề mặt men bị lỗi, giảm tỷ lệ phế phẩm từ 5% xuống dưới 1% và tiết kiệm chi phí năng lượng.
Thách thức: Công ty Gốm sứ Minh Long (ví dụ giả định) đang gặp vấn đề với lô men mới: bề mặt sản phẩm sau nung bị châm kim và độ bóng không đồng đều, tỷ lệ phế phẩm tăng 5%.
Giải pháp của Doanh Tín: Sau khi phân tích mẫu men, đội ngũ kỹ thuật của chúng tôi phát hiện nguồn cung cấp Soda Ash (nguồn Na₂O) của họ không ổn định về hàm lượng. Hóa Chất Doanh Tín đã tư vấn chuyển sang sử dụng Soda Ash Light với tiêu chuẩn kỹ thuật cam kết, đảm bảo hàm lượng Na₂O luôn ổn định ở mức 58% ± 0.2%.
Kết quả:
- Tỷ lệ phế phẩm giảm xuống dưới 1%.
- Bề mặt men căng bóng, đồng đều trên mọi sản phẩm.
- Nhiệt độ nung được điều chỉnh giảm 20°C, giúp tiết kiệm chi phí năng lượng.
6. Quy trình điều chế và thách thức về độ tinh khiết của Na₂O là gì?
Na₂O thường được điều chế bằng cách đốt Natri kim loại, nhưng quy trình này gặp thách thức lớn là dễ tạo ra sản phẩm phụ Natri Peroxit (Na₂O₂). Việc thu được Na₂O có độ tinh khiết cao đòi hỏi các phương pháp phức tạp và kiểm soát chặt chẽ hơn.
Việc điều chế Na₂O tinh khiết không hề đơn giản. Phương pháp phổ biến nhất là đốt natri kim loại, nhưng quá trình này dễ tạo ra sản phẩm phụ là Natri Peroxit (Na₂O₂).
Lưu ý cho doanh nghiệp: Tại Hóa Chất Doanh Tín, chúng tôi hiểu rằng độ tinh khiết của nguyên liệu đầu vào quyết định chất lượng sản phẩm cuối cùng. Chúng tôi cung cấp các sản phẩm chứa Na₂O với hàm lượng được kiểm soát chặt chẽ, đảm bảo không lẫn tạp chất peroxit có thể gây ảnh hưởng tiêu cực đến quy trình sản xuất của bạn.
Tải ngay Bảng Dữ liệu Kỹ thuật (TDS) & An toàn Hóa chất (MSDS) cho Soda Ash (Nguồn cung cấp Na₂O).
7. Hướng dẫn an toàn và bảo quản Natri Oxit theo Tiêu chuẩn TCVN như thế nào?
Việc tuân thủ an toàn đòi hỏi phải nhận thức rõ các rủi ro (ăn mòn, phản ứng mạnh với nước), sử dụng đầy đủ trang bị bảo hộ cá nhân (PPE), và bảo quản Na₂O trong thùng kín, nơi khô ráo, tách biệt khỏi độ ẩm và axit theo các quy định hiện hành.
Do tính phản ứng cao, việc tuân thủ các quy định an toàn khi làm việc với Na₂O là bắt buộc. Doanh nghiệp cần nắm rõ các quy định ghi nhãn hóa chất theo GHS và cập nhật những điểm mới của Luật Hóa Chất để đảm bảo an toàn tối đa.
7.1. Các rủi ro chính khi làm việc với Na₂O là gì?
Các rủi ro chính bao gồm khả năng ăn mòn mạnh gây bỏng da và mắt, phản ứng tỏa nhiệt dữ dội với nước có thể gây bắn tóe, và nguy cơ kích ứng hệ hô hấp nghiêm trọng khi hít phải bụi Na₂O.
- Ăn mòn: Gây bỏng nặng khi tiếp xúc với da, mắt và đường hô hấp do phản ứng với hơi ẩm tạo thành NaOH.
- Phản ứng với nước: Phản ứng tỏa nhiệt mạnh có thể gây bắn tóe dung dịch kiềm nóng, nguy hiểm.
- Hít phải bụi: Bụi Na₂O gây kích ứng nghiêm trọng hệ hô hấp.
7.2. Các biện pháp an toàn và bảo quản Na₂O cần tuân thủ là gì?
Các biện pháp bao gồm việc bắt buộc sử dụng trang bị bảo hộ cá nhân (PPE), lưu trữ hóa chất trong thùng kín ở nơi khô ráo, và có quy trình xử lý sự cố tràn đổ hoặc tiếp xúc rõ ràng, hiệu quả.
- Trang bị Bảo hộ Cá nhân (PPE): Luôn sử dụng găng tay chống hóa chất, kính bảo hộ, mặt nạ phòng độc và quần áo bảo hộ.
- Bảo quản: Lưu trữ Na₂O trong thùng chứa kín, làm bằng vật liệu chống ăn mòn, đặt ở nơi khô ráo, thoáng mát, tách biệt hoàn toàn khỏi khu vực có nước, độ ẩm và các loại axit.
- Xử lý sự cố:
- Tràn đổ: Thu gom cẩn thận bằng dụng cụ khô, không dùng nước để dọn rửa.
- Tiếp xúc da/mắt: Ngay lập tức rửa sạch vùng bị ảnh hưởng dưới vòi nước chảy liên tục trong ít nhất 15-20 phút và tìm kiếm sự chăm sóc y tế.
8. Các câu hỏi thường gặp (FAQ) về Natri Oxit?
Phần này giải đáp các thắc mắc phổ biến về việc so sánh Na₂O với K₂O, cách tính toán liều lượng, khả năng cung cấp Na₂O tinh khiết của Doanh Tín và các tác động môi trường của hóa chất này.
1. Na₂O và K₂O, oxit nào tốt hơn cho sản xuất men gốm?
Cả hai đều là chất trợ dung mạnh. Na₂O thường tạo ra men có độ giãn nở nhiệt cao hơn. Kali (K) Oxit (K₂O) tạo ra men có khoảng nóng chảy rộng hơn, dễ kiểm soát hơn. Sự lựa chọn phụ thuộc vào công thức men và nhiệt độ nung mong muốn.
2. Làm thế nào để tính toán lượng Na₂O cần thiết từ Soda Ash (Na₂CO₃)?
Dựa trên khối lượng phân tử, bạn có thể sử dụng công thức quy đổi. Đội ngũ kỹ thuật của Doanh Tín có thể hỗ trợ bạn tính toán chính xác để đảm bảo đúng tỷ lệ trong phối liệu.
3. Hóa Chất Doanh Tín có cung cấp Na₂O tinh khiết không?
Na₂O tinh khiết rất khó sản xuất và bảo quản nên không phổ biến trong thương mại. Thay vào đó, chúng tôi cung cấp các hợp chất nguồn Na₂O ổn định và có độ tinh khiết cao như Natri Cacbonat (Soda Ash) và Natri Hydroxide (Xút), đáp ứng tiêu chuẩn công nghiệp.
4. Tác động môi trường của Na₂O là gì?
Rủi ro chính là việc rò rỉ và phản ứng với nước tạo ra dung dịch kiềm mạnh, có thể làm ô nhiễm nguồn nước. Vì vậy, việc quản lý lưu trữ và xử lý chất thải chứa Na₂O theo quy định của Thông tư 36/2015/TT-BTNMT về quản lý chất thải nguy hại là cực kỳ quan trọng.
Kết luận
Natri Oxit (Na₂O) không chỉ là một hợp chất hóa học cơ bản mà còn là một công cụ mạnh mẽ để cải tiến và tối ưu hóa trong nhiều ngành công nghiệp. Từ việc giảm chi phí năng lượng trong sản xuất thủy tinh đến việc tạo ra lớp men gốm hoàn hảo, vai trò của nó là không thể phủ nhận.
Tuy nhiên, để khai thác tối đa tiềm năng của Na₂O, doanh nghiệp cần một đối tác am hiểu sâu sắc về kỹ thuật và cam kết về chất lượng. Hóa Chất Doanh Tín tự hào là nhà cung cấp các sản phẩm hóa chất công nghiệp uy tín, sẵn sàng đồng hành cùng quý khách hàng với các giải pháp được tùy chỉnh, nguồn hàng ổn định và hỗ trợ kỹ thuật chuyên nghiệp.
Về tác giả:
Bài viết được biên soạn và kiểm duyệt chuyên môn bởi Nguyễn Thị Mỹ Linh, Trưởng phòng Kỹ thuật với 15 năm kinh nghiệm trong lĩnh vực hóa chất công nghiệp tại Hóa Chất Doanh Tín. Bà Linh chuyên tư vấn các giải pháp tối ưu hóa công thức và quy trình sản xuất cho các ngành gốm sứ, thủy tinh và chất tẩy rửa.
Disclaimer:
Các thông tin trong bài viết này chỉ mang tính chất tham khảo và tư vấn kỹ thuật. Quý khách hàng cần tuân thủ nghiêm ngặt các hướng dẫn an toàn trên MSDS của sản phẩm và các quy định pháp luật hiện hành. Vui lòng liên hệ trực tiếp với Hóa Chất Doanh Tín để nhận được tư vấn phù hợp nhất với điều kiện sản xuất cụ thể của bạn.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










