Kiến thức chuyên môn
Năng Lượng Ion Hóa: Toàn Tập Về Nguồn Gốc và Ứng Dụng
Trong thế giới hóa học, việc hiểu rõ các tính chất cơ bản của nguyên tử là chìa khóa để dự đoán phản ứng và tạo ra vật liệu mới. Một trong những khái niệm nền tảng đó chính là năng lượng ion hóa. Vậy năng lượng ion hóa là gì và tại sao nó lại quan trọng đến vậy? Hãy cùng khám phá chi tiết.
Năng Lượng Ion Hóa là gì?
Năng lượng ion hóa (IE) là năng lượng tối thiểu cần thiết để tách một electron ra khỏi một nguyên tử hoặc cation ở trạng thái khí. Nó đo lường mức độ bền của electron liên kết với hạt nhân.
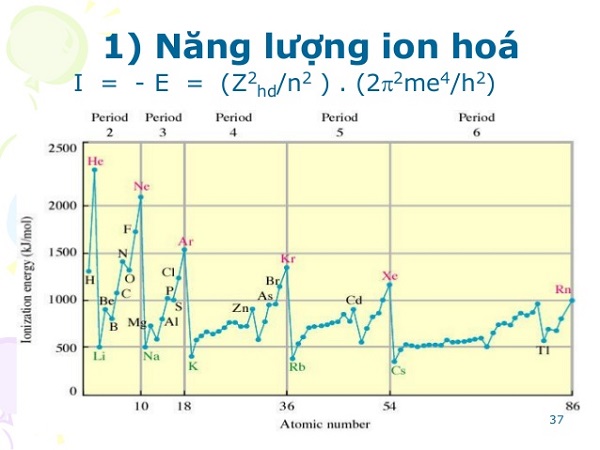
Năng lượng ion hóa (Ionization Energy – IE), ký hiệu là I, là năng lượng tối thiểu cần thiết để tách một electron ra khỏi một nguyên tử hoặc ion ở trạng thái khí, biến nó thành một ion dương. Về cơ bản, nó cho biết một nguyên tử “giữ” các electron của nó chặt đến mức nào. Năng lượng ion hóa càng cao, việc loại bỏ electron càng khó khăn. Đơn vị đo phổ biến nhất là kilojoule trên mol (kJ/mol) hoặc electronvolt (eV), trong đó 1 eV = 96.485 kJ/mol.
Các Mức Năng Lượng Ion Hóa
Năng lượng ion hóa được phân thành nhiều mức (thứ nhất, thứ hai,…). Năng lượng ion hóa thứ nhất (I₁) dùng để tách electron đầu tiên. Các mức năng lượng sau (I₂, I₃,…) luôn lớn hơn mức trước đó (I₁ < I₂ < I₃) vì electron bị hút mạnh hơn bởi ion dương.
- Năng lượng ion hóa thứ nhất (I₁): Là năng lượng cần để loại bỏ electron đầu tiên từ một nguyên tử trung hòa.
- Ví dụ: Quá trình ion hóa Natri (Na) thành ion Na⁺ có I₁ = 495.8 kJ/mol.
- Na(k) ⟶ Na⁺(k) + e⁻
- Năng lượng ion hóa thứ hai (I₂), thứ ba (I₃)…: Là năng lượng cần để loại bỏ các electron tiếp theo từ ion dương đã được tạo ra.
- Ví dụ: Để tách electron thứ hai từ Na⁺ (Na⁺(k) ⟶ Na²⁺(k) + e⁻), năng lượng cần thiết (I₂) là 4562 kJ/mol, cao hơn gần 10 lần so với I₁. Sự gia tăng đột ngột này là do electron thứ hai bị loại bỏ khỏi lớp vỏ bên trong, vốn ổn định và gần hạt nhân hơn. Điều này liên quan trực tiếp đến khái niệm số oxi hóa.
Các Yếu Tố Chính Ảnh Hưởng Đến Năng Lượng Ion Hóa
Bốn yếu tố chính ảnh hưởng đến năng lượng ion hóa là: 1. Bán kính nguyên tử (càng lớn, năng lượng càng thấp), 2. Điện tích hạt nhân (càng lớn, năng lượng càng cao), 3. Hiệu ứng chắn (càng mạnh, năng lượng càng thấp), và 4. Cấu hình electron (cấu hình bền vững như khí hiếm có năng lượng rất cao).
Độ lớn của năng lượng ion hóa không phải là ngẫu nhiên. Nó phụ thuộc vào các yếu tố cấu trúc của nguyên tử:
- Bán kính nguyên tử: Electron càng ở xa hạt nhân thì lực hút càng yếu, dễ bị tách ra hơn, dẫn đến năng lượng ion hóa thấp. Ví dụ, bán kính của Caesium (Cs) là 265 pm, lớn hơn nhiều so với Liti (Li) là 152 pm, do đó I₁ của Cs (375.7 kJ/mol) thấp hơn I₁ của Li (520.2 kJ/mol).
- Điện tích hạt nhân: Hạt nhân có càng nhiều proton, điện tích càng lớn, lực hút tĩnh điện lên các electron càng mạnh, làm tăng năng lượng ion hóa.
- Hiệu ứng chắn của electron: Các electron ở lớp trong sẽ che chắn, làm giảm lực hút của hạt nhân lên các electron ở lớp ngoài cùng. Hiệu ứng chắn càng lớn, năng lượng ion hóa càng giảm. Đây là lý do chính tại sao năng lượng ion hóa giảm dần khi đi xuống trong một nhóm.
- Cấu hình electron: Các nguyên tử có lớp vỏ electron ngoài cùng bão hòa (như khí hiếm) hoặc bán bão hòa (p³, d⁵) có cấu hình rất bền vững. Do đó, năng lượng cần để phá vỡ sự ổn định này là rất cao. Ví dụ, Neon (khí hiếm) có I₁ rất cao là 2080.7 kJ/mol.
Quy Luật Biến Đổi Trong Bảng Tuần Hoàn Hóa Học
Trong bảng tuần hoàn, năng lượng ion hóa có xu hướng tăng dần từ trái sang phải trong một chu kỳ và giảm dần từ trên xuống dưới trong một nhóm.
Hiểu rõ các yếu tố trên giúp chúng ta dễ dàng dự đoán xu hướng biến đổi của năng lượng ion hóa trong bảng tuần hoàn hóa học.
- Trong một chu kỳ (từ trái sang phải): Năng lượng ion hóa có xu hướng tăng dần. Nguyên nhân là do điện tích hạt nhân tăng nhưng số lớp electron không đổi, làm bán kính nguyên tử giảm và lực hút mạnh hơn.
- Trong một nhóm (từ trên xuống dưới): Năng lượng ion hóa có xu hướng giảm dần. Mặc dù điện tích hạt nhân tăng, nhưng số lớp electron cũng tăng lên, làm tăng bán kính nguyên tử và hiệu ứng chắn. Kết quả là electron ngoài cùng dễ bị tách hơn.
Ví dụ so sánh (dữ liệu I₁ năm 2025):
- Liti (Li) (520.2 kJ/mol) có I₁ thấp hơn Flo (F) (1681 kJ/mol) vì chúng cùng chu kỳ 2 và Flo ở bên phải.
- Caesium (Cs) (375.7 kJ/mol) có I₁ thấp nhất trong các kim loại kiềm ổn định vì nó nằm ở cuối nhóm IA, có bán kính nguyên tử lớn nhất.
Ứng Dụng Thực Tế Của Năng Lượng Ion Hóa
Năng lượng ion hóa giúp dự đoán bản chất của liên kết hóa học (ion hay cộng hóa trị), là nguyên tắc cốt lõi của các kỹ thuật phân tích phổ như AAS và phổ khối (MS), và có vai trò quan trọng trong công nghệ plasma và laser.
Khái niệm này không chỉ dừng lại ở lý thuyết mà còn có nhiều ứng dụng quan trọng:
- Dự đoán liên kết hóa học: Sự chênh lệch năng lượng ion hóa giữa hai nguyên tử giúp dự đoán chúng sẽ tạo thành liên kết ion (chênh lệch lớn) hay liên kết cộng hóa trị (chênh lệch nhỏ).
- Phân tích hóa học: Kỹ thuật Phổ hấp thụ nguyên tử (AAS) và Phổ khối (MS) đều dựa trên nguyên lý ion hóa các mẫu để xác định thành phần và nồng độ các nguyên tố, thậm chí ở mức vết.
- Công nghệ Plasma: Hiểu biết về năng lượng ion hóa là cần thiết để tạo và kiểm soát plasma, ứng dụng trong sản xuất vi mạch, xử lý bề mặt vật liệu, khử trùng và công nghệ chiếu sáng tiên tiến.
Câu Hỏi Thường Gặp (FAQ)
1. Nguyên tố nào có năng lượng ion hóa thấp nhất?
Tính đến năm 2025, Franci (Fr) là nguyên tố có năng lượng ion hóa thứ nhất thấp nhất theo lý thuyết (ước tính khoảng 380 kJ/mol). Tuy nhiên, do nó cực kỳ phóng xạ và không ổn định, trong thực tế, Caesium (Cs) (375.7 kJ/mol) được coi là nguyên tố ổn định có năng lượng ion hóa thấp nhất.
2. Nguyên tố nào có năng lượng ion hóa cao nhất?
Heli (He) là nguyên tố có năng lượng ion hóa thứ nhất cao nhất, ở mức 2372.3 kJ/mol. Với lớp vỏ electron đầu tiên đã bão hòa (1s²) và bán kính nguyên tử cực nhỏ, việc tách electron ra khỏi Heli đòi hỏi một năng lượng cực lớn.
3. Tại sao I₂ luôn lớn hơn I₁?
Sau khi nguyên tử mất đi một electron để trở thành ion dương, số proton trong hạt nhân không đổi nhưng số electron giảm đi. Điều này làm cho lực hút của hạt nhân lên các electron còn lại trở nên mạnh hơn đáng kể, đồng thời bán kính ion cũng thu nhỏ lại. Vì vậy, việc tách electron thứ hai luôn khó khăn hơn và đòi hỏi năng lượng cao hơn nhiều.
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn toàn diện và dễ hiểu về năng lượng ion hóa. Đây là một khái niệm cơ bản nhưng vô cùng thiết yếu để chinh phục môn hóa học và ứng dụng vào thực tiễn.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










