Kiến thức chuyên môn
Lưu huỳnh đioxit ? Ứng dụng, tác hại và cách xử lý
SO2 Là Gì? Tính Chất, Độc Tính & Cách Xử Lý Khí Thải Lưu Huỳnh Dioxit (Cập Nhật 2026)

Trong suốt 20 năm làm nghề tư vấn và cung ứng hóa chất công nghiệp, tôi đã chứng kiến Lưu huỳnh đioxit (SO2) đóng hai vai trò hoàn toàn trái ngược nhau. Một mặt, nó là “kẻ thù” số một của môi trường, tác nhân chính gây ra những cơn mưa axit tàn phá hệ sinh thái và là nỗi ám ảnh của cư dân sống gần các khu công nghiệp nhiệt điện. Mặt khác, nó lại là “người hùng thầm lặng” không thể thay thế trong quy trình sản xuất axit sunfuric, tẩy trắng giấy hay giữ cho trái cây sấy khô không bị nấm mốc tấn công.
Vậy thực chất SO2 là gì? Tại sao một chất khí không màu lại có sức tàn phá khủng khiếp đến hệ hô hấp nhưng lại được dùng trong thực phẩm? Bài viết chuyên sâu này sẽ giải mã toàn bộ hồ sơ về SO2, từ cấu trúc phân tử, tính chất lý hóa cho đến các giải pháp xử lý khí thải đạt chuẩn môi trường 2026.
Tổng quan định nghĩa SO2 là gì?
Khái niệm hóa học
SO2 là công thức hóa học của một hợp chất vô cơ có tên gọi chính thức là Lưu huỳnh đioxit (tiếng Anh: Sulfur dioxide). Ngoài ra, trong sách giáo khoa và tài liệu kỹ thuật cũ, bạn có thể bắt gặp các tên gọi khác như Khí sunfurơ, Anhidrit sunfurơ hay Lưu huỳnh oxit.
Về mặt phân loại, SO2 là một oxit axit điển hình. Đây là sản phẩm khí chính được sinh ra khi chúng ta đốt cháy lưu huỳnh hoặc các vật liệu chứa lưu huỳnh.
Cấu tạo phân tử

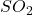 với liên kết cộng hóa trị phân cực điển hình.
với liên kết cộng hóa trị phân cực điển hình.Công thức phân tử ![]() cho thấy hợp chất này được cấu tạo từ:
cho thấy hợp chất này được cấu tạo từ:
- 1 nguyên tử Lưu huỳnh (S)
- 2 nguyên tử Oxy (O)
Liên kết giữa S và O là liên kết cộng hóa trị có cực. Cấu trúc này quyết định phần lớn tính chất phản ứng mạnh mẽ của nó mà chúng ta sẽ phân tích kỹ ở phần sau.
Nguồn gốc hình thành: SO2 đến từ đâu?
Khí SO2 không tự nhiên xuất hiện ở nồng độ cao trong không khí sạch, nó đến từ hai nguồn chính:

 nhân tạo lớn nhất.
nhân tạo lớn nhất.- Nguồn gốc tự nhiên (Chiếm tỷ lệ nhỏ nhưng cục bộ): Các vụ phun trào núi lửa là “nhà máy” sản xuất SO2 khổng lồ của tự nhiên. Khi núi lửa hoạt động, nó có thể giải phóng hàng triệu tấn SO2 vào khí quyển, gây ảnh hưởng khí hậu toàn cầu.
- Nguồn gốc nhân tạo (Nguyên nhân chính gây ô nhiễm): Đây là vấn đề chúng ta cần quan tâm nhất.
- Đốt nhiên liệu hóa thạch: Các nhà máy nhiệt điện đốt than, lò hơi công nghiệp đốt dầu mazut (FO), dầu diesel là nguồn phát thải SO2 lớn nhất. Than đá và dầu mỏ luôn chứa một lượng tạp chất lưu huỳnh, khi đốt cháy, lưu huỳnh oxy hóa tạo thành SO2.
- Luyện kim: Quá trình nung chảy các quặng sunfua (như Pyrit sắt
 , quặng đồng, kẽm, chì) để lấy kim loại giải phóng một lượng khổng lồ khí sunfurơ.
, quặng đồng, kẽm, chì) để lấy kim loại giải phóng một lượng khổng lồ khí sunfurơ. - Giao thông vận tải: Khí thải từ xe cộ sử dụng xăng dầu kém chất lượng cũng đóng góp vào nồng độ SO2 trong đô thị.
Đặc điểm và Tính chất Lý – Hóa của SO2 (Specs)
Là một kỹ sư hóa chất, tôi khuyên bạn cần nắm vững các thông số kỹ thuật này. Việc hiểu rõ tính chất vật lý không chỉ giúp nhận biết khí độc mà còn là cơ sở để thiết kế hệ thống xử lý khí thải hiệu quả.Tính chất vật lý đặc trưng
- Trạng thái và Màu sắc: Ở điều kiện thường, SO2 là chất khí không màu. Điều này khiến việc phát hiện bằng mắt thường là không thể, làm tăng tính nguy hiểm của nó.
- Mùi vị: Đây là đặc điểm nhận dạng quan trọng nhất. SO2 có mùi hắc đặc trưng (mùi diêm sinh cháy), gây cảm giác ngạt thở, khó chịu và kích ứng mạnh đường hô hấp ngay lập tức khi hít phải.
- Tỷ trọng: Khí SO2 nặng hơn không khí rất nhiều (
 ).Lưu ý an toàn: Vì nặng hơn không khí, khi rò rỉ, khí SO2 sẽ không bay lên cao mà tích tụ ở tầng thấp, các hố sâu hoặc sàn nhà xưởng. Do đó, khi gặp sự cố, tuyệt đối không được nằm xuống sàn mà phải di chuyển ở tư thế đứng hoặc lên cao.
).Lưu ý an toàn: Vì nặng hơn không khí, khi rò rỉ, khí SO2 sẽ không bay lên cao mà tích tụ ở tầng thấp, các hố sâu hoặc sàn nhà xưởng. Do đó, khi gặp sự cố, tuyệt đối không được nằm xuống sàn mà phải di chuyển ở tư thế đứng hoặc lên cao. - Độ tan: SO2 tan rất nhiều trong nước. Ở
 , 100ml nước có thể hòa tan được khoảng 9,4g khí SO2. Tính chất độ tan này giải thích tại sao SO2 là nguyên nhân chính gây ra mưa axit và cũng là cơ sở cho phương pháp xử lý khí thải bằng tháp rửa nước (Scrubber).
, 100ml nước có thể hòa tan được khoảng 9,4g khí SO2. Tính chất độ tan này giải thích tại sao SO2 là nguyên nhân chính gây ra mưa axit và cũng là cơ sở cho phương pháp xử lý khí thải bằng tháp rửa nước (Scrubber). - Nhiệt độ: Hóa lỏng ở
 và hóa rắn ở
và hóa rắn ở  .
.
Tính chất hóa học (Oxit axit)
SO2 là một oxit axit, do đó nó mang đầy đủ tính chất hóa học của nhóm này.
1. Tác dụng với nước:
Khi tan trong nước, SO2 phản ứng tạo thành dung dịch axit yếu là Axit sunfurơ (![]() ). Tuy nhiên, axit này không bền và dễ bị phân hủy ngược lại.
). Tuy nhiên, axit này không bền và dễ bị phân hủy ngược lại.
![]()
Hiện tượng thực tế: Dung dịch này làm quỳ tím chuyển sang màu đỏ nhạt. Đây chính là cơ chế hình thành mưa axit khi SO2 trong khí quyển gặp hơi nước.
2. Tác dụng với dung dịch Bazơ (Kiềm):
Đây là phản ứng quan trọng nhất trong công nghiệp xử lý khí thải. Tùy vào tỉ lệ mol giữa SO2 và Bazơ (như NaOH, Ca(OH)2), sản phẩm có thể là muối trung hòa hoặc muối axit.
- Tạo muối axit (Natri hiđrosunfit):
![Rendered by QuickLaTeX.com \[SO_2 + NaOH \rightarrow NaHSO_3\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20213%2014%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
- Tạo muối trung hòa (Natri sunfit):
![Rendered by QuickLaTeX.com \[SO_2 + 2NaOH \rightarrow Na_2SO_3 + H_2O\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20272%2014%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
Góc nhìn chuyên gia: Trong các tháp xử lý khí thải (Scrubber), chúng tôi thường duy trì lượng kiềm dư (
hoặc nước vôi trong) để đảm bảo toàn bộ khí độc
bị trung hòa hoàn toàn thành muối
hoặc
, ngăn không cho khí thoát ra môi trường.
3. Tính chất lưỡng tính về oxi hóa – khử:
Lưu huỳnh trong ![]() có số oxi hóa là +4. Đây là mức trung gian giữa -2 (trong
có số oxi hóa là +4. Đây là mức trung gian giữa -2 (trong ![]() ) và +6 (trong
) và +6 (trong ![]() ). Do đó,
). Do đó, ![]() vừa có thể là chất khử, vừa là chất oxi hóa.
vừa có thể là chất khử, vừa là chất oxi hóa.
- Tính khử (Thể hiện khi gặp chất oxi hóa mạnh):
 phản ứng với các chất oxi hóa mạnh như nước Brom (
phản ứng với các chất oxi hóa mạnh như nước Brom ( ) hoặc thuốc tím (KMnO4).
) hoặc thuốc tím (KMnO4).
![Rendered by QuickLaTeX.com \[SO_2 + Br_2 + 2H_2O \rightarrow 2HBr + H_2SO_4\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20304%2014%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
Ứng dụng: Phản ứng làm mất màu nước Brom này thường được dùng để nhận biết khí SO2 trong phòng thí nghiệm.
- Tính oxi hóa (Thể hiện khi gặp chất khử mạnh):
![Rendered by QuickLaTeX.com \[SO_2 + 2H_2S \rightarrow 3S \downarrow + 2H_2O\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20224%2016%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
Phản ứng này tạo ra kết tủa Lưu huỳnh màu vàng.
Phương pháp điều chế SO2 (Guide)
Làm thế nào để tạo ra SO2? Tùy thuộc vào quy mô (thí nghiệm hay nhà máy), chúng ta có các phương pháp khác nhau.
Trong phòng thí nghiệm
Để điều chế một lượng nhỏ khí SO2 phục vụ nghiên cứu, người ta thường cho muối sunfit tác dụng với axit mạnh (thường là ![]() đặc).
đặc).
Phương trình phản ứng:
![]()
Trong công nghiệp sản xuất
Trong công nghiệp, mục tiêu là sản xuất lượng lớn với chi phí thấp nhất. Có hai nguồn nguyên liệu chính:
- Đốt cháy Lưu huỳnh: Đây là cách sạch nhất và hiệu quả nhất.
![Rendered by QuickLaTeX.com \[S + O_2 \xrightarrow{t^o} SO_2\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20120%2022%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
- Đốt quặng Pyrit sắt (
 ): Đây là phương pháp phổ biến trong các nhà máy sản xuất axit sunfuric, tận dụng nguồn quặng sắt.
): Đây là phương pháp phổ biến trong các nhà máy sản xuất axit sunfuric, tận dụng nguồn quặng sắt.
![Rendered by QuickLaTeX.com \[4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20266%2022%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
4. Ứng dụng quan trọng của khí SO2 trong đời sống (Application)
Mặc dù được biết đến là một chất khí độc hại, nhưng dưới góc độ kinh tế và công nghiệp, SO2 là một “mắt xích” không thể thiếu. Nếu loại bỏ hoàn toàn SO2, nhiều ngành sản xuất sẽ tê liệt. Dưới đây là những ứng dụng thực tiễn mà có thể bạn đang tiếp xúc hàng ngày mà không hay biết:
Sản xuất hóa chất: “Mẹ đẻ” của Axit Sunfuric
Đây là ứng dụng lớn nhất, tiêu thụ phần lớn lượng SO2 được sản xuất ra trên toàn cầu. SO2 là nguyên liệu trung gian cốt lõi để sản xuất Axit Sunfuric (![]() ) – hóa chất được mệnh danh là “máu của ngành công nghiệp”.
) – hóa chất được mệnh danh là “máu của ngành công nghiệp”.
Quy trình: ![]() được oxi hóa thành
được oxi hóa thành ![]() , sau đó
, sau đó ![]() được hấp thụ trong nước để tạo thành axit sunfuric.
được hấp thụ trong nước để tạo thành axit sunfuric.
Công nghiệp Giấy và Bột giấy
Nếu bạn thắc mắc tại sao trang giấy bạn viết lại có màu trắng tinh khôi trong khi gỗ có màu nâu, thì câu trả lời nằm ở SO2.
Chất tẩy trắng: SO2 phản ứng với nước tạo thành dung dịch có tính tẩy màu mạnh. Nó giúp loại bỏ Lignin (chất làm gỗ có màu nâu) và tẩy trắng bột giấy mà không làm hỏng cấu trúc sợi cellulose quá nhiều như các chất oxi hóa mạnh khác.
Công nghiệp Thực phẩm: “Vệ sĩ” bảo quản

Có thể bạn sẽ bất ngờ, nhưng SO2 (hoặc các muối sunfit sinh ra nó) là một phụ gia thực phẩm hợp pháp (mã số E220).
- Hoa quả sấy khô: Các loại mứt, mơ sấy, nho khô… thường được xông hơi SO2 để giữ màu vàng tươi đẹp mắt, ngăn chặn quá trình thâm đen (oxi hóa) và chống nấm mốc, vi khuẩn xâm nhập. Nếu bạn thấy mơ sấy có màu nâu sẫm, đó là loại không dùng SO2 (hoặc rất ít), còn loại màu vàng cam rực rỡ chắc chắn có sự can thiệp của chất này.
- Sản xuất Rượu vang: Trong kỹ thuật làm rượu vang, SO2 được thêm vào với liều lượng cực nhỏ để kháng khuẩn (giết chết vi khuẩn làm chua rượu) và chống oxy hóa, giữ cho hương vị rượu được nguyên bản qua thời gian dài ủ.
Xử lý nước thải
Trong công nghiệp mạ điện hoặc xử lý nước thải, SO2 được dùng để:
- Khử lượng Clo dư thừa trong nước máy.
- Xử lý nước thải chứa Crom hóa trị 6 (
 ) độc hại thành Crom hóa trị 3 (
) độc hại thành Crom hóa trị 3 ( ) ít độc hơn để dễ dàng kết tủa và loại bỏ.
) ít độc hơn để dễ dàng kết tủa và loại bỏ.
5. Cảnh báo An toàn: Tác hại của SO2 đối với sức khỏe và môi trường (Safety)
Là một chuyên gia, tôi buộc phải nhấn mạnh phần này: Lợi ích kinh tế của SO2 không thể bù đắp được những rủi ro sức khỏe nếu không được kiểm soát chặt chẽ.
Ảnh hưởng nghiêm trọng đến sức khỏe con người

 vượt ngưỡng cho phép có thể gây viêm phổi mãn tính và các bệnh hô hấp nghiêm trọng.
vượt ngưỡng cho phép có thể gây viêm phổi mãn tính và các bệnh hô hấp nghiêm trọng.Khí SO2 là kẻ thù không đội trời chung của hệ hô hấp. Chỉ cần nồng độ rất thấp (vài ppm) cũng đủ gây ra các phản ứng cấp tính:
- Hệ hô hấp (Cơ quan đích):Khi hít phải, SO2 nhanh chóng hòa tan vào độ ẩm trong niêm mạc mũi và họng, tạo thành axit. Điều này gây ra cảm giác nóng rát dữ dội, ho sặc sụa, khó thở và co thắt phế quản. Với người bị hen suyễn hoặc viêm phế quản, SO2 là tác nhân kích thích cực mạnh, có thể dẫn đến các cơn hen cấp tính đe dọa tính mạng. Tiếp xúc lâu dài gây viêm phổi mãn tính, khí phế thũng và giảm chức năng phổi không hồi phục.
- Máu và Hệ tuần hoàn:SO2 có khả năng xâm nhập vào máu, gây ra các phản ứng hóa học làm giảm dự trữ kiềm trong máu. Nguy hiểm hơn, nó làm chuyển hóa Hemoglobin (vận chuyển oxy) thành Methemoglobin (không vận chuyển được oxy), gây ra tình trạng thiếu oxy mô, tắc nghẽn mạch máu và tăng gánh nặng cho tim.
- Mắt và Da:Tiếp xúc trực tiếp với khí SO2 nồng độ cao gây chảy nước mắt, đỏ mắt, viêm kết mạc. Nếu ở dạng lỏng, nó có thể gây bỏng lạnh hoặc hoại tử da.
Tác động tiêu cực đến môi trường (Hệ sinh thái)
SO2 chính là “thủ phạm” chính gây ra các vấn đề môi trường vĩ mô:
- Mưa Axit: Đây là hậu quả nổi tiếng nhất. Khí SO2 bay lên tầng khí quyển, phản ứng với hơi nước và oxy dưới tác dụng của ánh sáng mặt trời để tạo thành Axit Sunfuric (
 ). Khi mưa xuống, lượng axit này tàn phá rừng cây, làm chua đất nông nghiệp, ăn mòn các công trình xây dựng (đặc biệt là đá vôi, cẩm thạch) và làm rỉ sét kim loại.
). Khi mưa xuống, lượng axit này tàn phá rừng cây, làm chua đất nông nghiệp, ăn mòn các công trình xây dựng (đặc biệt là đá vôi, cẩm thạch) và làm rỉ sét kim loại. - Tàn phá thảm thực vật: Cây cối tiếp xúc với SO2 sẽ bị cháy lá, vàng lá (do diệp lục bị phá hủy), ngăn cản quá trình quang hợp và chậm phát triển.
- Ô nhiễm mù quang hóa: SO2 kết hợp với bụi mịn và độ ẩm tạo thành lớp mù dày đặc, làm giảm tầm nhìn và gây ô nhiễm không khí nghiêm trọng tại các đô thị lớn.
Các phương pháp xử lý khí thải SO2 hiệu quả nhất (Solution)

Trong bối cảnh các quy định về môi trường năm 2026 ngày càng thắt chặt, việc xử lý khí thải SO2 là bắt buộc đối với mọi nhà máy. Dưới đây là 3 công nghệ xử lý (Hấp thụ) phổ biến và hiệu quả nhất mà tôi thường tư vấn cho các đối tác:
Phương pháp 1: Hấp thụ bằng sữa vôi ( )
)
Đây là phương pháp “quốc dân” được 80% các nhà máy sử dụng.
Cơ chế: Khí thải chứa SO2 được dẫn qua tháp phun dung dịch vôi.
![]()
Ưu điểm: Chi phí nguyên liệu cực rẻ, nguồn vôi dồi dào, quy trình đơn giản.
Nhược điểm: Tạo ra lượng lớn cặn rắn (bùn thạch cao) cần xử lý tiếp, dễ gây đóng cặn làm tắc nghẽn vòi phun trong tháp xử lý.
Phương pháp 2: Hấp thụ bằng dung dịch Xút ( )
)
Đây là phương pháp dành cho các hệ thống yêu cầu hiệu suất cao và sự ổn định.
Cơ chế:
![]()
Ưu điểm: Hiệu suất xử lý cực cao (>98%), sản phẩm tạo thành là muối tan nên không lo tắc nghẽn hệ thống, có thể thu hồi muối Natri sunfit để bán.
Nhược điểm: Giá thành dung dịch Xút (NaOH) cao hơn nhiều so với vôi, tốn chi phí vận hành.
Phương pháp 3: Hấp thụ bằng dung dịch Soda ( )
)
Thường dùng cho các nhà máy quy mô nhỏ hoặc ngành công nghiệp đặc thù.
Ưu điểm: An toàn hơn xút ăn da, hiệu quả tốt.
Nhược điểm: Chi phí cao.
Lời khuyên chuyên gia: Để tối ưu chi phí và hiệu quả, nhiều hệ thống hiện đại sử dụng quy trình kép: Dùng tháp NaOH để xử lý tinh (đảm bảo đạt chuẩn xả thải) sau khi đã qua tháp vôi để xử lý thô.
Câu hỏi thường gặp về SO2 (FAQs)
Dưới đây là giải đáp nhanh các thắc mắc phổ biến của khách hàng:
1. Khí SO2 có màu gì, mùi gì?
SO2 là chất khí không màu, nhưng có mùi hắc rất đặc trưng (giống mùi khi đốt diêm sinh/pháo). Ở nồng độ cao, nó gây cảm giác ngạt thở tức thì.
2. SO2 có phải là nguyên nhân chính gây mưa axit không?
Đúng. SO2 cùng với NOx là hai tác nhân chính. SO2 chiếm tỷ trọng lớn hơn trong việc hình thành mưa axit do quá trình đốt than và dầu mỏ trên toàn cầu.
3. Tại sao thực phẩm sấy khô (như vải thiều, nhãn, mơ) lại có mùi hắc?
Đó có thể là dư lượng của khí SO2 dùng để bảo quản và giữ màu. Nếu mùi quá nồng, chứng tỏ sản phẩm đó đã bị lạm dụng hóa chất quá mức cho phép, bạn nên hạn chế sử dụng hoặc rửa/ngâm kỹ trước khi dùng.
4. Làm thế nào để phát hiện rò rỉ khí SO2 trong nhà máy?
Ngoài việc sử dụng các cảm biến đo khí chuyên dụng, cách nhận biết thủ công đơn giản nhất là dùng giấy quỳ tím ẩm treo tại các vị trí nghi ngờ. Nếu giấy quỳ chuyển sang màu đỏ, khu vực đó đang có khí SO2 (hoặc khí axit khác). Tuy nhiên, hãy luôn ưu tiên thiết bị đo an toàn.
5. Giới hạn tiếp xúc an toàn với SO2 là bao nhiêu?
Theo quy chuẩn Việt Nam và quốc tế, giới hạn tiếp xúc cho phép trong môi trường làm việc (TWA – 8 giờ) thường là 5 mg/m³ (khoảng 2 ppm). Vượt quá ngưỡng này cần phải có thiết bị bảo hộ hô hấp chuyên dụng.
Hiểu rõ về SO2 không chỉ giúp doanh nghiệp tuân thủ pháp luật môi trường mà còn là cách để mỗi cá nhân bảo vệ sức khỏe của chính mình. Đừng để sự thiếu hiểu biết biến “người hùng công nghiệp” thành “sát thủ thầm lặng”. Tìm hiểu thêm về tác hại của hóa chất để bảo vệ bản thân tốt hơn.
Cần tư vấn giải pháp xử lý khí thải SO2 hoặc mua hóa chất công nghiệp chuẩn chất lượng? Liên hệ ngay:
CÔNG TY CỔ PHẨN HOÁ CHẤT DOANH TÍN
📍 Địa chỉ VP: 16 Đ.Số 7, KDC Cityland, P.7, Q.Gò Vấp, TPHCM, Việt Nam.
☎️ Hotline: 0965 200 571
📧 Email: info@hoachatdoanhtin.com
🏢 Mã số thuế: 0318373620
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









