Kiến thức chuyên môn
Điện Phân Dung Dịch Là Gì? Nguyên Lý & Ứng Dụng 2025
Trong thế giới hóa học và kỹ thuật điện, có một quá trình được ví như “cây cầu” nối liền hai dạng năng lượng quan trọng nhất: Điện năng và Hóa năng. Đó chính là Điện phân dung dịch. Đối với các em học sinh, đây là chương kiến thức “khó nhằn” với hàng loạt quy tắc về thứ tự ion. Nhưng đối với nền công nghiệp hiện đại, điện phân là “trái tim” của các dây chuyền sản xuất tỷ đô, từ việc tạo ra hàng triệu tấn Xút (NaOH), khí Clo mỗi năm cho đến công nghệ mạ vàng tinh xảo trên các linh kiện điện tử.
Bài viết này không chỉ là lý thuyết sách giáo khoa. Hóa Chất Doanh Tín sẽ cùng bạn đi sâu vào bản chất của quá trình này, giải mã các quy luật ngầm tại điện cực và ứng dụng thực tế của nó trong đời sống.
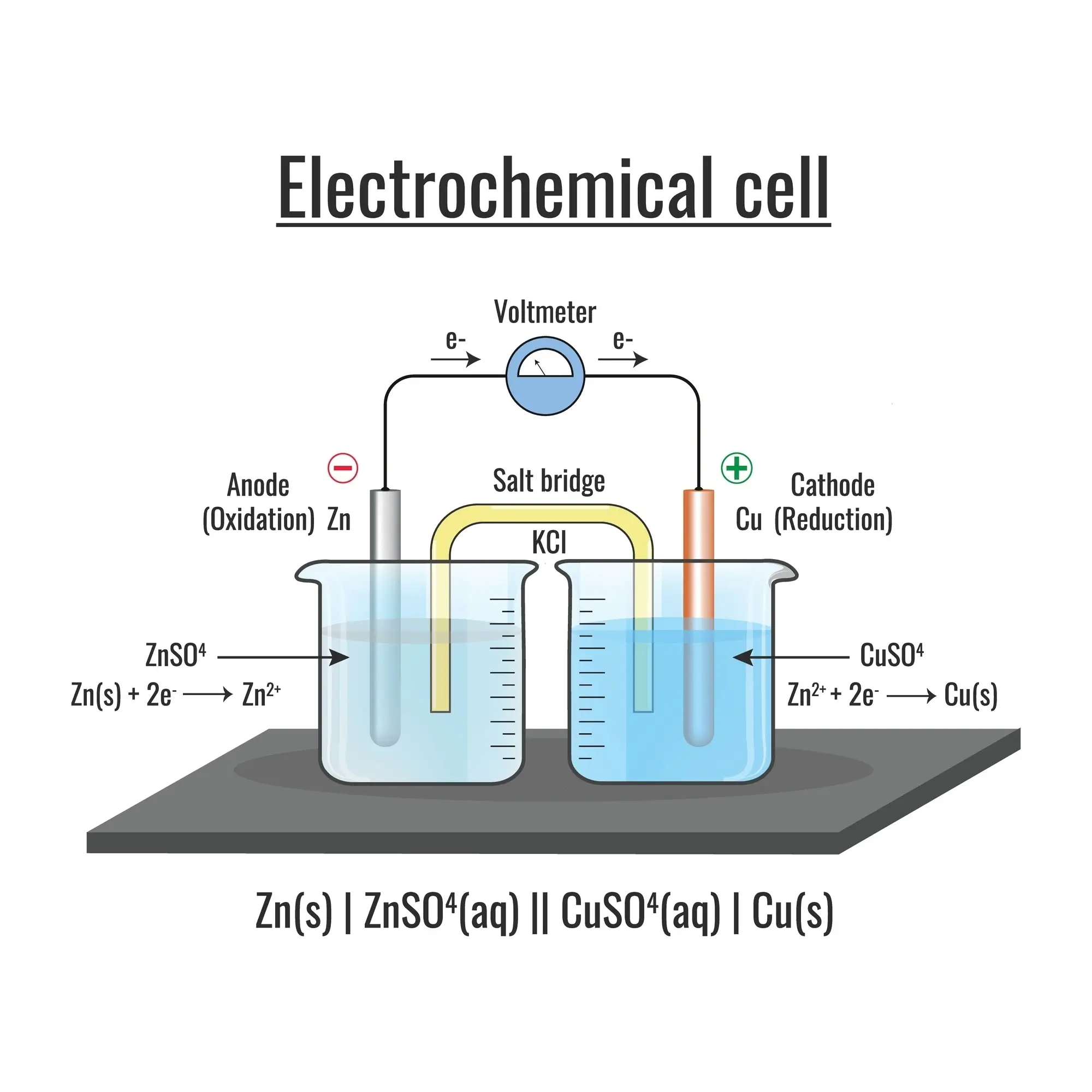
Sơ đồ nguyên lý hoạt động cơ bản của một bình điện phân dung dịch
Bản Chất Của Điện Phân Dung Dịch: Góc Nhìn Kỹ Thuật
Định Nghĩa Chính Xác
💡 Điện phân dung dịch là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều (DC) đi qua dung dịch chất điện li.
Khác với phản ứng hóa học thông thường xảy ra do sự va chạm giữa các phân tử, phản ứng điện phân là phản ứng “cưỡng bức”. Dòng điện đóng vai trò như một “bơm electron”, hút electron từ một cực và đẩy sang cực kia, buộc các ion trong dung dịch phải thay đổi trạng thái hóa trị.
Cấu Tạo Của Một Bể Điện Phân (Electrolytic Cell)
Để quá trình điện phân diễn ra, chúng ta cần một hệ thống gồm 4 thành phần chính. Là một kỹ sư điện, tôi luôn nhắc nhở việc xác định đúng cực tính là yếu tố sống còn:
- Nguồn điện một chiều (DC Source): Cung cấp năng lượng cho phản ứng.
- Anot (Anode): Được nối với cực dương (+) của nguồn điện. Tại đây, các Anion (ion âm) bị hút về và xảy ra quá trình Oxi hóa (nhường electron).Mẹo nhớ: Anot – Ăn mòn (thường bị tan ra nếu không trơ) – Anion.
- Catot (Cathode): Được nối với cực âm (-) của nguồn điện. Tại đây, các Cation (ion dương) bị hút về và xảy ra quá trình Khử (nhận electron).Mẹo nhớ: Catot – Cation – Cộng electron.
- Dung dịch điện li: Chứa các muối, axit hoặc bazơ tan trong nước.
⚠️ Lưu ý quan trọng: Rất nhiều người nhầm lẫn dấu của điện cực giữa Pin điện hóa (Galvanic cell) và Bình điện phân. Trong bình điện phân: Anot là Dương (+), Catot là Âm (-). Đừng nhầm lẫn!
Quy Tắc & Thứ Tự Điện Phân (Phần Quan Trọng Nhất)
Đây là phần kiến thức cốt lõi giúp bạn viết đúng phương trình hóa học và dự đoán sản phẩm. Trong một “cuộc đua” giữa các ion về phía điện cực, ai mạnh hơn sẽ được ưu tiên xử lý trước.
Tại Catot (Cực Âm -): Cuộc Đua Của Cation
Các ion dương (![]() ) di chuyển về Catot. Tại đây, chất nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
) di chuyển về Catot. Tại đây, chất nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Tại Anot (Cực Dương +): Cuộc Đua Của Anion
Các ion âm (![]() ) di chuyển về Anot. Tại đây, chất nào có tính khử mạnh hơn sẽ bị điện phân trước.
) di chuyển về Anot. Tại đây, chất nào có tính khử mạnh hơn sẽ bị điện phân trước.
- 1. Nhóm Anion không chứa Oxi (Trừ Fluor):
 .Quy tắc: DỄ bị điện phân.Phương trình:
.Quy tắc: DỄ bị điện phân.Phương trình:
![Rendered by QuickLaTeX.com \[2Cl^- \rightarrow Cl_2 \uparrow + 2e\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20144%2016%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
(Khí thoát ra).
- 2. Nhóm Anion có chứa Oxi và Fluor:
 .Quy tắc: KHÔNG bị điện phân.Hệ quả: Nước (
.Quy tắc: KHÔNG bị điện phân.Hệ quả: Nước ( ) điện phân thay thế:
) điện phân thay thế:
![Rendered by QuickLaTeX.com \[2H_2O \rightarrow 4H^+ + O_2 \uparrow + 4e\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20202%2020%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
Các Trường Hợp Điện Phân Điển Hình & Ứng Dụng Thực Tế
Để hiểu rõ hơn, chúng ta hãy phân tích các quy trình đang được áp dụng hàng ngày tại các nhà máy hóa chất lớn (như đối tác của Doanh Tín).
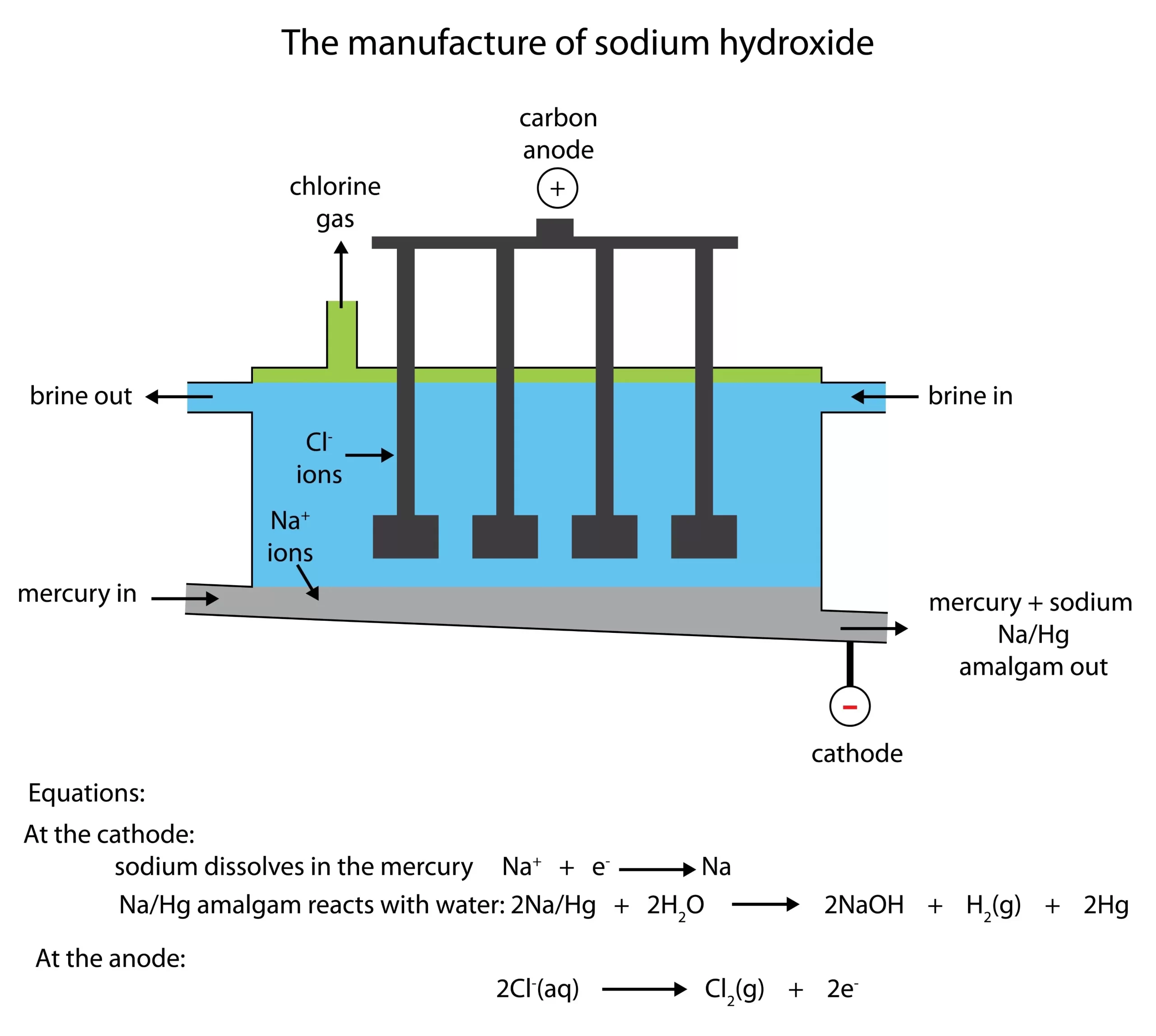
Điện Phân Dung Dịch NaCl (Sản Xuất Xút – Clo)
Đây là phản ứng quan trọng bậc nhất của ngành công nghiệp hóa chất vô cơ. Có hai kịch bản xảy ra:
- Trường hợp 1: Điện phân không màng ngănKhí Clo (
 ) sinh ra ở Anot sẽ phản ứng ngay với NaOH sinh ra ở Catot trong dung dịch.
) sinh ra ở Anot sẽ phản ứng ngay với NaOH sinh ra ở Catot trong dung dịch.
![Rendered by QuickLaTeX.com \[Cl_2 + 2NaOH \rightarrow NaCl + NaClO + H_2O\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20325%2014%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
👉 Ứng dụng: Đây chính là quy trình sản xuất Nước Javen (Chất tẩy rửa).
- Trường hợp 2: Điện phân CÓ MÀNG NGĂN xốp
Màng ngăn (hoặc màng trao đổi ion hiện đại) giữ không cho Clo tác dụng với NaOH.
Phương trình tổng quát:![Rendered by QuickLaTeX.com \[2NaCl + 2H_2O \xrightarrow{\text{đpdd, mnx}} 2NaOH + Cl_2 \uparrow + H_2 \uparrow\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20390%2024%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
👉 Ứng dụng: Đây là phương pháp duy nhất để sản xuất Xút Lỏng NaOH (Sodium Hydroxide) và khí Clo thương phẩm phục vụ cho ngành nhựa PVC, xử lý nước.
ShutterstockKhám phá
Điện Phân Dung Dịch CuSO4 (Tinh Chế Đồng)
Quá trình này dùng để điều chế kim loại Đồng từ dung dịch muối hoặc tinh luyện Đồng thô.
- Tại Catot (-):
 (Đồng đỏ bám vào).
(Đồng đỏ bám vào). - Tại Anot (+):
 (Nước điện phân).
(Nước điện phân). - Phương trình tổng:
![Rendered by QuickLaTeX.com \[2CuSO_4 + 2H_2O \xrightarrow{\text{đpdd}} 2Cu + 2H_2SO_4 + O_2 \uparrow\]](data:image/svg+xml,%3Csvg%20viewBox%3D%220%200%20360%2024%22%20xmlns%3D%22http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg%22%3E%3C%2Fsvg%3E)
- Hiện tượng: Màu xanh lam của dung dịch nhạt dần, độ axit (H2SO4) tăng lên.
Hiện Tượng Dương Cực Tan (Active Anode Dissolving)
Đây là trường hợp đặc biệt khi Anot không làm bằng vật liệu trơ (như than chì, Platin) mà làm bằng chính kim loại đang cần mạ/tinh chế. Ví dụ: Điện phân dung dịch ![]() với Anot bằng Đồng (
với Anot bằng Đồng (![]() ).
).
- Tại Anot (+): Thay vì nước điện phân, cực dương
 sẽ bị tan ra:
sẽ bị tan ra:  .
. - Tại Catot (-):
 .
. - Kết quả: Nồng độ
 trong dung dịch KHÔNG ĐỔI. Kim loại chuyển từ Anot sang bám vào Catot.
trong dung dịch KHÔNG ĐỔI. Kim loại chuyển từ Anot sang bám vào Catot.
👉 Ứng dụng: Dùng trong công nghệ Mạ điện (Electroplating) và tinh chế kim loại 99.99%.
Định Luật Faraday: Công Cụ Tính Toán Của Kỹ Sư
Trong công nghiệp, chúng tôi không thể “ước lượng” xem bao nhiêu kim loại đã bám vào cực. Mọi thứ phải được tính toán chính xác để kiểm soát chi phí điện năng. Định luật Faraday chính là công cụ đó.
Công thức tính khối lượng chất thoát ra ở điện cực:
![]()
 : Khối lượng chất thu được (gam).
: Khối lượng chất thu được (gam). : Khối lượng mol nguyên tử (VD: Cu=64, Ag=108, Cl=35.5).
: Khối lượng mol nguyên tử (VD: Cu=64, Ag=108, Cl=35.5). : Số electron trao đổi (Hóa trị).
: Số electron trao đổi (Hóa trị). : Cường độ dòng điện (Ampe).
: Cường độ dòng điện (Ampe). : Thời gian điện phân (Giây).
: Thời gian điện phân (Giây). : Hằng số Faraday
: Hằng số Faraday  (C/mol).
(C/mol).
💡 Mẹo nhớ cho học sinh: “Mời Anh I-ốt tơi nát Phố” (M = A.I.t / n.F).
Ứng Dụng Đa Dạng Trong Công Nghiệp Hiện Đại
Điện phân không chỉ nằm trên giấy, nó hiện diện trong mọi ngóc ngách của nền kinh tế. Là đơn vị cung cấp hóa chất, Doanh Tín chứng kiến sự ứng dụng của nó ở:
- Sản Xuất Hóa Chất Cơ Bản (Chlor-Alkali Industry): Hơn 95% lượng khí Clo và Xút trên thế giới được sản xuất bằng phương pháp điện phân dung dịch muối ăn (NaCl). Đây là nguyên liệu đầu vào cho hàng ngàn ngành công nghiệp khác.
- Công Nghệ Mạ Điện (Electroplating): Từ chiếc huy chương vàng, đồ trang sức cho đến các chi tiết máy chống gỉ sét đều nhờ vào quá trình điện phân dương cực tan.
- Luyện Kim & Tinh Chế (Electrometallurgy): Các kim loại như Đồng, Kẽm, Chì thường được tinh chế bằng điện phân dung dịch để đạt độ sạch lên tới 99.99%.
- Xử Lý Nước Thải (Electrochemical Water Treatment): Một ứng dụng mới nổi là dùng quá trình oxi hóa điện hóa để phá vỡ các hợp chất hữu cơ độc hại khó phân hủy trong nước thải dệt nhuộm hoặc y tế.
Kết Luận
Điện phân dung dịch là một quá trình đầy mê hoặc, nơi dòng điện thể hiện quyền năng thay đổi cấu trúc vật chất. Hiểu rõ về thứ tự điện phân và các quy tắc tại điện cực không chỉ giúp các em học sinh chinh phục điểm cao, mà còn giúp các kỹ sư vận hành hệ thống sản xuất một cách an toàn và hiệu quả.
CÔNG TY CỔ PHẨN HOÁ CHẤT DOANH TÍN
Nếu bạn đang là chủ doanh nghiệp hoặc kỹ thuật viên cần tìm nguồn cung cấp các hóa chất phục vụ cho quá trình điện phân như: Muối công nghiệp (NaCl), Đồng Sunfat (CuSO4), Xút (NaOH)… Hãy liên hệ ngay với chúng tôi.
📍 Địa chỉ: 16 Đường Số 7, KDC Cityland, Phường 7, Quận Gò Vấp, TP. Hồ Chí Minh
📞 Hotline Kỹ Thuật: 0965 200 571
📧 Email: info@hoachatdoanhtin.com
🌐 Website: hoachatdoanhtin.com
Chúng tôi luôn sẵn sàng hỗ trợ tư vấn kỹ thuật và cung cấp tài liệu chuyên sâu miễn phí!
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









