Kiến thức chuyên môn
Dãy Điện Hóa Là Gì? Bảng Đầy Đủ và Mẹo Ghi Nhớ Nhanh Nhất
Dãy điện hóa là gì? Đây là một công cụ nền tảng trong hóa học, sắp xếp các cặp oxi hóa – khử của kim loại theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim loại. Việc nắm vững dãy điện hóa không chỉ giúp dự đoán chính xác chiều của một phản ứng oxi hóa – khử mà còn là chìa khóa để so sánh tính chất kim loại và xác định sản phẩm trong các quá trình quan trọng như điện phân.
Bài viết này sẽ cung cấp bảng dãy điện hóa đầy đủ và cập nhật nhất, các mẹo ghi nhớ khoa học và những ứng dụng thực tế không thể bỏ qua.
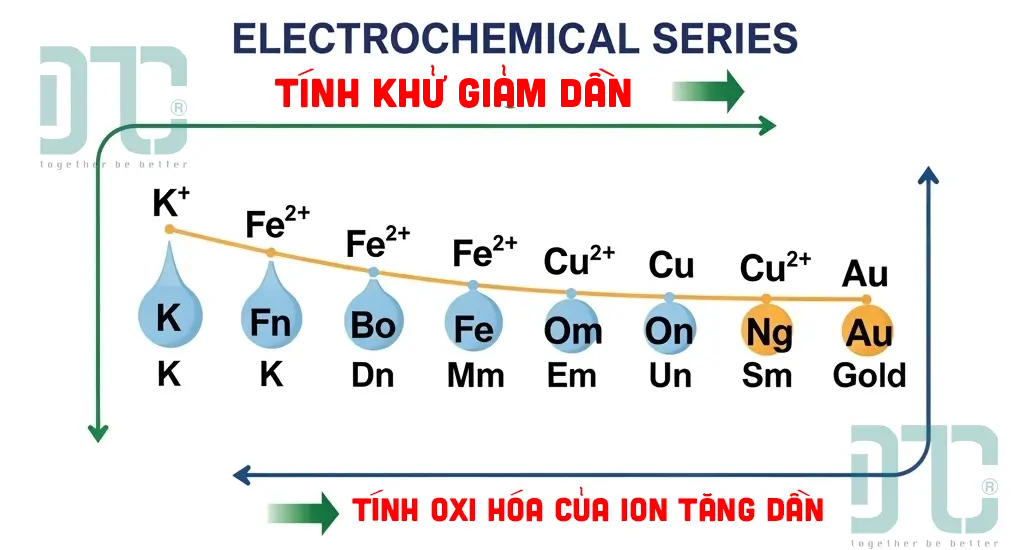
Sơ đồ Dãy điện hóa của kim loại đầy đủ và chi tiết
Bảng Dãy Điện Hóa Đầy Đủ và Chính Xác
Dãy điện hóa là bảng sắp xếp các cặp oxi hóa-khử theo thứ tự thế điện cực chuẩn (E°) tăng dần, thể hiện sự giảm dần tính khử của kim loại (từ Li đến Au) và sự tăng dần tính oxi hóa của ion kim loại tương ứng.
Bảng dưới đây được sắp xếp dựa trên giá trị thế điện cực chuẩn (E°) ở điều kiện tiêu chuẩn (25°C, nồng độ 1M, áp suất 1 atm), cập nhật mới nhất năm 2025.
| Kim loại (Dạng khử) | Ion (Dạng oxi hóa) | Thế điện cực chuẩn E° (V) |
|---|---|---|
| Li | Li⁺ | -3.04 |
| K | K⁺ | -2.92 |
| Ba | Ba²⁺ | -2.90 |
| Ca | Ca²⁺ | -2.87 |
| Na | Na⁺ | -2.71 |
| Mg | Mg²⁺ | -2.37 |
| Al | Al³⁺ | -1.66 |
| Mn | Mn²⁺ | -1.18 |
| Zn | Zn²⁺ | -0.76 |
| Cr | Cr³⁺ | -0.74 |
| Fe | Fe²⁺ | -0.44 |
| Ni | Ni²⁺ | -0.25 |
| Sn | Sn²⁺ | -0.14 |
| Pb | Pb²⁺ | -0.13 |
| H₂ | 2H⁺ | 0.00 |
| Cu | Cu²⁺ | +0.34 |
| Fe | Fe³⁺ | +0.77 |
| Ag | Ag⁺ | +0.80 |
| Hg | Hg²⁺ | +0.85 |
| Pt | Pt²⁺ | +1.20 |
| Au | Au³⁺ | +1.50 |
Nguyên tắc cốt lõi:
- Tính khử: Giảm dần từ trái sang phải (Li là kim loại có tính khử mạnh nhất).
- Tính oxi hóa: Tăng dần từ trái sang phải (ion Au³⁺ có tính oxi hóa mạnh nhất).
3 Mẹo Ghi Nhớ Dãy Điện Hóa Nhanh Nhất
Để nhớ nhanh dãy điện hóa, hãy sử dụng câu thơ ghi nhớ, chia dãy thành các nhóm kim loại (mạnh, trung bình, yếu), hoặc vẽ sơ đồ trực quan để liên kết hình ảnh.
Để ghi nhớ thứ tự phức tạp này, hãy áp dụng các phương pháp đã được chứng minh hiệu quả sau:
1. Mẹo Ghi Nhớ Bằng Câu Thơ (Phổ biến nhất)
Sử dụng câu thơ “Li Khi Ba Cần Nao May Áo Mang Záp Có Sắt Nên Sang Phố Hỏi Cửa Hàng Á Phi Âu” để ghi nhớ thứ tự các kim loại một cách dễ dàng.
Học thuộc câu thơ này, mỗi từ tương ứng với một kim loại. Đây là phương pháp giúp bạn xâu chuỗi các kim loại theo đúng thứ tự một cách tự nhiên và dễ thuộc nhất hiện nay.
2. Mẹo Ghi Nhớ Theo Nhóm Hóa Học
Chia dãy thành 3 nhóm: Kim loại mạnh (Li → Al), Kim loại trung bình (Mn → Pb), và Kim loại yếu (H → Au) để hệ thống hóa kiến thức và giảm tải việc ghi nhớ.
Việc chia nhỏ thông tin giúp bạn quản lý và ghi nhớ logic hơn:
- Nhóm kim loại mạnh (tính khử cao): Li, K, Ba, Ca, Na, Mg, Al. Đây là các kim loại kiềm và kiềm thổ điển hình.
- Nhóm kim loại trung bình: Mn, Zn, Cr, Fe, Ni, Sn, Pb.
- Nhóm kim loại yếu (tính khử thấp): H, Cu, Ag, Hg, Pt, Au.
3. Mẹo Ghi Nhớ Bằng Hình Ảnh và Sơ Đồ
Vẽ một sơ đồ mũi tên, điền tên các kim loại theo thứ tự và ghi chú chiều tăng/giảm của tính khử và tính oxi hóa để tạo ra một công cụ học tập trực quan.
Nếu bạn học tốt qua hình ảnh, hãy thử vẽ một sơ đồ trực quan. Vẽ một mũi tên dài, bên trái ghi “Tính khử mạnh / E° âm”, bên phải ghi “Tính oxi hóa mạnh / E° dương”. Điền các kim loại dọc theo mũi tên và có thể vẽ thêm các hình ảnh minh họa (ví dụ: thỏi vàng cho Au, cục pin cho Li).
Ứng Dụng Thực Tế Của Dãy Điện Hóa
Dãy điện hóa được ứng dụng để dự đoán chiều phản ứng oxi hóa-khử theo quy tắc alpha, xác định sản phẩm của quá trình điện phân và lựa chọn kim loại để chống ăn mòn (bảo vệ điện hóa).
1. Dự Đoán Chiều Phản Ứng Oxi Hóa – Khử (Quy Tắc Alpha)
Quy tắc Alpha phát biểu rằng: Chất khử mạnh (đứng trước) sẽ phản ứng với chất oxi hóa mạnh (đứng sau) để tạo ra chất khử yếu hơn và chất oxi hóa yếu hơn.
Ví dụ: Cho thanh kẽm (Zn) vào dung dịch CuSO₄.
- Bước 1: Xác định hai cặp oxi hóa – khử là Zn²⁺/Zn và Cu²⁺/Cu.
- Bước 2: So sánh vị trí trong dãy điện hóa: Zn đứng trước Cu. Do đó, Zn có tính khử mạnh hơn Cu, và ion Cu²⁺ có tính oxi hóa mạnh hơn ion Zn²⁺.
- Bước 3: Áp dụng quy tắc Alpha, Zn sẽ đẩy Cu ra khỏi muối.
- Phương trình phản ứng: Zn + CuSO₄ ⟶ ZnSO₄ + Cu
2. Xác Định Sản Phẩm Điện Phân
Dãy điện hóa là công cụ không thể thiếu để dự đoán sản phẩm tạo thành tại catot (cực âm) và anot (cực dương) khi điện phân.
- Tại catot (xảy ra sự khử): Cation (ion dương) có tính oxi hóa mạnh hơn (đứng sau trong dãy) sẽ bị khử trước.
- Tại anot (xảy ra sự oxi hóa): Anion (ion âm) hoặc vật liệu làm điện cực có tính khử mạnh hơn sẽ bị oxi hóa trước.
Ví dụ: Điện phân dung dịch NaCl.
- Catot: Dung dịch có Na⁺ và H₂O. Vì H₂O có tính oxi hóa mạnh hơn Na⁺ (thể hiện qua cặp 2H⁺/H₂ có E° = 0.00 V so với Na⁺/Na có E° = -2.71 V), nước sẽ bị khử để tạo ra khí H₂ và ion OH⁻.
- Anot: Dung dịch có Cl⁻ và H₂O. Tùy thuộc vào điện cực và nồng độ, Cl⁻ sẽ bị oxi hóa tạo khí Cl₂.
3. Chống Ăn Mòn Kim Loại (Bảo Vệ Điện Hóa)
Nguyên tắc là dùng một kim loại có tính khử mạnh hơn (kim loại “hy sinh”) để bảo vệ kim loại có tính khử yếu hơn.
Ví dụ: Để bảo vệ vỏ tàu biển làm bằng thép (hợp kim của Fe), người ta gắn các khối kẽm (Zn) lên vỏ tàu. Vì Zn (E° = -0.76 V) có tính khử mạnh hơn Fe (E° = -0.44 V), khi tiếp xúc với nước biển (dung dịch chất điện li), Zn sẽ bị ăn mòn trước, đóng vai trò là anot hy sinh, bảo vệ cho sắt.
Lưu Ý Quan Trọng Khi Sử Dụng Dãy Điện Hóa
- Điều kiện chuẩn: Bảng điện hóa chỉ đúng trong điều kiện chuẩn. Trong thực tế, nồng độ và nhiệt độ có thể làm thay đổi thứ tự và khả năng phản ứng.
- Phản ứng với nước: Các kim loại đứng trước Mg (K, Na, Ca,…) có thể phản ứng trực tiếp với nước ở nhiệt độ thường.
- Phản ứng với axit: Kim loại đứng trước H có thể đẩy H₂ ra khỏi dung dịch axit loãng (như HCl, H₂SO₄ loãng). Đối với các axit có tính oxi hóa mạnh như HNO₃ hay H₂SO₄ đặc, quy tắc này không áp dụng.
Câu Hỏi Thường Gặp (FAQs)
1. Dãy điện hóa dùng để làm gì?
Dãy điện hóa chủ yếu được dùng để dự đoán chiều phản ứng oxi hóa – khử, xác định sản phẩm điện phân, lựa chọn vật liệu chống ăn mòn và thiết lập pin điện hóa.
2. Làm thế nào để nhớ dãy điện hóa nhanh nhất?
Sử dụng các mẹo ghi nhớ như câu thơ, chia nhóm kim loại hoặc vẽ sơ đồ hình ảnh. Lặp lại 5-10 phút mỗi ngày sẽ giúp bạn ghi nhớ lâu dài.
3. Thế điện cực chuẩn E° âm có ý nghĩa gì?
E° âm cho thấy cặp oxi hóa – khử đó có dạng khử (kim loại) hoạt động mạnh, dễ nhường electron và dạng oxi hóa (ion) tương đối bền.
4. Dãy điện hóa có áp dụng cho pin điện hóa không?
Có. Để tạo ra một pin điện hóa, người ta chọn hai cặp oxi hóa – khử khác nhau. Cặp có E° âm hơn sẽ làm cực âm (anot), và cặp có E° dương hơn sẽ làm cực dương (catot) để đảm bảo suất điện động của pin (E°pin) lớn hơn 0, giúp pin hoạt động.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









