Kiến thức chuyên môn
Bạc Nitrat AgNO3 là gì? Tính chất, ứng dụng và cách sử dụng an toàn
Bạc nitrat, với công thức hóa học là AgNO₃, là một hợp chất vô cơ thiết yếu và là muối nitrat của bạc được ứng dụng rộng rãi nhất. Hợp chất này nổi bật với vai trò là một chất oxy hóa mạnh, tiền chất để sản xuất các hợp chất bạc khác, và đặc biệt là ứng dụng trong phản ứng tráng gương kinh điển. Về mặt vật lý, AgNO₃ là một chất rắn kết tinh không màu, dễ dàng hòa tan trong nước và cực kỳ nhạy cảm với ánh sáng.

Tính Chất Vật Lý Quan Trọng Của Bạc Nitrat
Bạc nitrat là chất rắn kết tinh không màu, tan rất tốt trong nước (216 g/100 mL ở 20°C), nóng chảy ở 212°C và rất nhạy cảm với ánh sáng (dễ bị phân hủy thành bạc kim loại màu đen).
Trạng thái & Hình thức: Ở điều kiện tiêu chuẩn, bạc nitrat tồn tại ở dạng tinh thể rắn, không màu hoặc màu trắng, không có mùi đặc trưng.
Độ tan: Tan rất tốt trong nước (216 g/100 mL ở 20°C), một minh chứng cho độ tan vượt trội của nó. Hợp chất này cũng tan trong các dung môi khác như acetone và amoniac.
Nhiệt độ nóng chảy: Nóng chảy ở nhiệt độ 212°C (413.6°F).
Độ nhạy sáng: Bạc nitrat rất nhạy cảm với ánh sáng, đặc biệt là tia cực tím. Khi tiếp xúc với ánh sáng, nó sẽ phân hủy từ từ và chuyển thành kim loại bạc, khiến cho hợp chất có màu xám hoặc đen. Do đó, việc bảo quản hóa chất này luôn đòi hỏi các chai lọ tối màu.
Tính Chất Hóa Học Đặc Trưng Của AgNO₃
Bạc nitrat là một chất điện li mạnh, thể hiện tính oxy hóa mạnh (ion Ag⁺ dễ bị khử), tham gia phản ứng trao đổi tạo kết tủa với ion halogenua, bị nhiệt phân ở nhiệt độ cao và có khả năng tạo phức chất với amoniac.
Là một chất điện li mạnh, bạc nitrat tham gia vào nhiều phản ứng hóa học quan trọng, chủ yếu xoay quanh cation Ag⁺. Các tính chất hóa học của muối được thể hiện rõ nét qua các phản ứng sau:
1. Phản ứng Oxy hóa – Khử
Ion Ag⁺ trong AgNO₃ bị kim loại mạnh hơn (ví dụ: Cu, Zn, Fe) khử thành bạc kim loại (Ag), trong khi kim loại đó bị oxy hóa thành muối tương ứng.
Ion Ag⁺ có thể dễ dàng bị khử thành bạc kim loại (Ag) khi tác dụng với các kim loại hoạt động mạnh hơn như Đồng (Cu). Khi nhúng một dây đồng vào dung dịch bạc nitrat, đồng sẽ tan ra tạo dung dịch đồng(II) nitrat màu xanh lam, và bạc kim loại màu trắng xám sẽ bám trên bề mặt dây đồng.
Cu + 2AgNO₃ ⟶ Cu(NO₃)₂ + 2Ag
2. Phản ứng Trao đổi Ion (Tạo kết tủa)
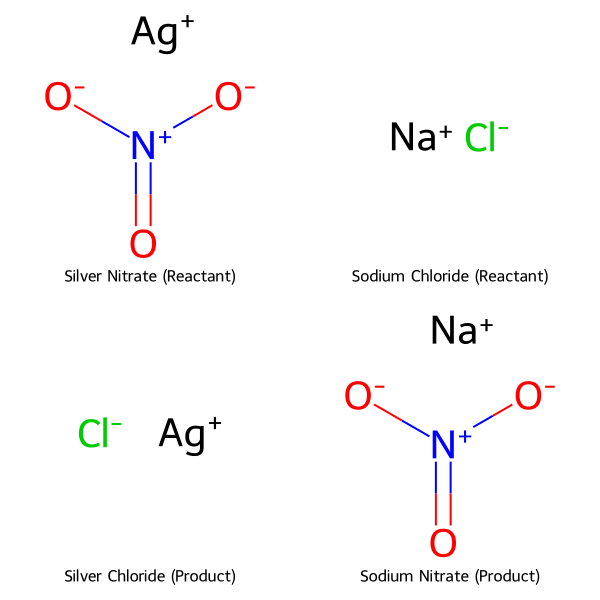
AgNO₃ phản ứng với các dung dịch muối chứa ion halogenua (Cl⁻, Br⁻, I⁻) tạo ra các kết tủa bạc halogenua không tan, điển hình là AgCl (trắng) khi phản ứng với NaCl.
Đây là phản ứng đặc trưng dùng để nhận biết ion bạc (Ag⁺) hoặc các ion halogenua (Cl⁻, Br⁻, I⁻). Khi cho dung dịch bạc nitrat tác dụng với dung dịch Natri Clorua (NaCl), sẽ xuất hiện ngay lập tức chất kết tủa trắng của bạc clorua (AgCl), không tan trong axit.
AgNO₃ + NaCl ⟶ AgCl↓ + NaNO₃
3. Phản ứng Nhiệt phân
Khi đun nóng trên 380°C, AgNO₃ bị phân hủy hoàn toàn thành bạc kim loại (Ag), khí nitơ đioxit (NO₂) và khí oxy (O₂).
Khi đun nóng ở nhiệt độ cao (trên 380°C), bạc nitrat bị phân hủy tạo thành bạc kim loại, khí nitơ đioxit (NO₂, màu nâu đỏ) và khí oxy.
2AgNO₃ –t°--> 2Ag + 2NO₂ + O₂
4. Phản ứng tạo phức
Ion Ag⁺ trong dung dịch AgNO₃ phản ứng với dung dịch amoniac (NH₃) dư tạo thành phức chất tan trong suốt, [Ag(NH₃)₂]NO₃ (diamminsilver(I) nitrate).
Ion Ag⁺ có khả năng tạo phức chất tan với dung dịch amoniac (NH₃). Phản ứng này là nền tảng để tạo ra thuốc thử Tollens, một hợp chất cực kỳ quan trọng trong hóa học hữu cơ.
AgNO₃ + 2NH₃ ⟶ [Ag(NH₃)₂]NO₃
Hướng Dẫn Chi Tiết Phản Ứng Tráng Gương (Thí Nghiệm Tollens)
Phản ứng tráng gương là ứng dụng của thuốc thử Tollens (tạo từ AgNO₃ và NH₃) để oxy hóa andehit, đồng thời khử ion Ag⁺ thành một lớp bạc kim loại sáng bóng bám trên bề mặt dụng cụ thí nghiệm.
Phản ứng tráng gương là một trong những ứng dụng nổi bật và đẹp mắt nhất của bạc nitrat, dùng để nhận biết các hợp chất có nhóm andehit (-CHO).
CẢNH BÁO AN TOÀN TUYỆT ĐỐI
- Luôn đeo kính bảo hộ và găng tay.
- Thực hiện trong tủ hút hoặc nơi thông gió tốt.
- Cực kỳ quan trọng: Thuốc thử Tollens phải được pha chế ngay trước khi sử dụng và không bao giờ được lưu trữ. Sau khi dùng xong, phải axit hóa ngay lập tức với axit loãng để phân hủy. Nếu để lâu, thuốc thử có thể tạo thành hợp chất bạc nitrua (Ag₃N) cực kỳ nhạy nổ.
Nguyên liệu và Dụng cụ:
- Dung dịch AgNO₃ 1%
- Dung dịch NH₃ loãng
- Dung dịch Glucose 5%
- Ống nghiệm sạch, cốc đun, đũa thủy tinh.
Các bước tiến hành:
- Rửa sạch ống nghiệm: Ống nghiệm phải được rửa cực kỳ sạch, tráng bằng nước cất để đảm bảo lớp bạc bám đều và sáng bóng.
- Tạo thuốc thử Tollens [Ag(NH₃)₂]OH:
- Cho khoảng 1-2 mL dung dịch AgNO₃ vào ống nghiệm.
- Nhỏ từ từ từng giọt dung dịch NH₃, vừa nhỏ vừa lắc đều. Ban đầu sẽ xuất hiện kết tủa bạc oxit (Ag₂O) màu nâu đen.
- Tiếp tục nhỏ NH₃ cho đến khi kết tủa tan hoàn toàn, tạo thành một dung dịch trong suốt. Đây chính là thuốc thử Tollens. Tránh dùng thừa amoniac.
- Thực hiện phản ứng:
- Thêm vào ống nghiệm khoảng 1 mL dung dịch glucose.
- Lắc nhẹ rồi đặt ống nghiệm vào cốc nước nóng (khoảng 60-70°C).
Hiện tượng và Giải thích: Sau vài phút, một lớp bạc kim loại sáng bóng sẽ từ từ hình thành và bám vào thành trong của ống nghiệm, tạo ra một chiếc “gương” thu nhỏ. Glucose (một aldehyde) đã khử ion Ag⁺ trong phức [Ag(NH₃)₂]⁺ thành bạc kim loại (Ag). Phương trình hóa học của phản ứng:
C₆H₁₂O₆ + 2[Ag(NH₃)₂]OH ⟶ C₆H₁₂O₇ (Axit gluconic) + 2Ag↓ + 4NH₃ + H₂O
Những Ứng Dụng Quan Trọng Khác Của Bạc Nitrat
AgNO₃ được ứng dụng rộng rãi trong y học (sát khuẩn, loại bỏ mụn cóc), phòng thí nghiệm (thuốc thử phân tích, chuẩn độ), và công nghiệp (sản xuất phim ảnh, tráng gương, mực không phai).

- Trong Y học: Do đặc tính sát khuẩn mạnh, bạc nitrat đã từng được sử dụng (ở nồng độ rất loãng) để nhỏ mắt trẻ sơ sinh nhằm ngăn ngừa nhiễm trùng. Các que chấm chứa bạc nitrat rắn cũng được dùng trong y tế để đốt và loại bỏ các mô thừa như mụn cóc.
- Trong Phòng thí nghiệm: Là một thuốc thử quan trọng trong hóa học phân tích, đặc biệt là trong các phép chuẩn độ để xác định nồng độ các ion halogenua.
- Công nghiệp: Trước đây, bạc nitrat là thành phần cốt lõi trong việc sản xuất phim ảnh và giấy ảnh. Nó cũng được dùng trong sản xuất gương và mực không phai.
An Toàn Khi Sử Dụng và Bảo Quản Bạc Nitrat
Bạc nitrat là chất ăn mòn, độc hại, gây bỏng và làm đen da khi tiếp xúc. Cần phải sử dụng đồ bảo hộ cá nhân và bảo quản trong chai lọ tối màu, đậy kín, đặt ở nơi khô ráo và tránh ánh sáng.
- Tác động sức khỏe: Bạc nitrat là chất ăn mòn và độc hại. Tiếp xúc trực tiếp với da sẽ gây bỏng hóa học và làm da bị nhuộm đen. Tìm hiểu thêm về các tác hại của hóa chất để có biện pháp phòng ngừa.
- Biện pháp an toàn: Luôn sử dụng thiết bị bảo hộ cá nhân (PPE) bao gồm găng tay, kính bảo hộ và áo khoác phòng thí nghiệm.
- Cách bảo quản: Phải được cất giữ trong chai lọ bằng thủy tinh tối màu, có nút đậy kín, đặt ở nơi khô ráo, thoáng mát, và tuân thủ các nguyên tắc chung về an toàn hóa chất.
Câu Hỏi Thường Gặp (FAQ)
Bạc nitrat có độc không?
Có, bạc nitrat độc khi nuốt phải và có tính ăn mòn cao khi tiếp xúc với da, mắt và đường hô hấp. Cần phải xử lý hết sức cẩn thận.
Tại sao da bị đen khi tiếp xúc với AgNO₃?
Da bị đen do ion Ag⁺ trong AgNO₃ bị khử bởi ánh sáng và các hợp chất hữu cơ trên da, tạo thành các hạt bạc kim loại siêu nhỏ có màu đen bám chặt vào lớp biểu bì.
Làm thế nào để loại bỏ vết đen AgNO₃ trên da?
Vết đen này không thể rửa trôi bằng xà phòng. Nó sẽ tự mờ đi và biến mất sau vài ngày đến một tuần khi lớp da chết bên ngoài tự nhiên bong ra.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









