Kiến thức chuyên môn
Bạc (Ag) Hóa Trị Mấy? Giải Đáp Chi Tiết Hóa Trị +1, +2, +3
Khi nghiên cứu về bảng tuần hoàn hóa học, một trong những câu hỏi phổ biến nhất là “Bạc (Ag) hóa trị mấy?”. Câu trả lời chính xác nhất là: Bạc (Ag) có hóa trị phổ biến và ổn định nhất là +1. Tuy nhiên, trong những điều kiện đặc biệt, bạc cũng có thể tồn tại với các số oxi hóa hiếm gặp hơn là +2 và +3.
Bài viết này sẽ phân tích chi tiết từng hóa trị của bạc, so sánh với các kim loại khác và cung cấp những lưu ý quan trọng giúp bạn nắm vững kiến thức nền tảng này.

Hóa Trị +1 Của Bạc: Trạng Thái Phổ Biến và Ổn Định Nhất
Trong hầu hết các hợp chất, bạc (Ag) có hóa trị +1. Đây là hóa trị ổn định và phổ biến nhất do cấu hình electron đặc trưng của nó.
Trong hầu hết các hợp chất và phản ứng hóa học thông thường, bạc luôn thể hiện hóa trị +1.
- Cơ chế xác định: Nguyên tử bạc có cấu hình electron lớp ngoài cùng là 5s¹. Nó có xu hướng dễ dàng nhường đi 1 electron này để tạo thành cation Ag⁺, đạt được cấu hình electron bão hòa bền vững của lớp 4d¹⁰.
- Ví dụ hợp chất điển hình:
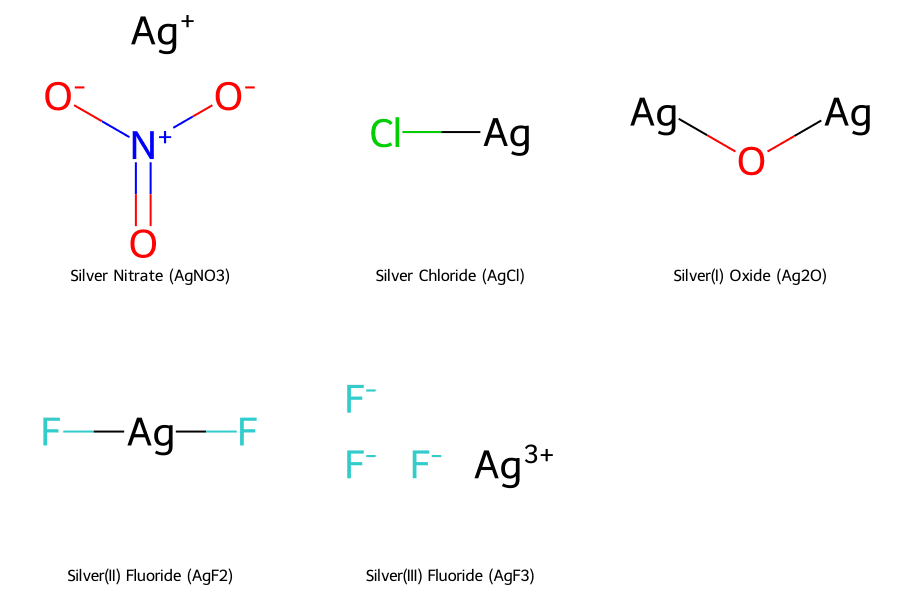
- Bạc nitrat (AgNO₃): Hợp chất được tạo thành từ gốc nitrat ([NO₃⁻]) và ion Ag⁺. Bạc nitrat là một muối quan trọng, được điều chế khi cho bạc kim loại phản ứng với dung dịch axit nitric (HNO₃).
- Bạc clorua (AgCl): Là một muối kết tủa màu trắng, không tan trong nước, hình thành khi ion Ag⁺ gặp ion Cl⁻. Phản ứng này là cơ sở để nhận biết sự có mặt của các ion halogen.
- Bạc oxit (Ag₂O): Là một oxit bazơ, trong đó hai nguyên tử Ag (hóa trị +1) liên kết với một nguyên tử Oxygen (hóa trị -2).
- Ứng dụng thực tế: Dung dịch AgNO₃ thường được dùng làm thuốc thử để nhận biết các ion halogenua (Cl⁻, Br⁻, I⁻) thông qua việc quan sát màu sắc của các chất kết tủa tương ứng.
Hóa Trị +2 Của Bạc: Không Ổn Định và Ít Gặp
Bạc có thể có hóa trị +2 trong các hợp chất không ổn định, thường là khi kết hợp với các nguyên tố có độ âm điện cực mạnh như Flo. Ví dụ điển hình là AgF₂.
Hóa trị +2 là một trạng thái oxi hóa kém bền của bạc, chỉ xuất hiện trong một số hợp chất đặc thù.
- Cơ chế xác định: Bạc phải mất đi 2 electron (một từ 5s¹ và một từ 4d¹⁰). Quá trình này đòi hỏi năng lượng ion hóa lớn, do đó chỉ xảy ra khi bạc phản ứng với các nguyên tố có độ âm điện rất cao như Flo (F).
- Ví dụ hợp chất:
- Bạc(II) fluorua (AgF₂): Là hợp chất điển hình nhất cho hóa trị +2 của bạc. Trong công thức này, Ag (hóa trị +2) liên kết với hai nguyên tử F (hóa trị -1).
- Ứng dụng thực tế: Do tính không ổn định và khả năng oxi hóa cực mạnh, AgF₂ chủ yếu được sử dụng làm chất oxi hóa trong các phòng thí nghiệm và nghiên cứu tổng hợp hóa học chuyên sâu.
Hóa Trị +3 Của Bạc: Cực Kỳ Hiếm và Chỉ Tồn Tại Trong Môi Trường Đặc Biệt
Bạc có hóa trị +3 trong trường hợp cực kỳ hiếm gặp, không bền và chỉ tồn tại trong các hợp chất đặc biệt như AgF₃, được tạo ra trong điều kiện phòng thí nghiệm khắc nghiệt.
Đây là trạng thái oxi hóa cao nhất và kém bền nhất của bạc.
- Cơ chế xác định: Nguyên tử bạc mất cả 3 electron ở lớp ngoài cùng, đòi hỏi một nguồn năng lượng cực lớn và chỉ có thể thực hiện được trong môi trường phản ứng khắc nghiệt với những chất oxi hóa mạnh nhất.
- Ví dụ hợp chất:
- Bạc(III) fluorua (AgF₃): Là hợp chất duy nhất được biết đến của bạc hóa trị +3, được tạo ra trong điều kiện phòng thí nghiệm được kiểm soát nghiêm ngặt.
- Ứng dụng thực tế: AgF₃ không có ứng dụng thương mại và chỉ được sử dụng trong phạm vi nghiên cứu khoa học cơ bản do tính không ổn định và khả năng phân hủy cao.
Bảng So Sánh Nhanh 3 Hóa Trị Của Bạc
| Tiêu Chí | Hóa Trị +1 | Hóa Trị +2 | Hóa Trị +3 |
|---|---|---|---|
| Độ Phổ Biến | Rất cao | Thấp | Cực kỳ hiếm |
| Độ Ổn Định | Ổn định nhất | Kém ổn định | Rất không ổn định |
| Ví Dụ Điển Hình | AgNO₃, AgCl, Ag₂S | AgF₂ | AgF₃ |
| Ứng Dụng Chính | Phân tích hóa học, xi mạ, nhiếp ảnh | Chất oxi hóa mạnh trong phòng lab | Chỉ dùng trong nghiên cứu |
| Điều Kiện Hình Thành | Phản ứng thông thường | Cần phi kim có độ âm điện rất cao (F) | Điều kiện khắc nghiệt, chuyên sâu |
So Sánh Hóa Trị Bạc Với Đồng (Cu) và Vàng (Au)
Bạc, Đồng và Vàng cùng thuộc nhóm 11 trong bảng tuần hoàn nhưng có sự khác biệt rõ rệt về hóa trị:
- Bạc (Ag): Hóa trị chính là +1. Hóa trị +2 và +3 rất hiếm do cấu hình electron [Kr]4d¹⁰5s¹ bền vững.
- Đồng (Cu): Có hai hóa trị phổ biến là +1 và +2. Ion Cu²⁺ tạo ra các dung dịch muối có màu xanh đặc trưng (CuSO₄, CuCl₂) và phổ biến hơn Cu⁺.
- Vàng (Au): Hóa trị chính là +1 và +3. Trạng thái +3 của vàng ổn định hơn đáng kể so với bạc, tạo thành nhiều phức chất quan trọng.
Tính khử của các kim loại này giảm dần theo thứ tự Ag > Cu > Au.
Những Lưu Ý Quan Trọng Khi Xác Định Hóa Trị Bạc
- Quy tắc mặc định: Khi không có điều kiện đặc biệt nào được nêu, hãy luôn giả định bạc có hóa trị +1.
- Cẩn trọng với hợp chất chứa Flo: Các hóa trị +2 và +3 chỉ xuất hiện khi bạc kết hợp với các nguyên tố có độ âm điện cực mạnh, điển hình là Flo.
- Sử dụng quy tắc hóa trị: Để xác định nhanh, hãy áp dụng quy tắc trong một hợp chất vô cơ AₓBᵧ: x × (hóa trị A) = y × (hóa trị B). Ví dụ, trong Ag₂S, biết lưu huỳnh (S) thường có hóa trị -2, ta có 2 × (hóa trị Ag) = 1 × 2, suy ra hóa trị Ag là +1.
Câu Hỏi Thường Gặp (FAQs)
1. Bạc có hóa trị âm không?
Không. Bạc là một kim loại, vì vậy nó luôn có xu hướng nhường electron và chỉ mang hóa trị dương (+1, +2, +3).
2. Tại sao hóa trị +1 của bạc lại phổ biến nhất?
Do cấu hình electron của bạc ([Kr]4d¹⁰5s¹) giúp nó dễ dàng nhường đi 1 electron duy nhất ở lớp 5s để đạt trạng thái bền vững.
3. Hóa trị của bạc trong bạc sulfide (Ag₂S) là bao nhiêu?
Trong Ag₂S, bạc có hóa trị +1. Theo quy tắc hóa trị, hai nguyên tử bạc phải có tổng hóa trị là +2 để cân bằng với hóa trị -2 của lưu huỳnh (S).
4. Làm thế nào để kiểm tra ion Ag⁺ trong phòng thí nghiệm?
Dùng dung dịch chứa ion clorua (Cl⁻) như axit clohidric (HCl) hoặc muối NaCl. Sự xuất hiện của kết tủa trắng AgCl sẽ xác nhận sự có mặt của ion Ag⁺.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →









