Kiến thức chuyên môn
Clo Hóa Trị Mấy? Hướng Dẫn Toàn Diện Về Các Mức Hóa Trị Của Clo
Khi nghiên cứu về nguyên tố Clo (Cl), câu hỏi “Clo hóa trị mấy?” là một trong những thắc mắc phổ biến nhất. Clo, một nguyên tố thuộc nhóm Halogen, không chỉ có một hóa trị duy nhất. Trong hầu hết các hợp chất, Clo thể hiện hóa trị -1, nhưng nó cũng có thể có các hóa trị dương như +1, +3, +5, và +7, tùy thuộc vào nguyên tố mà nó kết hợp.
Bài viết này sẽ cung cấp một cái nhìn sâu sắc và chi tiết về cách xác định hóa trị của Clo, kèm theo các ví dụ minh họa cụ thể giúp bạn nắm vững kiến thức nền tảng này.
Nguyên Tắc Vàng Để Xác Định Hóa Trị Của Clo
Để xác định hóa trị của Clo, hãy dựa vào 4 nguyên tắc chính: cấu hình electron (xu hướng nhận 1e, hóa trị -1), loại liên kết (ion hay cộng hóa trị), quy tắc tổng hóa trị bằng 0 trong hợp chất, và số oxi hóa khi kết hợp với nguyên tố có độ âm điện lớn hơn như Oxi.
1. Dựa vào Cấu Hình Electron
Clo nằm ở ô thứ 17 trong bảng tuần hoàn hóa học, với cấu hình electron [Ne] 3s²3p⁵. Với 7 electron ở lớp ngoài cùng, Clo có xu hướng mạnh mẽ nhận thêm 1 electron để đạt cấu hình octet bền vững. Điều này giải thích tại sao hóa trị phổ biến và ổn định nhất của nó là -1.
2. Trong Hợp Chất Ion
Với các hợp chất hình thành qua liên kết ion, hóa trị của Clo thường là -1. Ví dụ điển hình là Natri Clorua (NaCl). Trong hợp chất này, Natri (Na) có hóa trị +1, do đó Clo sẽ có hóa trị -1 để đảm bảo phân tử trung hòa về điện.
3. Trong Hợp Chất Cộng Hóa Trị
Đối với các hợp chất tạo bởi liên kết cộng hóa trị, hóa trị được xác định bằng số liên kết mà một nguyên tử Clo tạo ra. Trong phân tử Cl₂, mỗi nguyên tử Clo chia sẻ 1 electron với nguyên tử còn lại, tạo ra một liên kết đơn, do đó hóa trị của nó là 1.
4. Dựa vào Số Oxi Hóa
Trong các hợp chất với Oxygen (một nguyên tố có độ âm điện lớn hơn), Clo sẽ có số oxi hóa dương, và giá trị này cũng chính là hóa trị của nó. Đây là trường hợp của các axit chứa oxi của Clo.
Các Hóa Trị Phổ Biến Của Clo Và Các Hợp Chất Tiêu Biểu
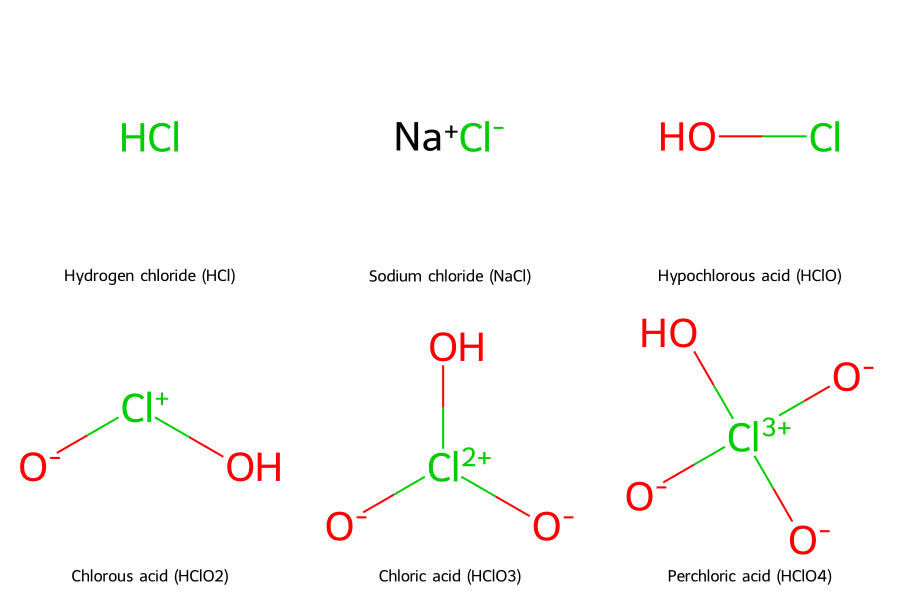
Clo có các hóa trị phổ biến là -1 (trong HCl, NaCl), +1 (HClO), +3 (HClO₂), +5 (HClO₃), và +7 (HClO₄). Hóa trị thay đổi tùy thuộc vào nguyên tố mà nó liên kết.
Bảng dưới đây tổng hợp các hóa trị thường gặp của Clo cùng với các ví dụ minh họa rõ ràng.
| Hóa Trị | Ví Dụ Hợp Chất | Công Thức Hóa Học | Giải Thích Ngắn Gọn |
|---|---|---|---|
| -1 | Axit Clohidric Natri Clorua |
HCl NaCl |
Clo nhận 1 electron từ H hoặc Na để hoàn thành lớp vỏ electron. |
| +1 | Axit Hypoclorơ | HClO | Clo liên kết với một nguyên tử Oxi có độ âm điện cao hơn. |
| +3 | Axit Clorơ | HClO₂ | Clo tạo liên kết với hai nguyên tử Oxi. |
| +5 | Axit Cloric | HClO₃ | Thường gặp trong các muối clorat như Kali clorat (KClO₃). |
| +7 | Axit Percloric | HClO₄ | Đây là trạng thái oxi hóa cao nhất, thể hiện tính oxi hóa mạnh nhất. |
Những Sai Lầm Cần Tránh Khi Xác Định Hóa Trị Clo
Hiểu đúng về hóa trị giúp ích rất nhiều trong việc cân bằng phương trình phản ứng và dự đoán tính chất hóa học. Dưới đây là một số nhầm lẫn thường gặp:
- Nhầm lẫn Hóa trị và Số Oxi hóa: Mặc dù liên quan chặt chẽ, hóa trị là số liên kết còn số oxi hóa là điện tích giả định. Hãy luôn xác định rõ loại hợp chất (ion hay cộng hóa trị) để tránh sai sót.
- Mặc định Clo chỉ có hóa trị -1: Đây là sai lầm phổ biến, bỏ qua vai trò của Clo trong các hợp chất có tính oxi hóa cao. Khi Clo kết hợp với Oxi hoặc Flo, nó sẽ có hóa trị dương.
- Tính sai trong các hợp chất phức tạp: Ví dụ, trong Cl₂O₇, mỗi nguyên tử Clo có hóa trị +7. Luôn áp dụng quy tắc octet và cân bằng electron để đảm bảo tính chính xác.
Mẹo Ghi Nhớ Và Lời Khuyên Chuyên Gia
- Tra Cứu Bảng Tuần Hoàn: Luôn nhớ rằng Clo thuộc nhóm 17 (VIIA), có 7 electron hóa trị, vì vậy hóa trị cơ bản khi nhận electron là 1 (hay -1).
- Học theo dãy Axit: Ghi nhớ dãy axit của Clo là một cách hiệu quả: HCl (-1), HClO (+1), HClO₂ (+3), HClO₃ (+5), HClO₄ (+7).
- Cập nhật kiến thức: Ngành hóa học luôn phát triển. Theo dõi các thông tin mới nhất về Luật Hóa Chất 2025 và các quy định an toàn liên quan đến việc sử dụng và bảo quản hóa chất là rất quan trọng.
Câu Hỏi Thường Gặp (FAQ)
Clo có phải chỉ có một hóa trị duy nhất không?
Không. Hóa trị của Clo rất linh hoạt, dao động từ -1 đến +7 tùy thuộc vào hợp chất mà nó tham gia.
Làm thế nào để tính hóa trị của Clo trong Cl₂O?
Trong hợp chất này, Oxi có hóa trị -2. Để phân tử trung hòa về điện, tổng hóa trị phải bằng 0. Do đó, 2*(hóa trị Cl) + (-2) = 0, suy ra hóa trị của mỗi nguyên tử Clo là +1.
Tại sao Clo có thể có hóa trị dương?
Khi Clo liên kết với một nguyên tố có độ âm điện cao hơn nó (chủ yếu là Oxi và Flo), nó sẽ bị “mất” electron và do đó mang hóa trị dương.
Hóa trị của Clo trong nước Clo là bao nhiêu?
Nước Clo là hỗn hợp của Cl₂ tan trong nước, tạo ra phản ứng thuận nghịch: Cl₂ + H₂O ⇌ HCl + HClO. Trong sản phẩm, Clo trong axit clohidric (HCl) có hóa trị -1, còn Clo trong axit hypoclorơ (HClO) có hóa trị +1.
Để biết thêm thông tin chi tiết về các loại hóa chất công nghiệp và ứng dụng, hãy khám phá các sản phẩm tại cửa hàng hóa chất của chúng tôi.





