Kiến thức chuyên môn
NaHCO₃ là gì? Tất Tần Tật Về Natri Bicarbonat (Baking Soda)
Natri Bicarbonat (NaHCO₃), thường được biết đến với tên gọi baking soda, là một trong những hợp chất vô cơ quan trọng và đa dụng nhất trong đời sống cũng như công nghiệp. Đây là một loại bột trắng, dễ hút ẩm và tan trong nước, tạo ra một dung dịch có tính bazơ yếu.
Bài viết này sẽ cung cấp một cái nhìn sâu sắc và toàn diện về NaHCO₃, từ cấu trúc phân tử, tính chất hóa học, các ứng dụng then chốt cho đến những lưu ý an toàn quan trọng khi sử dụng.
Cấu Trúc Phân Tử và Tính Chất Vật Lý Của NaHCO₃
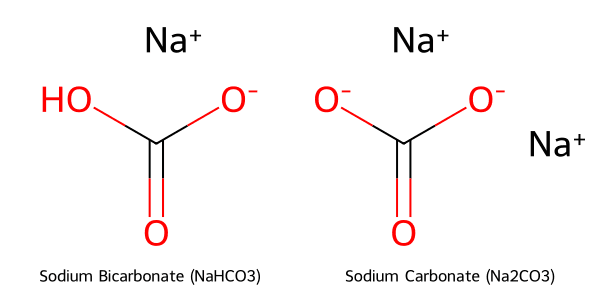
Phân tử NaHCO₃ gồm ion Natri (Na⁺) và ion bicarbonat (HCO₃⁻) liên kết với nhau, tạo thành tinh thể đơn tà màu trắng, có đặc tính hút ẩm cao và dễ bị vón cục.
Phân tử NaHCO₃ được hình thành từ sự kết hợp của ion Natri (Na⁺) và ion bicarbonat (HCO₃⁻), tạo nên cấu trúc tinh thể đơn tà. Một trong những đặc tính vật lý nổi bật của nó là khả năng hút ẩm cao, dễ gây vón cục khi tiếp xúc với không khí ẩm.
Cấu trúc phân tử của NaHCO₃ và Na₂CO₃ được minh họa dưới đây:
Bảng Thuộc Tính Vật Lý Của NaHCO₃
| Thuộc tính | Giá trị | Phương pháp đo đề xuất |
|---|---|---|
| Trạng thái | Bột tinh thể màu trắng | Quan sát trực tiếp |
| Khối lượng riêng | 2.20 g/cm³ | Sử dụng pycnometer |
| Điểm nóng chảy | Phân hủy ở nhiệt độ >50°C | Phân tích nhiệt vi sai (DSC) |
| Độ tan trong nước | 9 g/100 mL ở 20°C | Phương pháp chuẩn độ |
| Độ pH (dung dịch 1%) | Khoảng 8.3 | Đo bằng pH meter |
Để duy trì chất lượng, NaHCO₃ cần được bảo quản hóa chất trong bao bì kín, đặt ở nơi khô ráo và thoáng mát.
Tính Chất Hóa Học Của Natri Bicarbonat
Natri Bicarbonat là một bazơ yếu, có tính lưỡng tính. Nó phản ứng đặc trưng với axit để giải phóng khí CO₂, bị nhiệt phân trên 50°C thành Natri Cacbonat (Na₂CO₃), và không cháy.
NaHCO₃ thể hiện các tính chất hóa học đặc trưng, giúp nó có nhiều ứng dụng quan trọng.
1. Phản ứng với Axit
Là một bazơ yếu, NaHCO₃ phản ứng mạnh với các axit để tạo ra muối, nước và giải phóng khí cacbon đioxit (CO₂). Phản ứng sủi bọt này là dấu hiệu nhận biết đặc trưng của nó.
NaHCO₃ + HCl ⟶ NaCl + H₂O + CO₂
2. Tính Lưỡng Tính Yếu
NaHCO₃ có tính lưỡng tính, nghĩa là nó có thể phản ứng với cả axit và bazơ. Khi tác dụng với một bazơ mạnh như Ca(OH)₂ (vôi tôi), nó tạo ra kết tủa Canxi Cacbonat (CaCO₃).
3. Phản ứng Nhiệt Phân
Khi bị đun nóng trên 50°C, NaHCO₃ bắt đầu phân hủy thành Natri Cacbonat (Na₂CO₃), nước và CO₂. Đây là phản ứng nền tảng cho ứng dụng làm bột nở trong thực phẩm.
2NaHCO₃ (rắn) ⟶ Na₂CO₃ (rắn) + H₂O (hơi) + CO₂ (khí)
4. Tính Không Cháy
NaHCO₃ không bắt lửa. Ngược lại, khi bị nung nóng, nó giải phóng CO₂ có tác dụng dập tắt đám cháy. Vì vậy, nó được ứng dụng như một chất chữa cháy hiệu quả cho các đám cháy nhỏ do dầu, mỡ hoặc điện.
So Sánh Chi Tiết: NaHCO₃ và Na₂CO₃
Điểm khác biệt chính: NaHCO₃ là bazơ yếu, kém bền với nhiệt và dùng trong thực phẩm/y tế, trong khi Na₂CO₃ là bazơ mạnh, bền nhiệt và chủ yếu dùng trong công nghiệp tẩy rửa, sản xuất thủy tinh.
Dù có công thức hóa học gần giống nhau, NaHCO₃ và Na₂CO₃ (Soda Ash) có nhiều điểm khác biệt cơ bản về tính chất và ứng dụng.
| Đặc điểm | NaHCO₃ (Natri Bicarbonat) | Na₂CO₃ (Natri Cacbonat) | Cách Phân Biệt Nhanh |
|---|---|---|---|
| Tính chất | Bazơ yếu, lưỡng tính | Bazơ mạnh | Đo pH: NaHCO₃ ~8.3, Na₂CO₃ ~11 |
| Trạng thái | Bột mịn, dễ hút ẩm | Bột ổn định hơn | NaHCO₃ sủi bọt mạnh khi gặp axit loãng |
| Độ bền nhiệt | Phân hủy ở >50°C | Bền vững, nóng chảy ở 851°C | Phân tích nhiệt (TGA/DSC) |
| Ứng dụng chính | Thực phẩm (bột nở), y tế, dược phẩm | Tẩy rửa công nghiệp, sản xuất thủy tinh | Dựa trên mục đích sử dụng trên bao bì |
Ứng Dụng Đa Dạng Của NaHCO₃ Trong Công Nghiệp
Natri Bicarbonat được ứng dụng rộng rãi trong nhiều ngành: làm bột nở trong thực phẩm, thuốc kháng axit trong y tế, chất tẩy rửa gia dụng, chất cân bằng pH trong xử lý nước và là hóa chất trung gian trong công nghiệp.
Nhờ các tính chất độc đáo của mình, NaHCO₃ được ứng dụng rộng rãi trong nhiều lĩnh vực:
- Công nghiệp thực phẩm: Là thành phần chính trong bột nở, giúp bánh mì, bánh quy nở xốp. Nó cũng được dùng làm phụ gia thực phẩm để điều chỉnh độ pH và làm mềm thịt.
- Y tế và Dược phẩm: Dùng làm thuốc kháng axit để giảm chứng ợ nóng, khó tiêu. Trong y tế, nó được dùng để điều trị nhiễm toan chuyển hóa.
- Chất tẩy rửa và khử mùi: Khả năng trung hòa axit của NaHCO₃ giúp nó trở thành chất tẩy rửa nhẹ nhàng và khử mùi hiệu quả cho tủ lạnh, thảm và các bề mặt khác.
- Xử lý nước: Được sử dụng để điều chỉnh độ pH và độ kiềm trong bể bơi và ao nuôi thủy sản, tạo môi trường sống tối ưu.
- Công nghiệp hóa chất: Đóng vai trò là chất xúc tác và chất trung gian trong nhiều quy trình sản xuất hóa chất khác.
Hướng Dẫn An Toàn và Xử Lý NaHCO₃
Dù an toàn, khi xử lý NaHCO₃ cần đeo đồ bảo hộ (kính, khẩu trang) để tránh hít phải bụi. Bảo quản hóa chất ở nơi khô ráo, thoáng mát và tránh xa các loại axit mạnh.
Mặc dù NaHCO₃ được coi là an toàn, việc tuân thủ các quy tắc xử lý là cần thiết để tránh các tác hại của hóa chất.
- An toàn cá nhân (PPE): Khi làm việc với lượng lớn NaHCO₃ dạng bột, nên đeo kính bảo hộ và khẩu trang để tránh hít phải bụi, có thể gây kích ứng đường hô hấp.
- Xử lý sự cố: Nếu xảy ra rò rỉ, quét khô bột và thu gom. Tránh dùng nước vì có thể làm bột vón cục và khó xử lý.
- Bảo quản: Lưu trữ NaHCO₃ ở nơi khô ráo, thoáng mát, tránh xa các nguồn axit mạnh để ngăn ngừa phản ứng hóa học không mong muốn.
Câu Hỏi Thường Gặp (FAQ)
1. NaHCO₃ được sản xuất như thế nào?
NaHCO₃ được sản xuất thương mại chủ yếu qua công nghệ Solvay, sử dụng amoniac (NH₃), CO₂, muối ăn (NaCl) và nước.
Quá trình này sử dụng các nguyên liệu thô gồm amoniac (NH₃), CO₂, muối ăn (NaCl) và nước để tạo ra NaHCO₃ và amoni clorua (NH₄Cl).
2. NaHCO₃ có ảnh hưởng đến sức khỏe không?
An toàn khi dùng trong thực phẩm với liều lượng cho phép. Hít phải bụi có thể gây kích ứng hô hấp nhẹ; nuốt lượng lớn có thể gây rối loạn điện giải.
Ở liều lượng thông thường trong thực phẩm, NaHCO₃ an toàn. Tuy nhiên, nuốt phải một lượng lớn có thể gây rối loạn điện giải và kiềm hóa máu. Hít phải bụi có thể gây kích ứng nhẹ.
3. NaHCO₃ có thân thiện với môi trường không?
Có, NaHCO₃ được xem là an toàn và thân thiện với môi trường vì có khả năng phân hủy sinh học và không tích tụ độc hại.
Nó có khả năng phân hủy sinh học và không tích tụ trong tự nhiên. Tuy nhiên, việc thải bỏ số lượng lớn cần được kiểm soát để tránh làm thay đổi độ pH của đất và nước.
Nếu bạn đang tìm kiếm một nhà cung cấp uy tín các sản phẩm NaHCO₃ hoặc các hóa chất công nghiệp khác, hãy truy cập
hoachatdoanhtin.com
để biết thêm chi tiết.





